9.4: Cloración vs Bromación
- Page ID
- 76324
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)9.4.1 Monocloración
Primero nos enfocaremos en el producto de monocloración, asumiendo que la cloración solo ocurre una vez. Dado que el cloro es un reactivo bastante reactivo, presenta una selectividad relativamente baja, lo que significa que el Cl 2 no discrimina mucho entre los diferentes tipos de átomos de hidrógenos (primarios, secundarios o terciarios) en un alcano. Como resultado, para la reacción de alcano con diferentes átomos de hidrógeno, se obtiene una mezcla de productos monoclorados isoméricos.

Los resultados experimentales de la monocloración de propano indican que se produce 45% de cloruro primario (1-cloropropano) y 55% de cloruro secundario (2-cloropropano). ¿Cómo explicar este resultado?
Para predecir la cantidad relativa de diferentes productos de cloración, debemos considerar dos factores al mismo tiempo: reactividad y probabilidad.
Se ha discutido en la sección 9.3, que los diferentes radicales (primarios, secundarios o terciarios) tienen diferente estabilidad y reactividad. Se ha medido la velocidad de reacción relativa de los radicales alquilo para la cloración y tiene los valores aproximados de:

La probabilidad simplemente depende de cuántos átomos de hidrógeno hay para cada tipo. Con más átomos de hidrógeno disponibles, la probabilidad de que ese tipo de hidrógeno reaccione es estadísticamente mayor.
Por lo que la cantidad total de cada producto isomérico debe estimarse teniendo en cuenta tanto la reactividad como la probabilidad, es decir:
la cantidad de cierto tipo de producto = número de ese tipo de hidrógenos × reactividad relativa
Para el ejemplo de la monocloración de propano, el cálculo es:
Cantidad de 1-cloropropano: 6 (número de hidrógenos de 1°) × 1.0 (reactividad relativa) = 6.0
Cantidad de 2-cloropropano: 2 (número de hidrógenos de 2°) × 3.8 (reactividad relativa) = 7.6
Rendimiento% de 1-cloropropano: 6.0/13.6 = 44%
rendimiento% de 1-cloropropano 7.6/13.6 = 56%
Los valores calculados son consistentes con los resultados del experimento.
Ejercicios 9.1
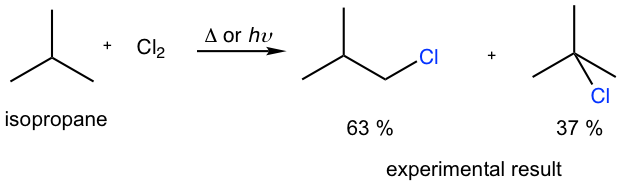
Prediga el rendimiento porcentual de cada producto para la monocloración de isobutano por cálculo y compare sus números calculados con los resultados del experimento. ¿Son consistentes?
Respuestas a las preguntas de práctica Capítulo 9
Para el alcano con un solo tipo de hidrógeno, el problema de la mezcla isomérica puede prevenirse por supuesto ya que solo se produjo un producto. Para la siguiente cloración de cylclopentano, solo se produce un monocloruro.

9.4.2 Multicloración
Si bien suponemos que la cloración ocurre una vez en las discusiones de la última sección, lamentablemente este no es el caso real. Un problema común con la cloración es que la sustitución múltiple siempre ocurre. Un ejemplo sencillo es la cloración del metano, que se obtuvo una mezcla de producto de cloración múltiple como aprendimos antes.

El mecanismo para la formación del producto de multicloración es similar al del monocloruro. Cuando el clorometano (o cloruro de metilo) reacciona con Cl 2, otro hidrógeno se reemplaza por un átomo de cloro para dar diclorometano, el diclorometano reacciona con Cl 2 nuevamente para dar triclorometano, y el triclorometano reacciona más para producir tetraclorometano. Todas las reacciones siguen pasando por pasos de propagación similares con mecanismo radical.
Ejemplos
Mostrar el mecanismo de los pasos de propagación para la formación de diclorometano a partir de clorometano.
Solución:

Prácticamente, para minimizar el problema de los productos de multicloración, las condiciones de reacción se pueden controlar de ciertas maneras, por ejemplo:
- Utilizar alta concentración de alcano en relación con Cl 2, para disminuir la posibilidad de multicloración;
- Tiempo de reacción de control: detener la reacción después de un tiempo “corto” para favorecer el producto de monocloración.
Estos métodos ayudan a reducir la cantidad de productos de multicloración, pero el problema aún no se puede evitar por completo.
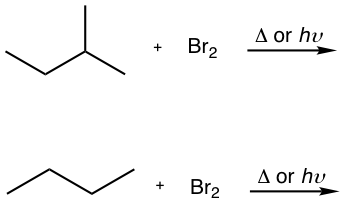
9.4.3 Bromación
Debido a los dos problemas principales para la cloración, falta de selectividad y multisustitución, la cloración no es útil como método de síntesis para preparar un producto específico de haluro de alquilo. En cambio, la bromación con Br 2 se puede aplicar para ese propósito. La reactividad relativamente menor del bromo lo hace exhibir una selectividad mucho mayor. El bromo es menos reactivo, significa que reacciona más lentamente, por lo tanto tiene oportunidad de diferenciar entre los diferentes tipos de hidrógenos, y reacciona selectivamente con el más reactivo. Aquí se muestra la velocidad de reacción relativa de bromación para diferentes radicales, y se puede ver la gran diferencia con la de la cloración:

Para la bromación, la diferencia de reactividad entre diferentes tipos de posición es tan alta que el factor de reactividad se vuelve predominante para determinar el producto. Por lo tanto, la bromación suele ocurrir selectivamente en la posición más reactiva (la posición que forma el intermedio radical carbonado más estable), y da un producto principal exclusivamente, como el ejemplo aquí para la bromación de isobutano.

Como resultado, la bromación tiene la mayor utilidad de síntesis de haluro de alquilo.
Ejercicios 9.2
Mostrar el principal producto de bromación de las siguientes reacciones.