10.2: Reacciones de Alquenos- Adición de Halogenuros de Hidrógeno a
- Page ID
- 76396
Los alquenos experimentan una gran variedad de reacciones. A primera vista, estas reacciones parecen ser bastante diferentes, sin embargo, estudios detallados indicaron que los diferentes mecanismos comparten algunas características comunes. El doble enlace es el centro de reactividad del alqueno, esto se debe principalmente a los electrones π relativamente holgados del doble enlace. El enlace π está formado por solapamiento lado a lado, el modo de superposición débil relativo, por lo que el enlace π es débil y exhibe una alta reactividad. Los electrones π también hacen que los carbonos de doble enlace sean ricos en electrones, y tienen la tendencia a ser atraídos por un electrófilo. La alta reactividad hace que los alquenos sean un tipo importante de compuestos orgánicos, y pueden ser utilizados para la síntesis una amplia variedad de otros compuestos, como haluro, alcohol, éteres, alcanos.
El tipo de reacción más común para el alqueno es la reacción de adición al doble enlace C=C. Además de la reacción, se agrega una molécula pequeña al enlace múltiple y un enlace π se convierte en dos enlaces σ (el grado de saturación disminuye) como resultado de la adición. La reacción de adición es el proceso opuesto a la eliminación.
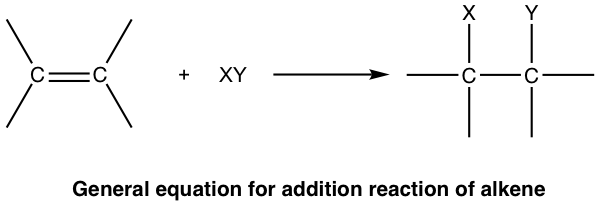
Las reacciones de adición generalmente se pueden categorizar dependiendo de qué molécula pequeña agregó, nuestras siguientes discusiones también se basarán en eso.
10.2.1 Adición de haluro de hidrógeno a alquenos
La reacción de adición de un haluro de hidrógeno a un alqueno produce un haluro de alquilo como producto. Para ejemplos:


En las reacciones anteriores, los alquenos están en estructuras simétricas, es decir, no importa qué carbono se deshuesó con hidrógeno y qué carbono enlazó el halógeno, el mismo producto se obtendrá de cualquier manera.
Para el alqueno que no tiene la estructura simétrica, los carbonos de doble enlace tienen diferentes sustituyentes, entonces la cuestión de qué carbono obtiene el hidrógeno es muy crítica. Para el ejemplo de la siguiente reacción, se podrían producir dos posibles productos, 2-bromo-2-metilpropano y 1-bromo-2-metilpropano, ¿cuál se forma realmente? ¿O ambos están formados?
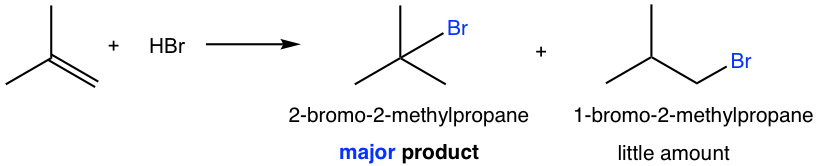
Resulta que el 2-bromo-2-metilpropano es el producto principal para la reacción. Para explicar y comprender el resultado de la reacción, necesitamos mirar el mecanismo de la reacción como siempre lo hacemos.
El mecanismo de la reacción de adición implica dos etapas (que se muestran a continuación). En el primer paso, los electrones π del alqueno actúan como nucleófilos y son atraídos por el hidrógeno parcialmente cargado positivamente (electrófilo) de HBr. A medida que los electrones π de los alquenos se mueven hacia el hidrógeno, el enlace H-Br se rompe, con Br se aleja con los electrones de enlace, y se forma un nuevo enlace σ entre un carbono de doble enlace e hidrógeno. Un carbocatión y un bromuro, Br —, se forman en este paso.
En la segunda etapa, el bromuro, Br —, reacciona con el carbocatión cargado positivamente para dar el producto final. Esta etapa es algo similar a la segunda etapa de la reacción de S N 1, en la que un nucleófilo reacciona con electrófilo (carbocatión).
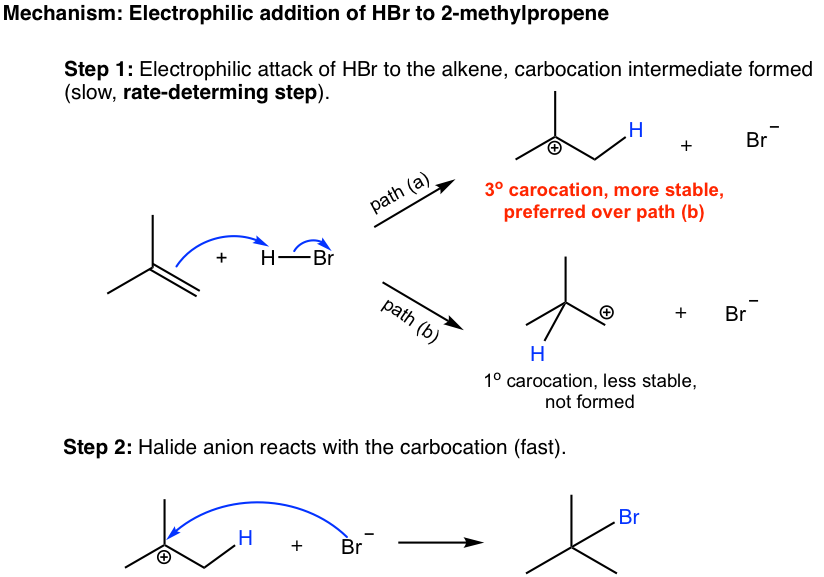
Cuando el nuevo sbond se formó entre carbono de doble enlace e hidrógeno en la primera etapa, el hidrógeno posiblemente podría enlazarse con cualquiera de los dos carbonos, como se muestra en la ruta (a) y (b), y se producirán los carbocationes con diferente estructura. Es obvio decir que el carbocatión terciario formado en la ruta (a) es mucho más estable que el carbocatión primario en la ruta (b), y se producirá preferiblemente. El carbocatión terciario es entonces atacado por el Br —en la segunda etapa, que produce el producto 2-bromo-2-metilpropano. Es la diferencia de estabilidad entre dos carbocationes en el primer paso lo que da cuenta de la formación selectiva de 2-bromo-2-metilpropano de la reacción global.
Debido a que el primer paso de la reacción anterior es la adición de un electrófilo (H +) al alqueno, la reacción se denomina reacción de adición electrófila. La reacción de adición electrófila es un tipo característico de reacción de alquenos, varias otras reacciones de adición que veremos más adelante también pertenecen a esta categoría.
Los dos posibles productos de esta reacción son isómeros constitucionales entre sí. Para la reacción en la que podrían obtenerse como productos dos o más isómeros constitucionales, pero predomina uno de ellos, se dice que la reacción es una reacción regioselectiva. Regio proviene del vocablo latino regionem que significa dirección. La tendencia regioselectiva de la adición electrófila de HX a los alquenos había sido resumida como regla de Markovnikov por el químico ruso Vladimir Markovnikov. Una forma de afirmar la regla de Markovnikov es que en la adición de HX a un alqueno, el átomo de hidrógeno se suma al doble enlace carbono que tiene mayor número de átomos de hidrógeno.
El razonamiento subyacente para la regla de Markovnikov es la estabilidad del carbocatión intermedio que interviene en el mecanismo de reacción. Te parece fácil simplemente memorizar la regla o simplemente memorizar el hecho de que el 2-bromo-2-metilpropano es el producto para la reacción anterior, sin entender por qué. Sin embargo, pronto notarás que tu memorización se verá abrumada y mezclada con muchas más reacciones que se avecinan. La manera adecuada de estudiar las reacciones orgánicas es aprender y comprender el mecanismo, unificar los principios de las reacciones basadas en el mecanismo. El dominio de los contenidos será mucho más fácil y mucho más divertido de esta manera, en lugar de tratar de memorizar toneladas de reacciones.
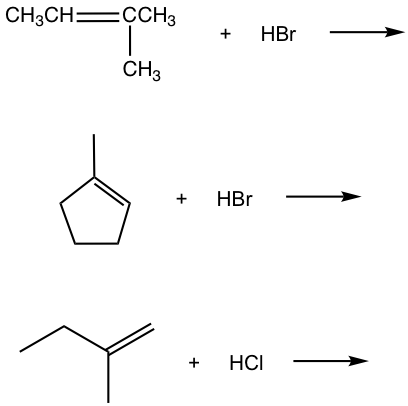
Ejercicios 10.1
Respuestas a las preguntas de práctica Capítulo 10
Ejercicios 10.2
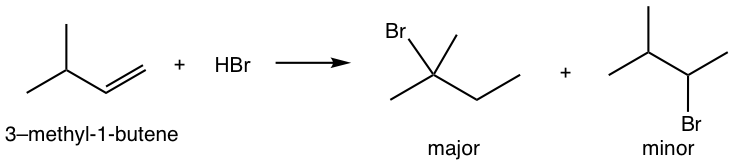
Para la adición de HBr a 3-metil-1-buteno, se observaron dos productos. Mostrar el mecanismo de reacción para explicar la formación de ambos productos.
10.2.2 Adición Radical de HBr a Alquenos
En última sección aprendimos que la adición electrófila de HX al alqueno da productos de adición que siguen la regla de Markovnikov. Aquí aprenderemos que el bromhidrato, HBr, también puede agregar al alqueno de una manera que le da producto anti-Markovnikov.
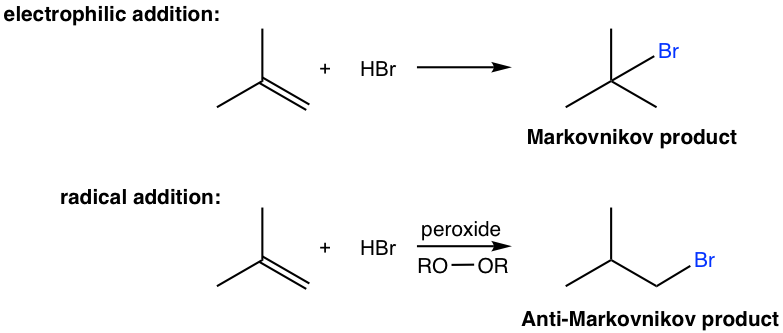
El producto anti-Markovnikov se obtiene a través de diferentes mecanismos, es decir, el mecanismo radical. Para iniciar el mecanismo radical, el peróxido debe estar involucrado para generar el radical en la etapa de inicio del mecanismo. El enlace O-O del peróxido es débil (con energía de enlace de aproximadamente 150 kJ/mol), y experimenta la escisión homolítica fácilmente con calor para producir radicales alcoxilo. Por lo tanto, el peróxido actúa como iniciador de radicales generando radicales, y la adición se denomina adición radical. El mecanismo detallado de adición de radicales de la adición anterior de HBr a 2-metilpropeno se da aquí.
Mecanismo de adición radical:
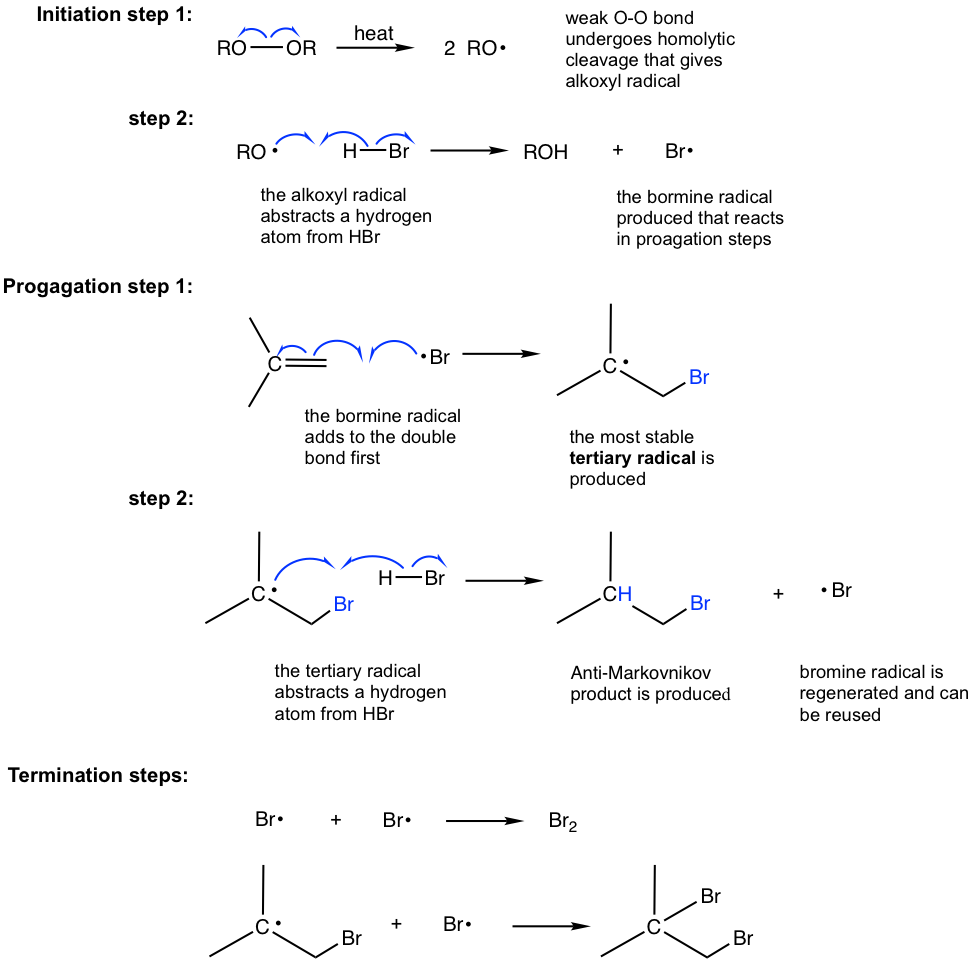
La iniciación implica dos etapas para el mecanismo de adición radical. El radical alcoxilo generado en la etapa 1 reacciona con H-Br para generar el radical bromo, Br·, que reacciona con alqueno para iniciar la reacción en cadena en etapas de propagación. Se demostró claramente en las etapas de propagación que el orden de la adición se invierte en adición radical comparando con el de la adición electrófila. Específicamente, el radical bromo (Br) se agrega al doble enlace primero seguido de la abstracción del átomo de hidrógeno (H), por lo que se produce como resultado el producto anti-Markovnikov.
Una nota más es que solo HBr procede con adición radical en presencia de peróxido, no HCl o HI.


