10.4: Reacciones de Alquenos- Adición de Bromo y Cloro a Alquenos
- Page ID
- 76408
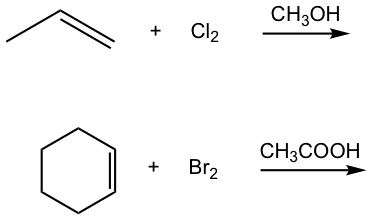
La reacción de adición también ocurre fácilmente entre halógenos (Br 2 y Cl 2) y alquenos. En presencia de disolvente aprótico, el producto es un dihaluro vecinal, como se muestra aquí para la adición de cloro al propeno.
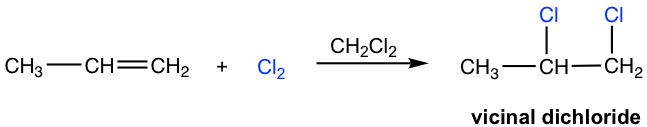
La reacción entre doble enlace C=C y bromo (Br 2) puede ser utilizada como prueba de la presencia de alqueno en una muestra desconocida. El reactivo de bromo es de color rojizo, y el producto dibromuro vecinal es incoloro. Cuando se agrega bromo a la muestra, si el color rojizo desaparece, eso significa que la muestra sí contiene un alqueno. La reacción de adición se produce para obtener bromo rojizo consumido y se forma producto incoloro, por lo que el color se desvanece.
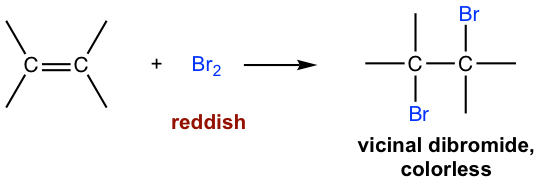
Mecanismo para la Adición de Halógenos a Alquenos
Los productos para la adición de halógeno a los alquenos parecen sencillos, con cada halógeno agregado a cada carbono de doble enlace. Sin embargo, la adición procede con una característica estereoquímica única que requiere atención especial. Resulta que los átomos de halógeno se agregan vía anti adición al doble enlace, como ejemplos se muestran aquí:
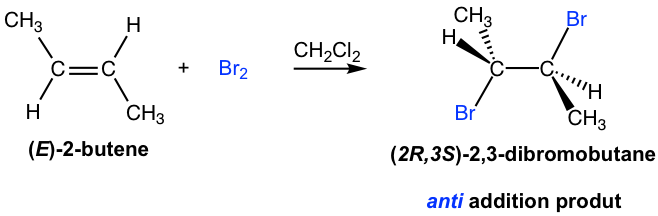
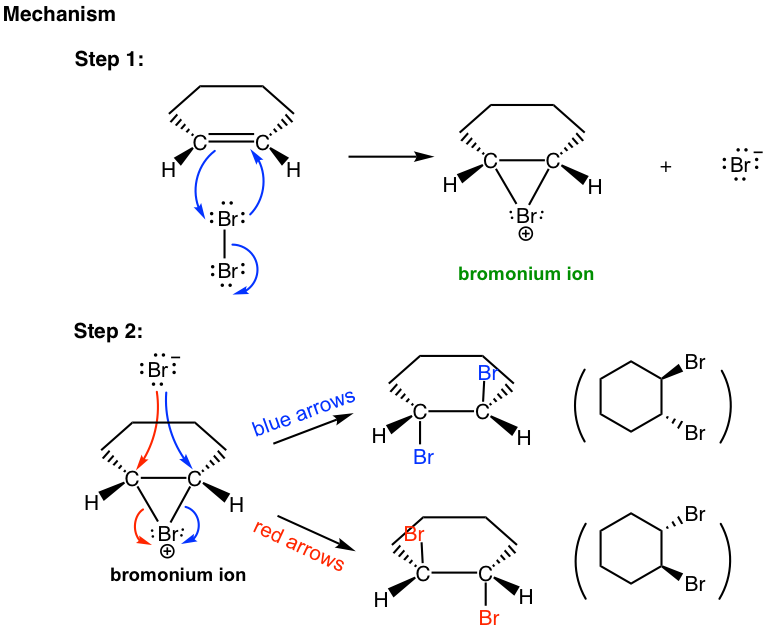
El mecanismo que da cuenta de la anti adición de halógeno involucra los pares de electrones transferidos de una manera diferente a lo que estamos familiarizados, y la formación del intermedio de iones halonio cíclico. Tomaremos como ejemplo la adición de bromo al (E) -2-buteno para explicar el mecanismo.
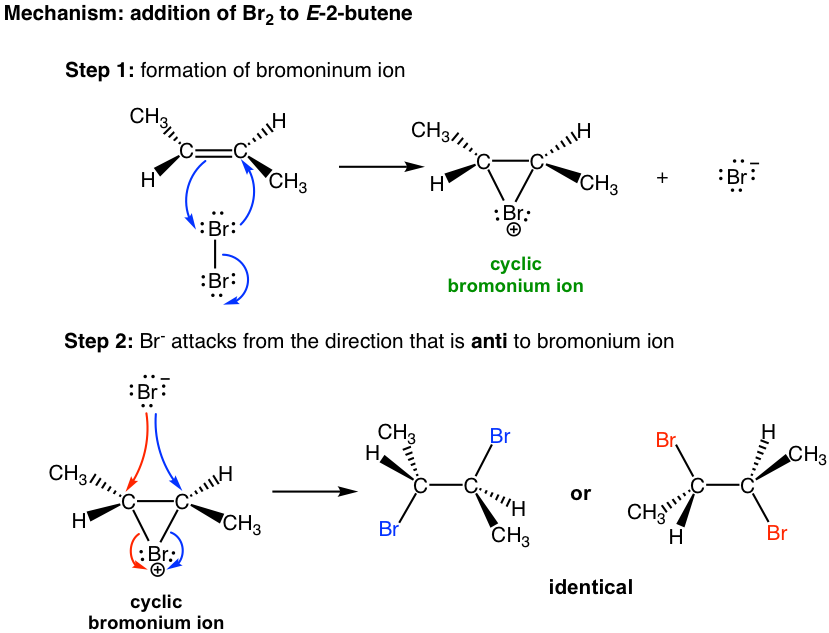
Cuando la molécula Br 2 se acerca al alqueno en el primer paso, la densidad electrónica del enlace π en alqueno repele la densidad electrónica en el bromo, polarizando la molécula de bromo y haciendo que el átomo de bromo que está más cerca del doble enlace electrófilo. El alqueno dona un par de electrones π al bromo más cercano, provocando el desplazamiento del átomo de bromo que está más lejos. El par solitario en el átomo de bromo más cercano actúa entonces como nucleófilo para atacar al otro carbono sp 2. Así, el mismo átomo de bromo es tanto electrófilo como nucleófilo, y se forman dos enlaces simples entre los dos carbonos sp 2 y el bromo más cercano que da el intermedio de ion bromonio cíclico.
En el segundo paso, el bromuro nucleofílico, Br — (generado en el paso 1), ataca el carbono del intermedio cíclico. Dado que el lado inferior del intermedio está bloqueado por el anillo, el Br — solo puede atacar desde el lado superior, eso da como resultado la anti posición de los dos Br en el producto. El ataque es similar a la reacción de S N 2 y provoca que el anillo se abra y la formación de dibromuro vecinal. Para el ejemplo anterior, los dos carbonos en el intermedio del ion bromonio están en el mismo ambiente químico, por lo que ambos tienen la misma oportunidad de ser atacados por Br —, como se muestra en flechas azules y rojas. Los dos ataques dan como resultado el mismo producto, el compuesto meso (2R,3S) -2,3-dibromobutano, en esta reacción.
A continuación, examinemos la adición de bromo al (Z) -2-buteno. Como es de esperar, la reacción pasa por el mismo mecanismo que involucra al intermedio de ion bromonio cíclico, sin embargo los productos tienen diferentes características estereoquímicas.
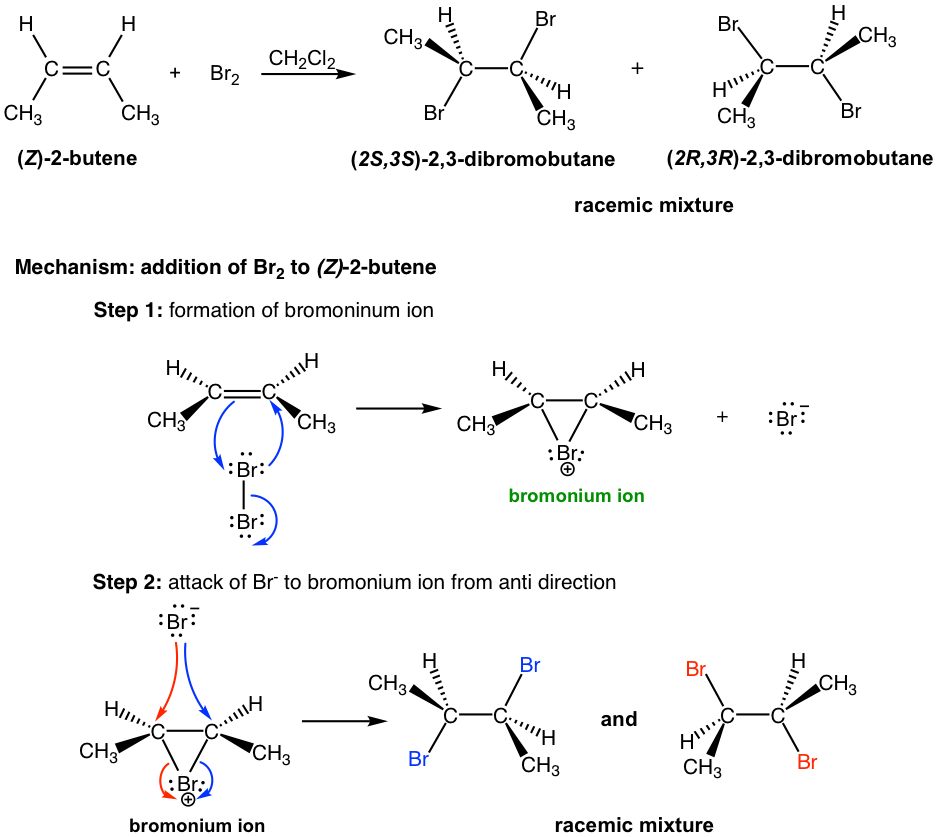
En la adición de Br 2 a (Z) -2-buteno, el ataque de Br — a cualquiera de carbono en el ion bromonio siguiendo la flecha azul o roja da como resultado diferentes enantiómeros (etapa 2 en el mecanismo anterior). Dado que ambos carbonos tienen la misma posibilidad de ser atacados, por lo que el producto es la mezcla racémica 50:50 de los dos enantiómeros.
Partiendo de los dos diastereómeros diferentes, (E) -2-buteno y (Z) -2-buteno, la reacción de adición produce diferentes estereoisómeros. La adición de (E) -2-buteno da un producto, el compuesto meso (2R,3S) -2,3-dibromobutano, mientras que la adición de (Z) -2-buteno produce la mezcla racémica de dos enantiómeros, (2S,3S) -2,3-dibromobutano y (2R,3R) -2,3-dibromobutano. Tal reacción, aquella en la que un estereoisómero particular del material de partida produce un estereoisómero específico del producto se denomina reacción estereoespecífica. La anti adición de un halógeno a un alqueno es un ejemplo de una reacción estereoespecífica.
Ejemplos
Mostrar el producto de la siguiente adición.
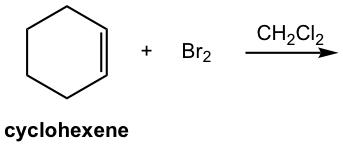
Soluciones:
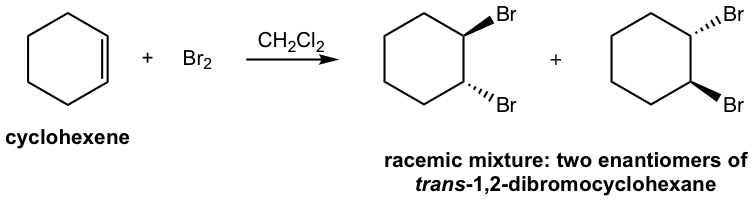
La formación del producto mezcla racémica puede explicarse por el mecanismo:
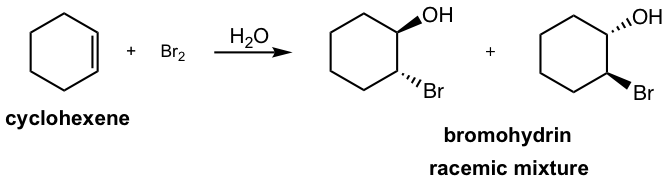
Si se usa agua como disolvente en la reacción, en lugar de CH 2 Cl 2, entonces el agua toma parte de la reacción y actúa como nucleófilo para atacar el intermedio de halonio cíclico en la segunda etapa. El producto principal de la adición será una halohidrina vecinal como resultado. Una halohidrina vecinal es el compuesto que contiene un halógeno y un grupo OH en dos carbonos adyacentes.
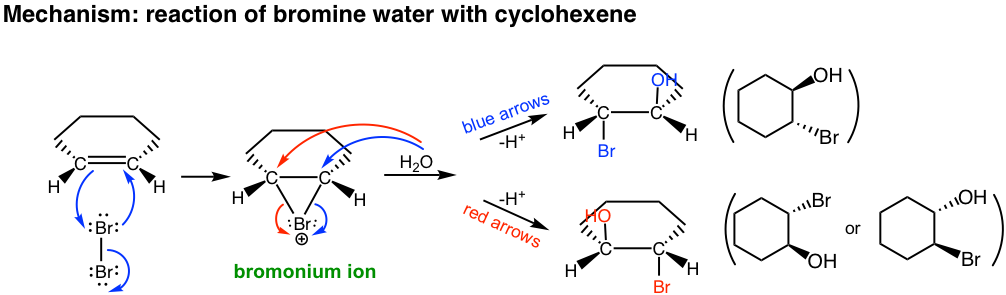
En el segundo paso del mecanismo, tanto H 2 O (disolvente) como Br — (producido en el primer paso) son nucleófilos y tienen oportunidad de reaccionar con el ion bromonio cíclico. Sin embargo como H 2 O es el disolvente, su concentración es mucho mayor que la de Br —, por lo que los principales productos provienen del ataque de H 2 O.
Esta reacción sigue siendo la reacción estereoespecífica en la que se produce la anti adición, que el halógeno y el grupo OH están en posición anti. Para el ejemplo anterior, se obtiene la adición de agua de bromo a ciclohexeno, la mezcla racémica con ambos enantiómeros.
Si el alqueno no está en estructura simétrica, se observa que la adición también muestra la regioselectividad, específicamente el halógeno se suma en el átomo de carbono con mayor número de átomos de hidrógeno, y el grupo OH termina en el carbono de doble enlace con menor cantidad de átomos de hidrógeno. ¿Cómo explicar esto?
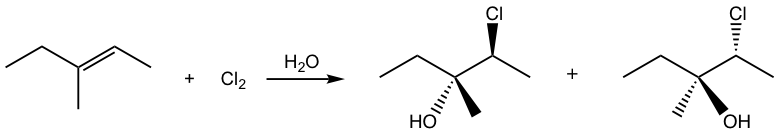
Esto se debe a la diferencia entre los dos carbonos de doble enlace en el intermedio cíclico. Cuando el agua nucleofílica ataca, el enlace C-Br comienza a romperse y el átomo de carbono tiene cargas positivas parciales. El átomo de carbono con dos sustituyentes tiene más cargas positivas y se asemeja al carbocatión terciario más estable, y el otro átomo de carbono con un sustituyente muestra carácter de carbocatión secundario. Como resultado, el ataque al carbono con más carácter de carbocatión terciario es más preferible.

Ejercicios 10.4
Mostrar producto (s) principal (s) de las siguientes reacciones: