9.2: Descripción general de los grupos fosfato
- Page ID
- 72472
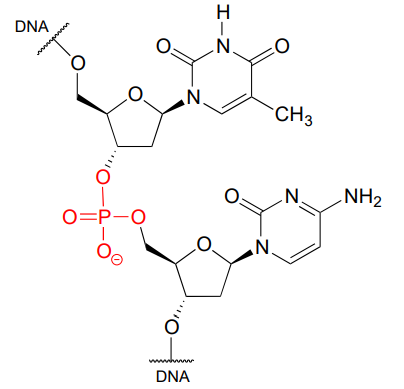
El fosfato está en todas partes en bioquímica. Como se nos recordó en la introducción a este capítulo, nuestro ADN está ligado por fosfato:
La función de muchas proteínas está regulada - encendida y apagada - por enzimas que unen o eliminan un grupo fosfato de las cadenas laterales de residuos de serina, treonina o tirosina.
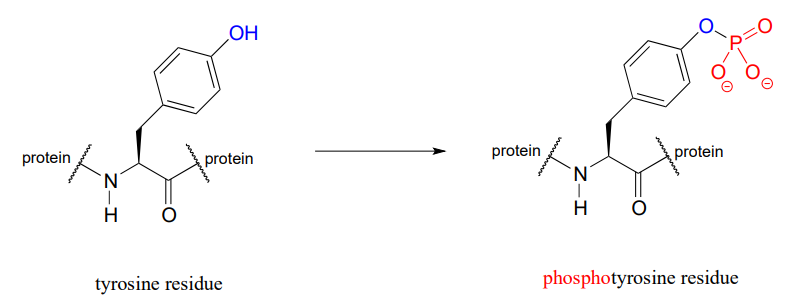
Innumerables enfermedades son causadas por defectos en las enzimas transferibles de fosfato. Como solo un ejemplo, la acondroplasia, una causa común de enanismo, es causada por un defecto en una enzima cuya función es transferir un fosfato a un residuo de tirosina en una proteína de señalización relacionada con el crecimiento.
Por último, los fosfatos son excelentes grupos de salida en las reacciones orgánicas biológicas, como veremos muchas veces a lo largo del resto de este libro.
Claramente, la comprensión de la química de los fosfatos es fundamental para el estudio de la química orgánica biológica. Comenzaremos con una visión general de los términos utilizados cuando se habla de fosfatos.
Términos y abreviaturas
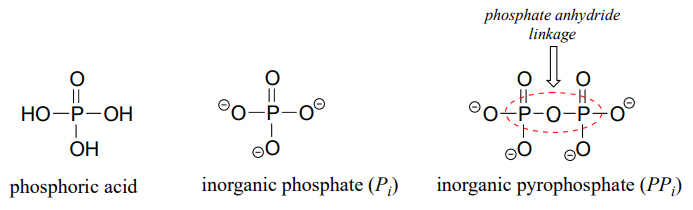
La base conjugada completamente desprotonada del ácido fosfórico se llama ion fosfato, o fosfato inorgánico (a menudo abreviado '\(P_i\)'). Cuando dos grupos fosfato están unidos entre sí, el enlace en sí se conoce como un 'anhídrido de fosfato', y el compuesto se llama 'pirofosfato inorgánico' (a menudo abreviado\(PP_i\)).
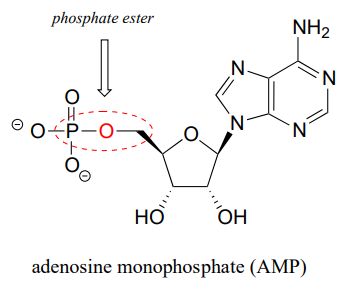
El enlace químico entre fosfato y un átomo de carbono es un éster de fosfato. El monofosfato de adenosina (AMP) tiene un solo enlace éster fosfato.
El trifosfato de adenosina tiene un enlace éster fosfato y dos enlaces anhídrido fosfato.
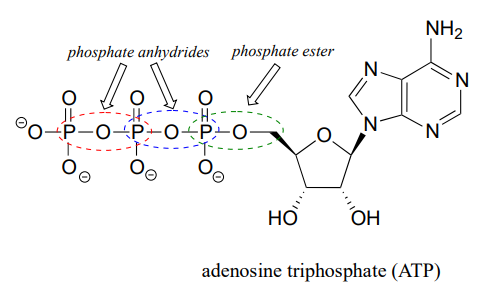
Los átomos de oxígeno en los grupos fosfato se denominan “puente” o “no puente”, dependiendo de su posición. Un difosfato orgánico tiene dos oxígenos puente (uno en el enlace éster fosfato y otro en el enlace anhídrido fosfato) y cinco oxígenos no puente:
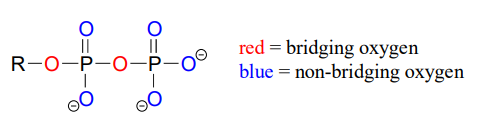
Un solo fosfato se une a dos grupos orgánicos se llama fosfato diéster. El esqueleto del ADN está unido por diésteres de fosfato.

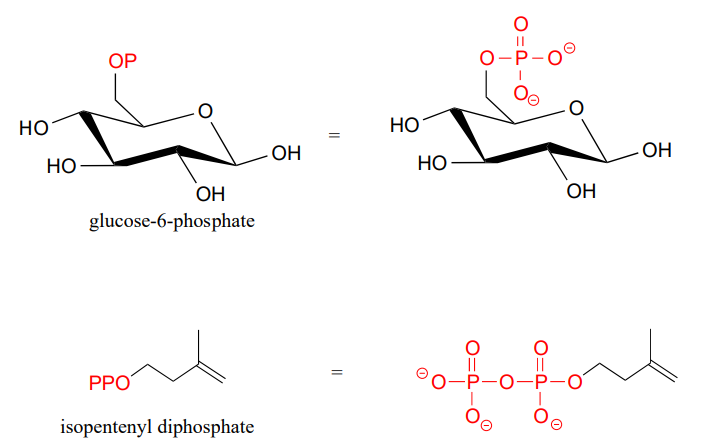
Los fosfatos orgánicos a menudo se abrevian usando\(OP\) '' y\(OPP\) '' para mono y difosfatos, respectivamente. Por ejemplo, la glucosa-6-fosfato y el difosfato de isopentenilo a menudo se representan como se muestra a continuación. Observe que la abreviatura 'P' incluye los átomos de oxígeno asociados y las cargas negativas.
Considere los compuestos biológicos a continuación, algunos de los cuales se muestran con estructuras abreviadas:

- Para cada compuesto, especifique el número de oxígenos puente y no puente en el grupo fosfato.
Constantes ácidas y estados de protonación
El ácido fosfórico es triprótico, lo que significa que tiene tres protones ácidos disponibles para donar, con\(pK_a\) valores de 1.0, 6.5 y 13.0, respectivamente. (da Silva y Williams)
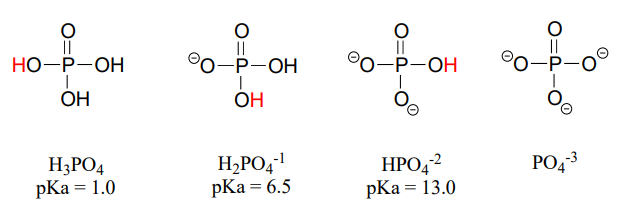
Estos valores constantes de ácido, junto con la ecuación de Henderson-Hasselbalch (sección 7.2) nos dicen que, a la fisiología\(pH\) de aproximadamente 7, algo más de la mitad de las especies de fosfato estarán en el\(HPO_4^{-2}\) estado, y ligeramente menos de la mitad estarán en el\(H_2PO_4^{-1}\) estado, lo que significa que la carga neta promedio está entre -1.5 y -2.0.
Los diésteres de fosfato tienen una\(pK_a\) de aproximadamente 1, lo que significa que llevan una carga negativa completa en fisiológico\(pH\).
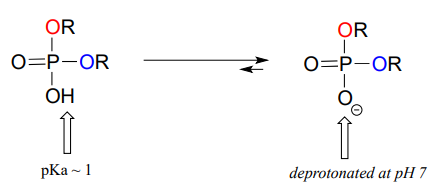
Los monofosfatos orgánicos, los difosfatos y los trifosfatos tienen cargas negativas netas y están parcialmente protonados en condiciones fisiológicas\(pH\), pero por convención generalmente se dibujan en estado completamente desprotonado.
Explique por qué el segundo\(pK_a\) de ácido fosfórico es tanto mayor que el primero\(pK_a\).
¿Cuál es la carga neta aproximada de fosfato inorgánico en una solución tamponada para\(pH 1\)?
Recordemos de la sección 8.4 que los buenos grupos salientes en las reacciones orgánicas son, por regla general, bases débiles. En las reacciones orgánicas de laboratorio, los grupos salientes suelen ser haluros o toluenosulfonatos (sección 8.4), ambos de los cuales son bases débiles. En las reacciones orgánicas biológicas, los fosfatos son grupos salientes muy comunes. Estos podrían ser fosfato inorgánico, pirofosfato inorgánico o monofosfatos orgánicos, todos los cuales son débilmente básicos, especialmente cuando se coordinan a cationes metálicos como\(Mg^{+2}\) en el sitio activo de una enzima. Veremos muchos ejemplos de grupos de hojas de fosfato en este y capítulos posteriores.
Adhesión en fosfatos
Al observar la ubicación del fósforo en la tabla periódica, podría esperarse que se una y reaccione de manera similar al nitrógeno, que se encuentra justo encima de él en la misma columna. En efecto, las fosfinas-análogos de fósforo de las aminas- son comúnmente utilizadas en el laboratorio orgánico.
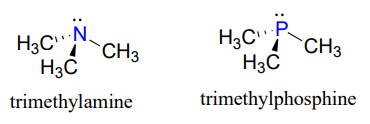
Sin embargo, es en forma de fosfato, más que fosfina, donde el fósforo juega su papel principal en la biología.
Los cuatro sustituyentes de oxígeno en los grupos fosfato están dispuestos alrededor del átomo central de fósforo con geometría tetraédrica, sin embargo hay un total de cinco enlaces a fósforo - cuatro enlaces s y un\(\pi \) enlace deslocalizado.

El fósforo puede romper la 'regla del octeto' porque está en la tercera fila de la tabla periódica, y así tiene\(d\) orbitales disponibles para la unión. La carga menos 3 en un ion fosfato completamente desprotonado se extiende uniformemente sobre los cuatro átomos de oxígeno, y cada enlace fósforo-oxígeno puede considerarse que tiene 25% de carácter de doble enlace: en otras palabras, el orden de enlace es 1.25.
Recordemos de la sección 2.1 la imagen de unión híbrida para el nitrógeno tetraédrico en un grupo amina: uno simple\(2s\) y tres\(2p\) orbitales se combinan para formar cuatro orbitales\(sp^3\) híbridos, tres de los cuales forman enlaces s y uno de los cuales contiene un par solitario de electrones.
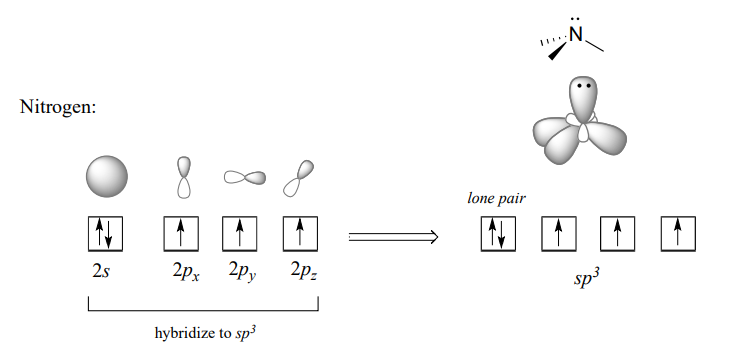
En la imagen orbital híbrida para el ion fosfato, uno\(3s\) y tres\(3p\) orbitales también se combinan para formar cuatro orbitales\(sp^3\) híbridos con geometría tetraédrica. En contraste con una amina, sin embargo, cuatro de los cinco electrones de cenefa en fósforo ocupan\(sp^3\) orbitales, y el quinto ocupa un\(3d\) orbital no hibridado.

Esta disposición orbital permite cuatro enlaces s con geometría tetraédrica además de un quinto\(p\) enlace deslocalizado formado por\(p\) superposición entre el\(3d\) orbital semilleno en fósforo y\(2p\) orbitales en los átomos de oxígeno.
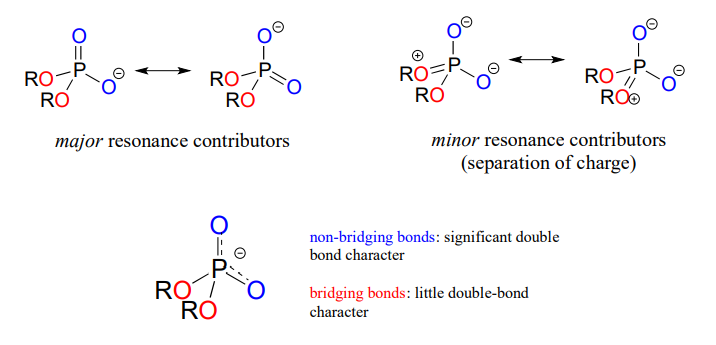
En los ésteres de fosfato, diésteres y anhidridos, el enlace π se deslocaliza principalmente sobre los enlaces no puente, mientras que los enlaces puente tienen principalmente carácter de enlace simple. En un diéster de fosfato, por ejemplo, los dos oxígenos no puente comparten una carga -1, como lo ilustran los dos principales contribuyentes de resonancia a continuación. El orden de unión para los\(P-O\) enlaces puente en un grupo diéster de fosfato es aproximadamente 1, y para los\(P-O\) enlaces no puente aproximadamente 1.5. En los contribuyentes de resonancia en los que los oxígenos puente se muestran como dobles enlaces (a la derecha en la siguiente figura), hay una separación adicional de carga, por lo que estos contribuyentes son menores y hacen una contribución relativamente poco importante a la imagen general de unión.
Dibujar todas las estructuras de resonancia que muestran la deslocalización de la carga en un monofosfato orgánico (completamente desprotonado). Si una “orden de fianza” de 1.0 es un enlace sencillo, y un orden de bonos de 2.0 es un doble enlace, cuál es el orden aproximado de enlace de puente y no puente\(P-O\) bonds?
A lo largo de este libro, los grupos fosfato a menudo se dibujan sin intentar mostrar geometría tetraédrica, y los enlaces π y las cargas negativas generalmente se mostrarán localizados en un solo oxígeno. Esto se hace en aras de la simplificación - sin embargo es importante recordar siempre que el grupo fosfato es realmente tetraédrico, las cargas negativas se deslocalizan sobre los oxígenos no puente, y que hay cierto grado de protonación a nivel fisiológico\(pH\) (con la excepción de la grupo fosfato diéster).


