9.5: Fosforilación de Alcoholes
- Page ID
- 72500
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Una amplia familia de enzimas llamadas quinasas catalizan la transferencia de un grupo fosfato de TP a un aceptor de alcohol. Mecanísticamente, el oxígeno del alcohol actúa como nucleófilo, atacando el g-fósforo electrófilo del TP y expulsando ADP.
La glucosa es fosforilada en el primer paso de la vía de la glucólisis por la enzima hexosa quinasa (EC 2.7.1.1), formando glucosa-6-fosfato.
Mecanismo de la hexosa quinasa

Aquí hay una forma abreviada de representar esta reacción. Observe la notación “ATP in, ADP out” utilizada a continuación, indicando que ATP es uno de los reactivos y ADP es uno de los productos. A partir de aquí, frecuentemente utilizaremos esta convención común para indicar participantes de reacción cuyas estructuras no están dibujadas en una figura.

La actividad biológica de muchas proteínas está regulada por las proteínas quinasas. En una reacción de proteína quinasa, los grupos hidroxilo de la cadena lateral en los residuos de serina, treonina o tirosina de ciertas proteínas son fosforilados por ATP:
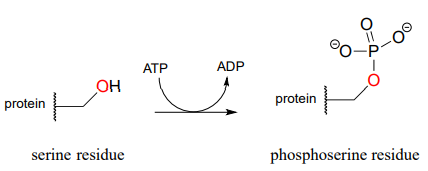
La conversión de un grupo hidroxilo neutro en un fosfato cargado representa un cambio muy dramático en la arquitectura local de la proteína, alterando potencialmente su patrón de plegamiento y su capacidad de unirse a moléculas pequeñas u otras proteínas. La función biológica de una proteína puede “activarse” mediante la fosforilación de un solo residuo y apagarse nuevamente mediante la eliminación del grupo fosfato. Esta última reacción la examinaremos más adelante en este capítulo.
- La treonina quinasa cataliza la fosforilación del grupo hidroxilo de la cadena lateral de los residuos de treonina en proteínas. Dibujar la estructura, incluyendo la configuración de todos los estereocentros, de un residuo de fosfotreonina. Explica cómo puedes predecir la estereoquímica de la cadena lateral.
Aunque la inversión estereoquímica en la transferencia de fosfato se predice por teoría, el hecho de que los grupos fosfato sean aquirales hizo imposible durante mucho tiempo verificar el fenómeno directamente. Esto finalmente se logró a fines de la década de 1970, cuando un grupo de investigadores demostró inversión de fosfato en enzimas cinasas utilizando ATP sintetizado químicamente en el que se incorporaron tres isótopos diferentes de oxígeno al g-fosfato, creando así un centro de fósforo quiral. (Ann. Rev. Biochem. 1980 49, 877).

Los alcoholes se pueden convertir en difosfatos orgánicos de dos maneras diferentes. Un proceso de dos etapas implica simplemente transferencias sucesivas de los grupos g-fosfato de dos donantes de ATP, como en estas etapas secuenciales en la biosíntesis de isoprenoides. (EC 2.7.1.36; EC 2.7.4.2). Un compuesto llamado mevalonato se difosforila de esta manera en la fase temprana de la vía biosintética para el colesterol, las hormonas esteroides y otras moléculas isoprenoides.
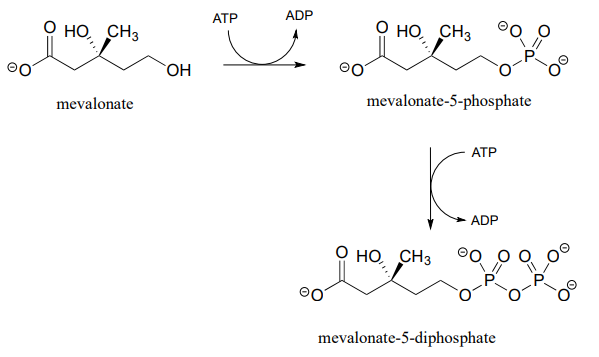
El mecanismo para la primera etapa de fosforilación es análogo al de una reacción de alcohol quinasa, que acabamos de ver. En la segunda etapa de transferencia de fosfato, catalizada por una enzima separada, uno de los oxígenos de fosfato en el monofosfato orgánico actúa como aceptor de fosfato nucleófilo, atacando el g-fosfato de un segundo ATP.

En algunas vías metabólicas, la difosforilación ocurre por un mecanismo diferente al anterior. En lugar de transferir secuencialmente dos fosfatos de dos donantes de ATP, el mecanismo alternativo ocurre en un solo paso: la molécula aceptora nucleofílica ataca al b-fosfato de ATP, en lugar del g-fosfato. Después de la formación del intermedio bipiramidal trigonal, es AMP (no ADP) el que se expulsa, y lo que comenzó como los fosfatos b y g de ATP permanecen ambos con el aceptor.
En la biosíntesis de nucleótidos de ADN y ARN, uno de los grupos hidroxilo de la ribosa-5-fosfato se difosforila (EC 2.7.6.1) en un mecanismo de un solo paso:
Una reacción de difosforilación de alcohol en una etapa (PRPP sintasa):
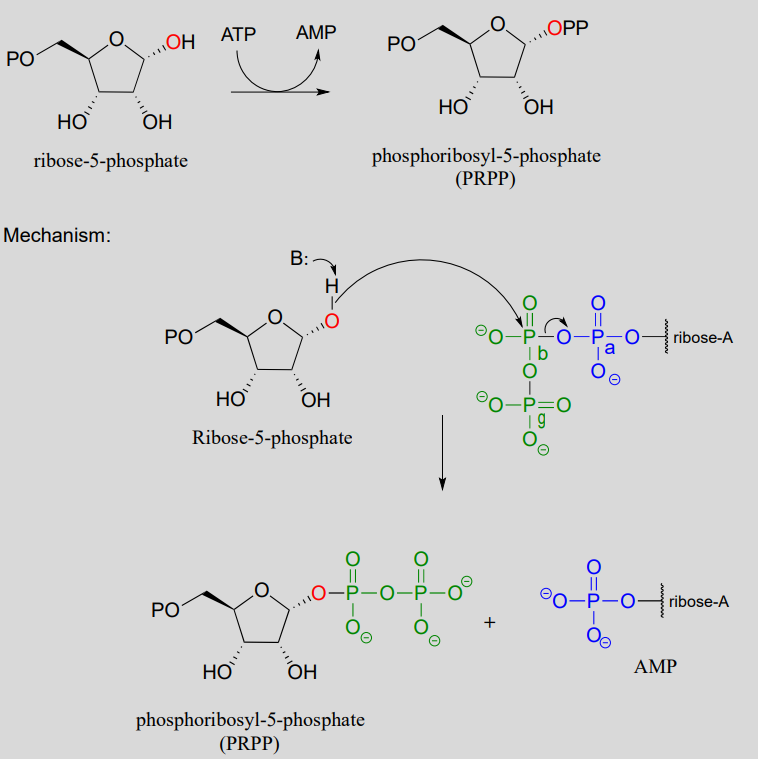
El papel metabólico de ambos procesos de difosforilación que acabamos de ver es convertir un grupo hidroxilo en un buen grupo saliente (recordemos que los iones hidróxido son bases fuertes y grupos salientes pobres, mientras que los fosfatos/difosfatos, especialmente cuando se estabilizan en un sitio activo enzimático, son bases débiles y muy buenas dejando grupos). En las vías de biosíntesis de nucleósidos, el grupo difosfato del PRPP actúa como grupo saliente en el siguiente paso metabólico, lo cual es una\(S_N1\) reacción: ya hemos visto esta reacción en la sección 8.7).


