V. Comparación de la reactividad de carbohidratos de O-tiocarbonilo y O-carbonilo
- Page ID
- 80284
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Cuando se considera el éxito de los compuestos de O-tiocarbonilo como sustratos en la reacción de Barton-McCombie, una pregunta razonable es “¿Por qué los derivados de carbohidratos de O - carbonilo (en particular, los compuestos O-acilados) no exhiben reactividad similar?” Una respuesta a esta pregunta se puede enmarcar en términos de las reacciones mostradas en el Esquema 28. 223—225 Según esta explicación, el equilibrio que implica la adición de Bu 3 Sn· a un compuesto con un grupo O-tiocarbonilo produce una concentración mucho mayor del radical aducto 77 que la concentración del radical 76 producida por adición de Bu 3 Sn· al correspondiente carbohidrato de O - carbonilo. La concentración de equilibrio dramáticamente mayor de 77 conduce a un aumento correspondiente de la tasa de formación de radicales carbohidrato (CARB·). 223—225
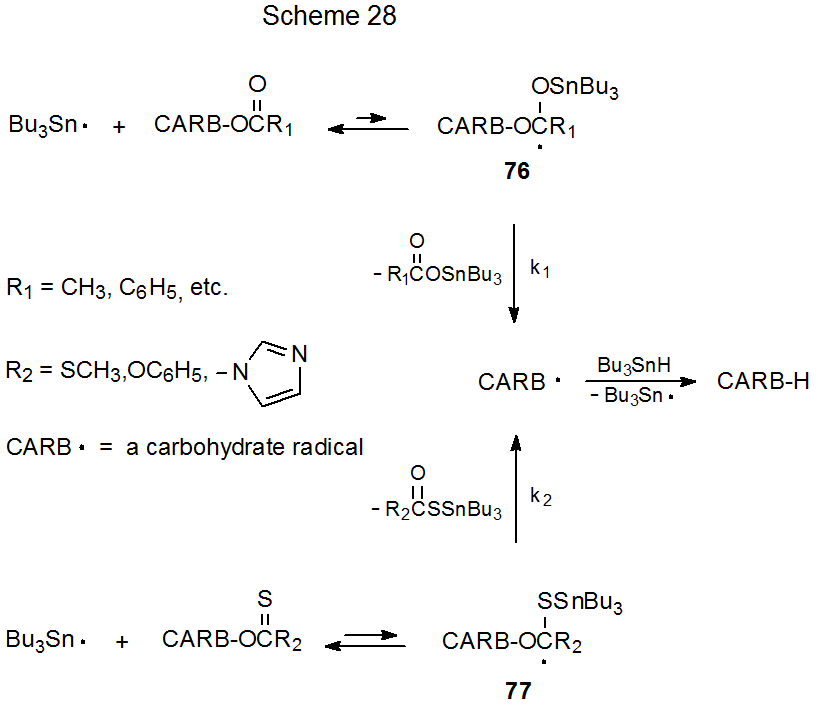
La reacción detectable de ésteres simples con Bu 3 Sn· se hace posible solo si la baja concentración de equilibrio de 76 puede ser incrementada de alguna manera o compensada por una rápida reacción posterior de este radical (k 1 grande). Debido a estos requisitos, no se produce ninguna reacción en condiciones normales de Barton-McCombie, pero sí se produce la sustitución de un grupo acilooxi con un átomo de hidrógeno cuando los carbohidratos acilados reaccionan con (C 6 H 5) 3 Si· en condiciones vigorosas [(C 6 H 5) ) 3 SiH, 140 o C, 12 h, peróxido de benzoilo]. 226 Además, bajo condiciones bastante diferentes (HMPA, H 2 O, luz UV, temperatura ambiente) la transferencia fotoquímica de electrones conduce a la reducción de los carbohidratos acilados a los correspondientes desoxicompuestos. 227 Estas y otras reacciones de los carbohidratos esterificados se discuten en detalle en el Capítulo 8.

