II. Azides
- Page ID
- 80328
A. Reacciones
1. Reducción
Las azidas se reducen a aminas sustituidas con estaño por reacción con hidruros de estaño. 1—9 Estos compuestos que contienen estaño generalmente no están aislados; más bien, cada uno se convierte en la amina correspondiente o en un derivado de amina. Los derivados de amina incluyen compuestos formados por reacción de un producto que contiene estaño con un haluro de ácido, anhídrido 1,2, 3 o éster. 4 Las aminas libres se liberan de los productos que contienen estaño mediante una hidrólisis que a menudo tiene lugar durante la purificación cromatográfica. 5—9 Ejemplos de reacciones que producen amina y derivados de amina se encuentran en las ecuaciones 1 7 y 2, 1 respectivamente. La conversión de una azida en la amina correspondiente también puede tener lugar cuando el hidruro de tri- n-butilestaño se reemplaza por tris (trimetilsilil) silano. 10
.png)
.png)
El tratamiento de azidas con hidruro de tri- n - butilestaño no siempre causa reacción del grupo azido. 11—13 Los carbohidratos que contienen sustituyentes O- tiocarbonilo (eq 3) 11,12 o átomos de yodo (eq 4) 13 experimentan una reacción quimioselectiva que deja intacto al grupo azido. Si la cantidad de Bu 3 SnH es suficiente y las condiciones son propicias, los grupos azido reaccionarán después de que se complete el reemplazo de grupos más reactivos. 13
.png)
.png)
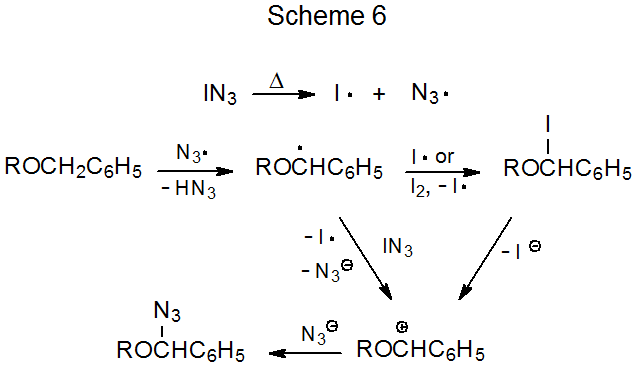
El radical tri- n-butilestaño potencialmente puede agregarse a N α o N γ en un grupo azido (Esquema 1), pero dado que se cree que el radical intermedio 1 es un precursor del producto que contiene estaño 2, se supone que la adición inicial de Bu 3 Sn· es a N α. 14—16 Como se mencionó anteriormente e indicó en el Esquema 1, el procedimiento normal requiere ya sea hidrólisis o derivatización previo al aislamiento del producto.
2. Bromación
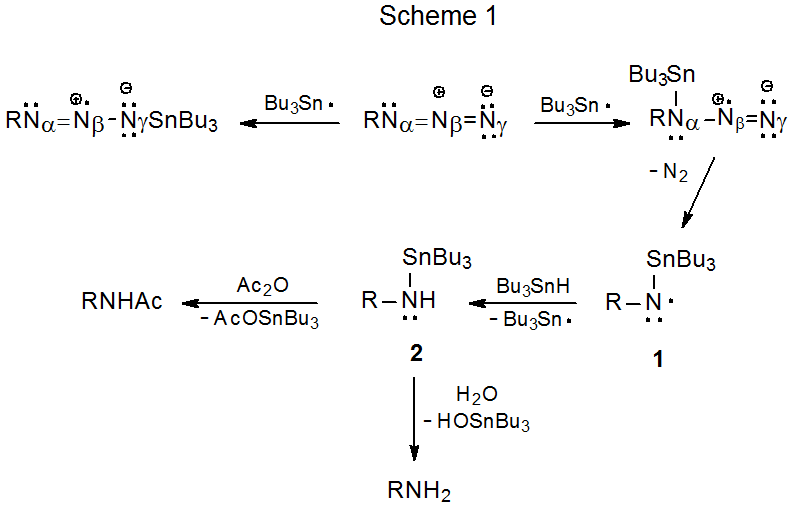
La bromación por radicales libres de una glucosilazida produce la correspondiente N-bromoglicosilimina. 17,18 La reacción mostrada en el Esquema 2 inicia tal proceso cuando H-1 se abstrae regioselectivamente para dar el radical 3, un intermedio que es estabilizado tanto por el átomo de oxígeno del anillo como por el grupo azido. La pérdida de nitrógeno molecular, seguida de la abstracción de átomos de bromo, completa la reacción.
3. Formación de nitrilo
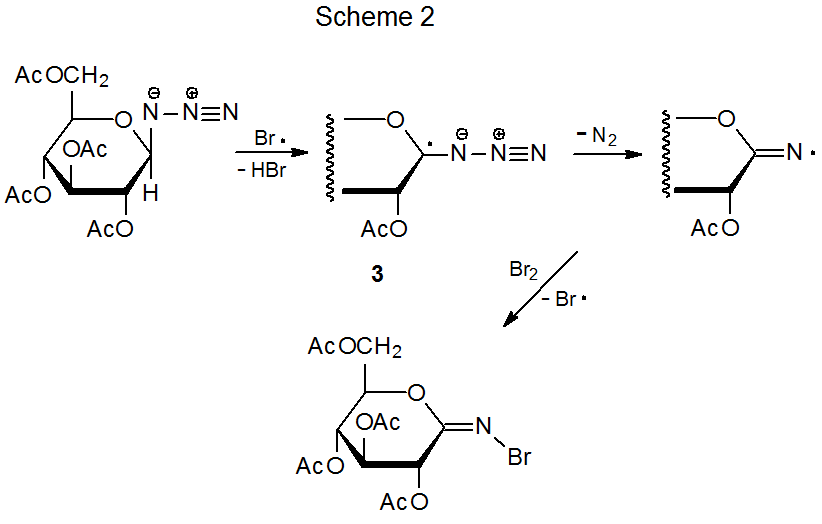
Si un radical centrado en oxígeno y un grupo azido están unidos a átomos de carbono adyacentes, el enlace entre los átomos de carbono se escinde en una reacción que conduce a un nitrilo. 19 En el ejemplo mostrado en el Esquema 3, el radical alcoxi 4 se fragmenta para abrir un anillo de seis miembros; una secuencia de etapas luego conduce al nitrilo 5. La apertura del anillo similar ocurre en compuestos con anillos de cinco miembros. 19
B. Síntesis
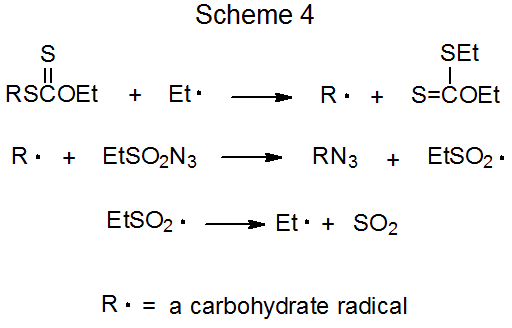
1. Adición de Radical Carbohidrato a Azidas de Etanosulfonilo y Bencenosulfonilo
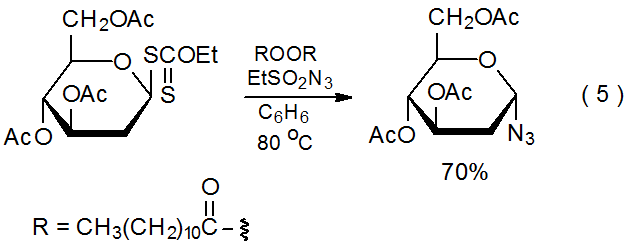
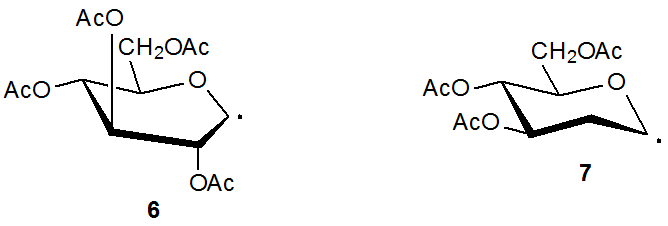
Es posible sintetizar una azida carbohidrato por reacción del xantato correspondiente con etanosulfonilazida 20 o bencenosulfonilazida 20,21 (eq 5 21). Los pasos de propagación para este tipo de reacción se describen en el Esquema 4. 21 Como se muestra en la ecuación 6, la presencia de un grupo acetoxi en C-2 reduce el rendimiento del producto cuando se compara con la reacción en la que dicho grupo está ausente (eq 5). El radical intermedio piranos-1-ilo 6, que adopta una conformación de barco B 2,5, está más obstaculizado en C-1 que el radical piranos-1-ilo 7, el cual carece de un sustituyente C-2 y tiene una conformación silla. (La Sección IV del Capítulo 6 del Tomo I contiene más información sobre la conformación de los radicales piranos-1-ilo.) Además de estar más obstaculizado en C-1, el radical 6 es menos nucleófilo debido a la naturaleza atrayente de electrones del grupo acetoxi C-2.
.png)
.png)
2. Adición de radical azida a un carbohidrato insaturado
a. Radicales azida
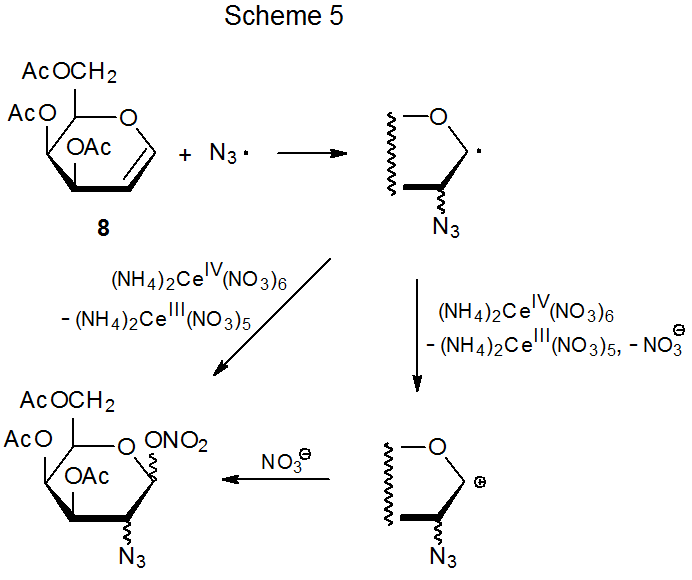
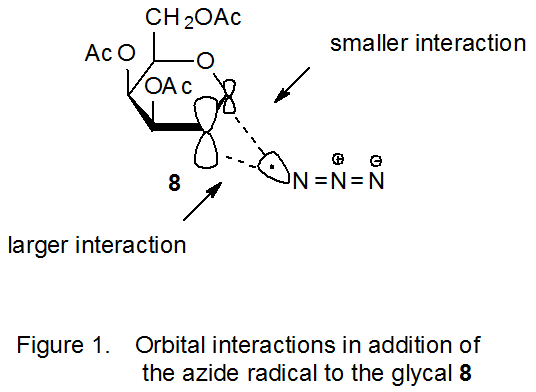
El ion azida se convierte en radical azida por reacción con agentes oxidantes que incluyen nitrato de amonio cerio (IV) (eq 7) 22 y (diacetoxiyodo) benceno (eq 8). 23 La naturaleza electrofílica del radical azida está atestiguada por su adición a dobles enlaces ricos en electrones como los que se encuentran en los glicales. 24—47 Los coeficientes orbitales atómicos pueden ser críticos para determinar la regioselectividad en una reacción con un estado de transición temprano porque la constante de velocidad para el proceso de formación de enlaces entre dos átomos depende en sus primeras etapas de la magnitud de los coeficientes de la frontera interactuante orbitales. 28,29 En la adición radical azida que se muestra en el Esquema 5, los orbitales fronterizos son el SOMO del radical azida y el HOMO del D-galactal 8. La posición más reactiva para la adición al doble enlace en 8 está en C-2 porque, con base en sistemas modelo simples, 30 el coeficiente orbital atómico para el HOMO es mayor en C-2 que en C‑1 (Figura 1).
.png)
.png)
b. Azidonitración
La azidonitración se produce cuando el radical azida se produce por oxidación del ion azida por nitrato de cerio amónico (IV) en presencia de un glical. 24—27,31—39 La estereoselectividad de la adición de radicales azida depende de la estructura glical; así, N 3 · se agrega de manera altamente selectiva a la cara α del D-galactal 8 porque la cara β está bien protegida por sustituyentes en el anillo (eq 9). 24 La protección menos efectiva de la cara β, que ocurre cuando 8 es reemplazado por el D-glucal 9, conduce a una estereoselectividad que varía a medida que cambian las condiciones de reacción (eq 10). 37 Cuando se incorpora un grupo 4,6-O-isopropilideno a la estructura D-glucal, crea un compuesto que es conformacionalmente menos móvil. Con esta reducción en la movilidad conformacional viene mayor estereoselectividad además del radical azida al derivado D-glucal (eq 11). 37
.png)
.png)
.png)
c. Azidofenilselenilación
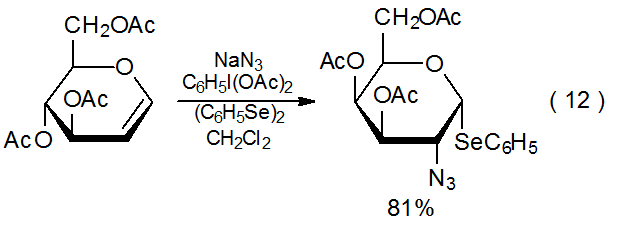
Cuando el ion azida es oxidado por (diacetoxiyodo) benceno, el radical azida resultante se agregará a un glical para producir un seleniuro de fenilo si el difenildiselenuro está presente en la mezcla de reacción (eq 12 40). 39—48 El disolvente normal para esta reacción es el diclorometano, pero debido a la limitada solubilidad de la azida sódica en este disolvente, la reacción suele ser heterogénea, situación que provoca que los rendimientos del producto sufran excepto en soluciones bastante diluidas. Sin embargo, si el radical azida se genera a partir de trimetilsilil azida, las soluciones son homogéneas y se obtienen buenos rendimientos de producto (eq 13). 49
.png)
.png)
d. Azidohalogenación
El radical azida también se forma por fotólisis de cloroazida (eq 14). Cuando esta reacción se lleva a cabo en presencia de un glical, se produce azidocloración (eq 15). 50 La estereoselectividad de la adición de glicales por el radical azida formado a partir de la fotólisis es similar a la observada cuando este radical es generado por oxidación de iones azida. La reacción fotoquímica es diferente, sin embargo, en que se produce una pequeña cantidad (13%) de adición en la que se intercambian las posiciones de los sustituyentes azido y cloro. Dado que la fotólisis de la cloroazida también produce el átomo de cloro electrófilo (eq 14), es razonable esperar que a veces un átomo de cloro se agregue a un glical en C-2.
.png)
.png)
3. Sustitución de Átomos por un Grupo Azido
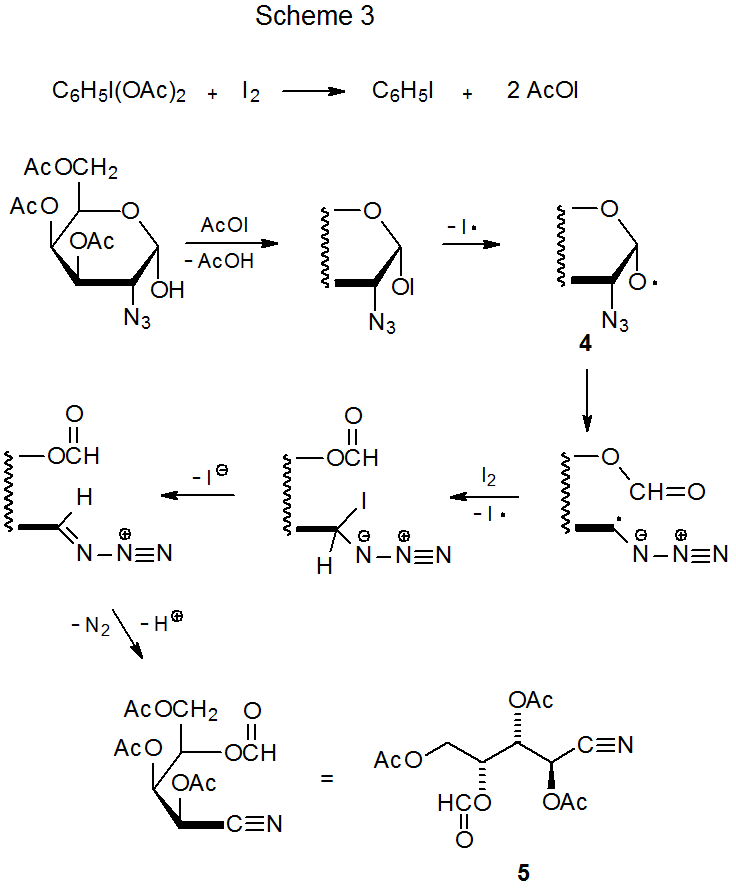
La reacción entre yodoazida y un carbohidrato que contiene un grupo benciloxi conduce al reemplazo del átomo de hidrógeno por un grupo azido (eq 16). 51 En esta reacción el radical azida abstrae uno de los átomos de hidrógeno reactivos del grupo benciloxi para formar un radical bencílico. El grupo azido puede entonces ser introducido por una de las vías propuestas que se muestran en el Esquema 6.
.png)