II. Isonitrilos
- Page ID
- 80532
A. Reacciones
1. Repuesto de Grupo
a. Grupos isocianos
La reacción del hidruro de tri- n-butilestaño con carbohidratos que contienen grupos isociano reemplaza cada uno de estos grupos con un átomo de hidrógeno. Se sabe que dicho reemplazo ocurre cuando los grupos isociano están unidos a átomos de carbono anoméricos, 1,2 secundarios, 3—9 y primarios de 7 —9. Un ejemplo de reemplazo en un átomo de carbono anomérico se muestra en la ecuación 1, 5 mientras que tanto los grupos primarios como los secundarios se reemplazan en la reacción descrita en el Esquema 1. 7,9
.png)
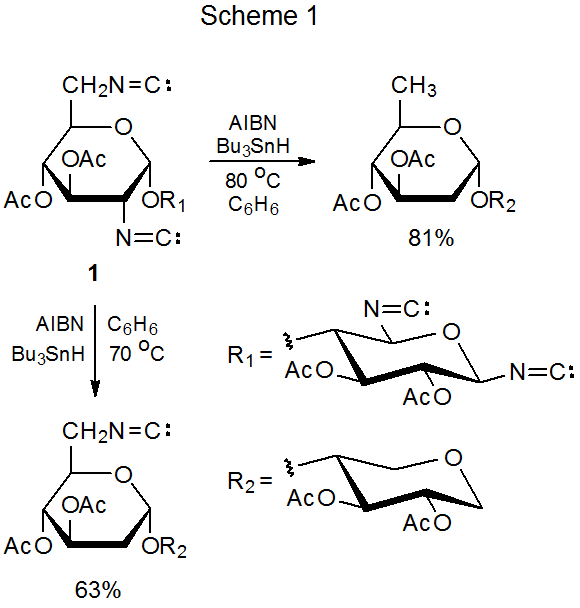
El reemplazo del grupo isociano es notablemente sensible a la temperatura. La reacción de los grupos secundarios en 1 tiene lugar a 70 o C, pero el grupo isociano primario no es reactivo (Esquema 1). 7,9 Cuando la temperatura de la mezcla de reacción se eleva a 80 o C, ambos grupos son reemplazados. Esta dependencia de la temperatura proporciona una base para la reacción regioselectiva.
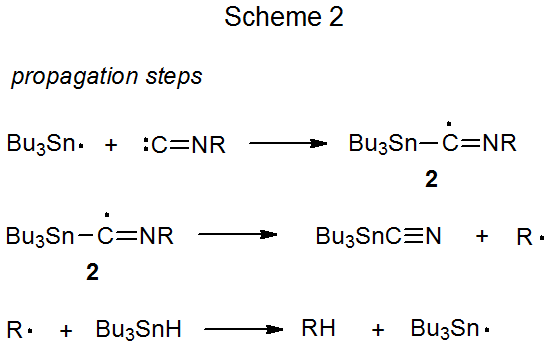
Un mecanismo para el reemplazo del grupo isociano con un átomo de hidrógeno se representa en el Esquema 2. 10 En la primera etapa de este proceso el radical tri- n-butilestaño se suma al átomo de carbono del grupo isociano para producir un radical imidoilo (2). La fragmentación de este radical (2) genera entonces el radical centrado en carbono R·, que abstrae un átomo de hidrógeno de Bu 3 SnH para completar la secuencia de reacción. Si R representa un grupo fenilo o fenilo sustituido, no se produce la fragmentación para dar un radical arilo; más bien, tiene lugar una reacción de adición. 11 Cuando tris (trimetilsilil) silano reemplaza al hidruro de tri- n - butilestaño en la reducción de isonitrilos, los compuestos que contienen grupos isociano primarios, secundarios o terciarios son todos reactivos. 12
b. Grupos sulfhidrilo
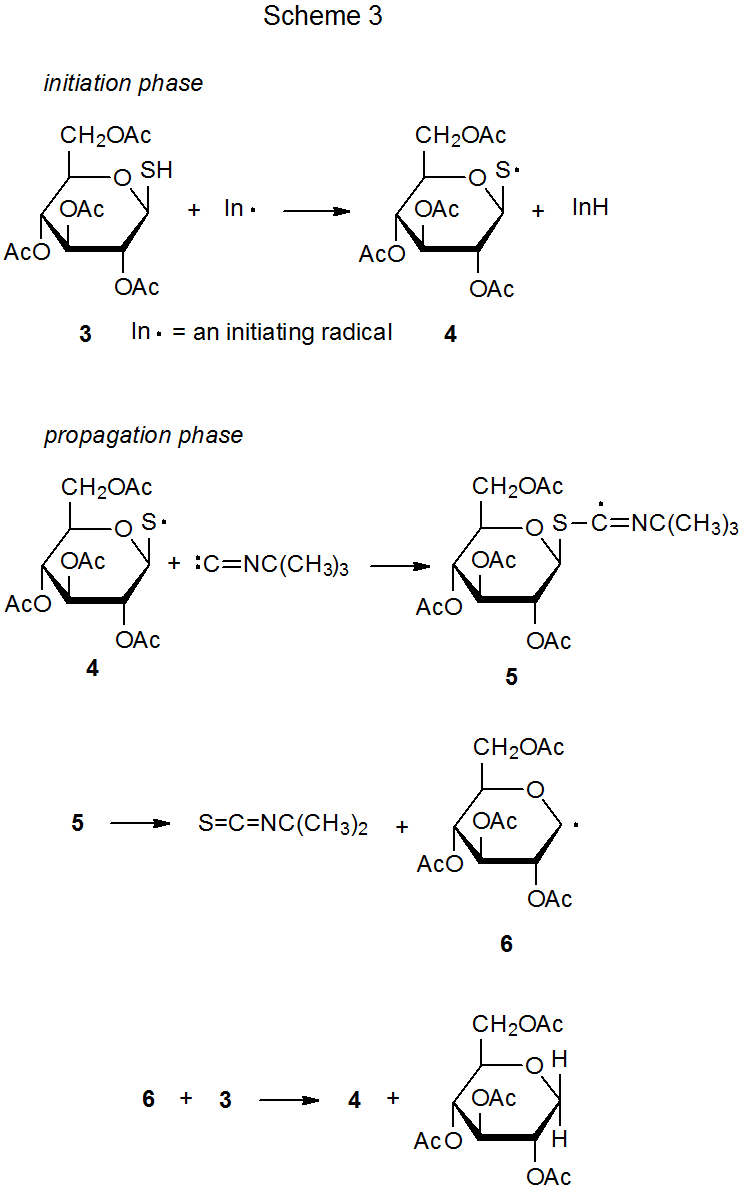
Un isonitrilo puede participar en la sustitución de un grupo sulfhidrilo por un átomo de hidrógeno. 13 Tal reacción se representa en el Esquema 3, donde el reemplazo comienza cuando el radical 4 centrado en el azufre se forma a partir del tiol 3 por abstracción de átomos de hidrógeno. La adición de 4 al isocianuro de t-butilo da el radical aducto 5, que luego se fragmenta para producir el radical piranos-1-ilo 6. La abstracción de átomos de hidrógeno por 6 de otra molécula del tiol inicial (3) completa el ciclo e inicia una nueva secuencia de reacción. El reemplazo del grupo sulfhidrilo representa otra vía para generar radicales carbohidratados centrados en carbono.
2. Reacciones de eliminación
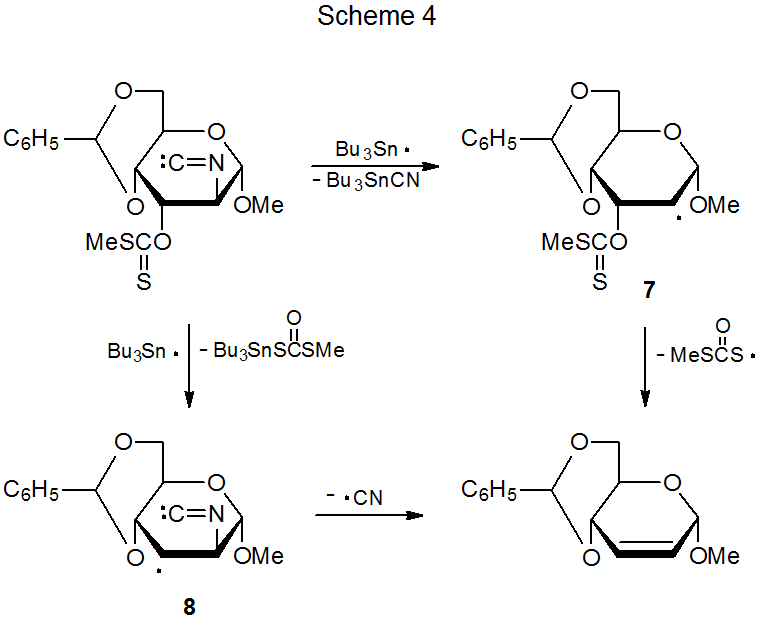
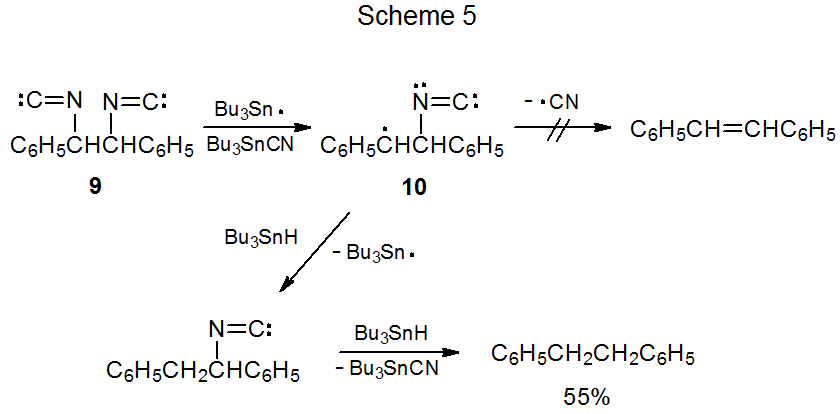
La reacción de hidruro de tri- n-butilestaño con un carbohidrato que tiene grupos isociano y O-tiocarbonilo adyacentes genera un producto con un doble enlace C-C (Esquema 4). 4 En esta reacción los radicales 7 y 8 son ambos posibles intermedios. El estudio del diisonitrilo 9 proporciona información útil para elegir entre 7 y 8. La reacción de 9 con Bu 3 Sn· produce un radical centrado en carbono (10) con un grupo isociano unido al átomo de carbono adyacente al centro radical (Esquema 5). 8 El intermedio 10 no expulsa un radical ciano para formar un enlace múltiple, sino que abstrae un átomo de hidrógeno del hidruro de tri- n-butilestaño. Extrapolar el comportamiento de 10 a la reacción mostrada en el Esquema 4 lleva a la conclusión de que el radical 8 es un intermedio poco probable en este proceso.
3. Reacciones de Adición
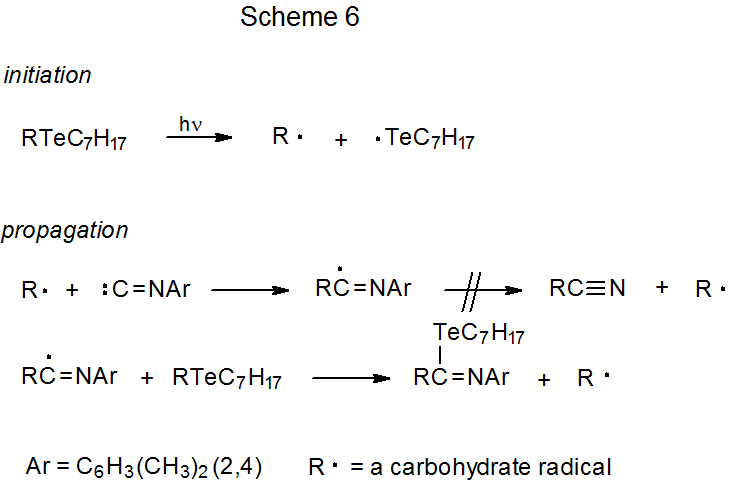
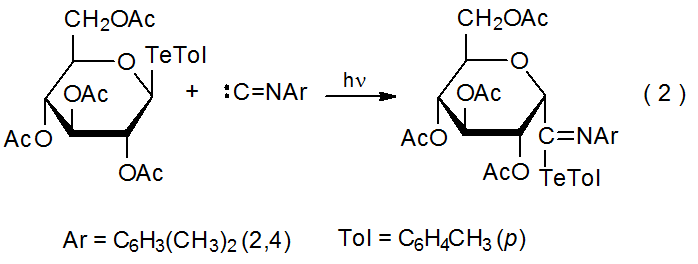
Como parte del proceso de reemplazo mostrado en el Esquema 2, un isonitrilo reacciona con Bu 3 Sn· para producir un radical intermedio centrado en carbono R·. La finalización normal de esta reacción implica la abstracción de átomos de hidrógeno por R· a partir de Bu 3 SnH; sin embargo, si R· se forma sin una transferencia de átomo de hidrógeno presente, se agregará a una molécula de isonitrilo (Esquema 6). Un ejemplo específico de este tipo de reacción se encuentra en la ecuación 2, que describe la adición α de un radical piranos-1-ilo, formado a partir de un telururo de carbohidratos, a un isonitrilo aromático. 14
.png)
B. Síntesis
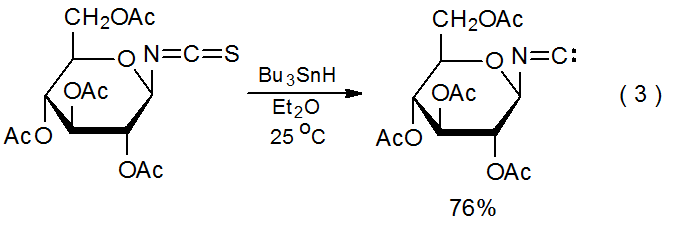
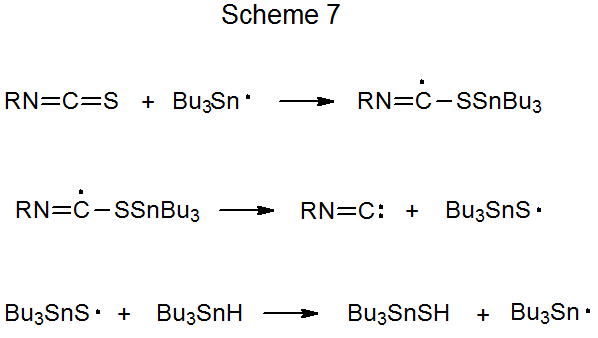
Es posible producir isonitrilos a partir de isotiocianatos por reacción radical (eq 3). 2 Un mecanismo propuesto para tal cambio estructural se muestra en el Esquema 7. La formación de isonitrilo resulta cuando la reacción se realiza a temperatura ambiente (eq 3), pero si la temperatura de reacción se eleva a 110 o C, el isonitrilo no se aísla debido a que experimenta reemplazo de grupo isociano por un átomo de hidrógeno (eq 4). 2,15
.png)
.png)

