III. Nitrato de Cerio Amonio (IV)
- Page ID
- 79869
A. Adición de Compuestos Ch-ácidos a D-Glycals
1. Malonato de dimetilo
a. Regioselectividad
De manera similar a la reacción del acetato de manganeso (III), el nitrato de amonio cerio (IV) promueve la adición regioselectiva de compuestos ácidos CH a carbohidratos con dobles enlaces ricos en electrones. 6—9,15,16,19—22 Se dan ejemplos de tales reacciones en las ecuaciones 3 y 4, y en el Esquema 7 se propone un mecanismo para el proceso de adición. 6—9 Las reacciones de glicales con (NH 4) 2 Ce (NO 3) 6 (eq 3 y eq 4) pueden realizarse a temperaturas más bajas que aquellas con Mn (OAc) 3 (eq 1 y eq 2). Estas condiciones más suaves suprimen completamente la formación del producto de transposición Ferrier 8, un compuesto formado en la reacción dada en la ecuación 1 pero ausente en el que se muestra en la ecuación 3.
.png)
.png)
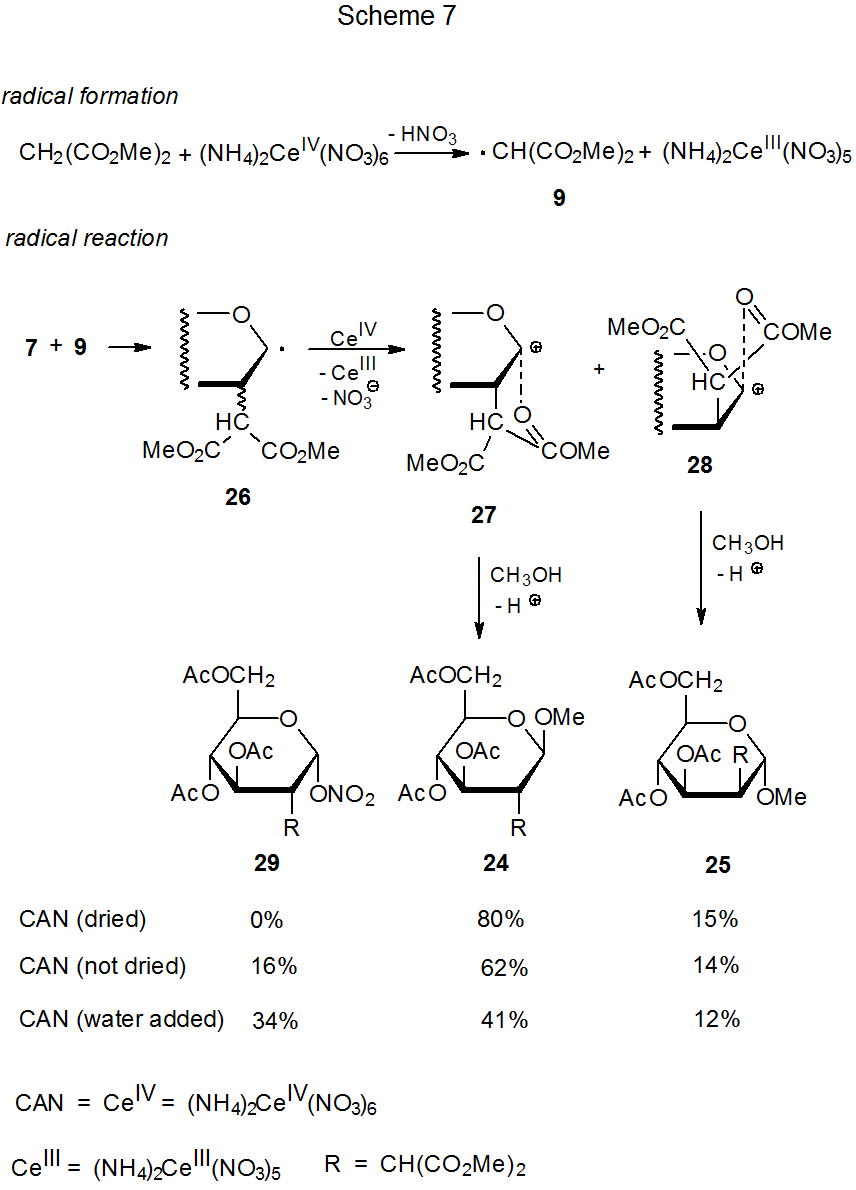
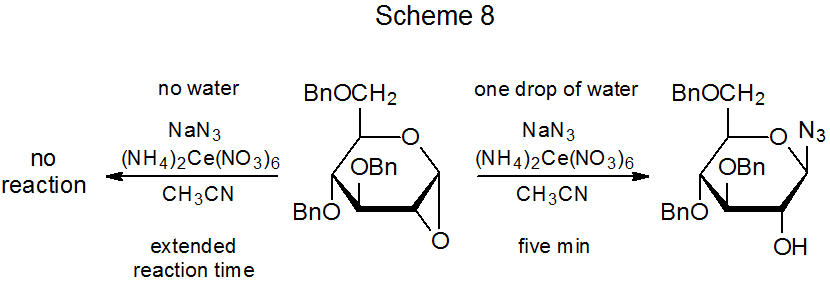
Si hay agua presente, incluso en pequeñas cantidades, se produce un nuevo compuesto (29) en la reacción mostrada en el Esquema 7. 22 ¿Cómo se forma este compuesto? La reacción directa entre el catión 27 y el anión nitrato es una posibilidad, pero si esta vía es la correcta, la adición de nitrato de sodio a la mezcla de reacción debería aumentar el rendimiento de 29. No lo hace. 7 También es posible la transferencia de ligandos de (NH 4) 2 Ce (NO 3) 6 al radical 26, 6,7 pero es difícil ver por qué tal proceso debería depender de la cantidad de agua presente en la mezcla de reacción. Ambas posibilidades [reacción de 27 con NaNO 3 o transferencia de ligando de (NH 4) 2 Ce (NO 3) 6] parecen más propensas a producir el anómero de 29 en lugar de 29 mismo. Los datos del Esquema 7 muestran que la formación del nitrato 29 viene a expensas del β-glucósido 24. La conversión de 24 en 29 podría resultar de la reacción de 24 con el ácido nítrico producido por la interacción de (NH 4) 2 Ce (NO 3) 6 con agua. Esta posibilidad está respaldada por la reacción mostrada en el Esquema 8, donde una gota de agua reacciona aparentemente con (NH 4) 2 Ce (NO 3) 6 para crear el ácido nítrico necesario para una apertura de anillo catalizada por ácido. 23
b. Estereoselectividad
La estereoselectividad de reacción mejora cuando (NH 4) 2 Ce (NO 3) 6 reemplaza Mn (OAc) 3 en la adición de malonato de dimetilo a 3,4,6-tri- O -acetil- D-glucal (7). La relación de adición de cara α a cara beta en C-2 por el radical malonilo cambia de 52:14 (eq 1, Esquema 4) 6 a 80:15 (eq 3, Esquema 7). 22 La diferencia en la temperatura de estas reacciones [95 o C (eq 1) a 0 o C (eq 3)] es una causa probable de este incremento en la estereoselectividad.
Una segunda etapa estereoselectiva en las reacciones mostradas en los Esquemas 3 y 7 ocurre durante la captura de solventes por cationes intermedios. El metanol reacciona con los cationes 27 y 28 exclusivamente desde la cara del anillo opuesto al grupo malonilo y produce un solo estereoisómero en cada caso (Esquema 7). La captura de ácido acético que se muestra en el Esquema 3 también es estereoselectiva pero menos porque cada catión intermedio reacciona para dar una mezcla de estereoisómeros. Una vez más, una mayor estereoselectividad de reacción se correlaciona con una menor temperatura de reacción.
La estereoselectividad en la adición de radicales malonilo también aumenta cuando el acercamiento a una cara de un anillo se vuelve más difícil debido a un cambio en la estructura del sustrato. Tal cambio ocurre cuando se reemplaza 3,4,6-tri- O -acetil- D-glucal (7) (eq 3) por 3,4,6-tri- O- acetil - D-galactal (30) (eq 4). 7 La proyección del grupo acetoxi C-4 sobre la cara β del anillo piranoide en 30 hace que esta cara esté más congestionada que la cara β del anillo piranoide en 7.
c. Reactividad
(1). Efecto de los sustituyentes C-1 sobre la formación de orto-éster de reactividad glical
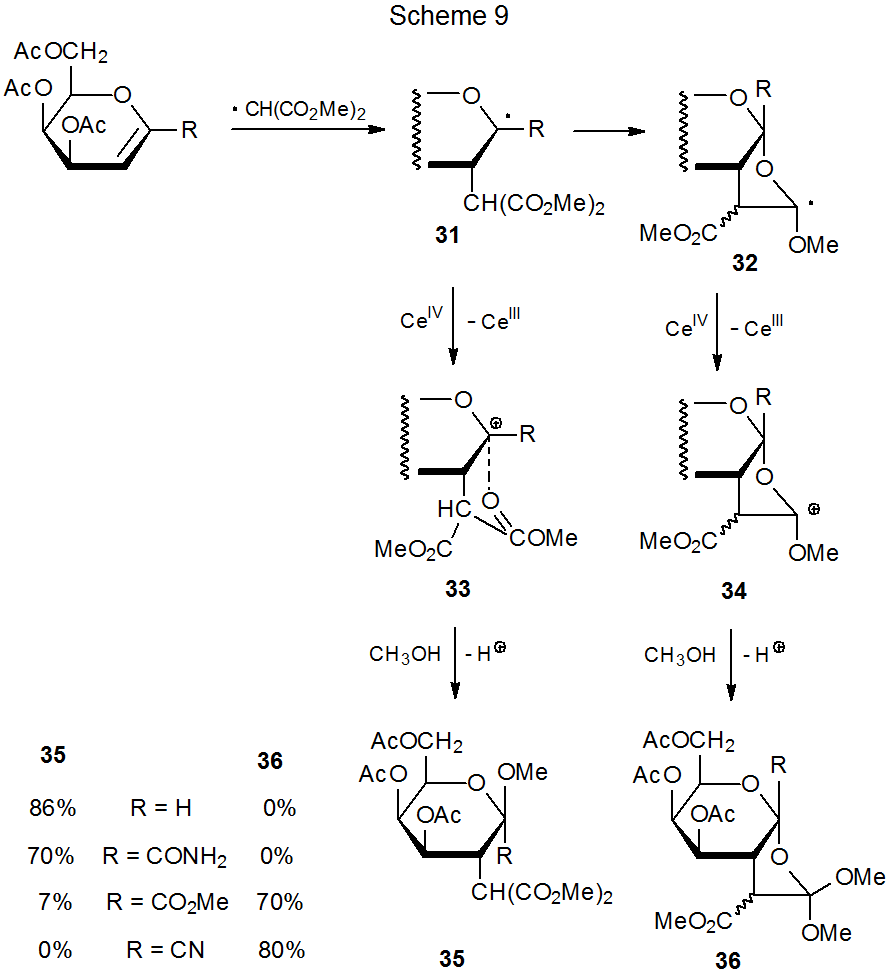
Los productos formados a partir de la adición del radical malonilo 9 a glicales sustituidos en C-1 dependen de la estructura de los sustituyentes C-1 (Esquema 9). 24 Cuando R es H o C (=O) NH 2, se forma el glucósido 35, pero cuando R es CO 2 Me o CN, los productos son los ortoésteres 36. Una explicación de esta diferencia en la reactividad es que cuando R es altamente aceptor de electrones (por ejemplo, CN o CO 2 Me), el potencial de oxidación del radical 31 es lo suficientemente alto como para que su conversión al catión 33 por reacción con (NH 4) 2 Ce (NO 3) Se suprime 6 (Esquema 9). 24,25 Cuando se produce esta supresión, la ciclación de 31 produce 32, un radical que ahora se puede oxidar fácilmente al catión correspondiente (34). La reacción de este catión con metanol da entonces los ortoésteres 36.
(2). Efecto de un sustituyente C-3 de la reactividad glical
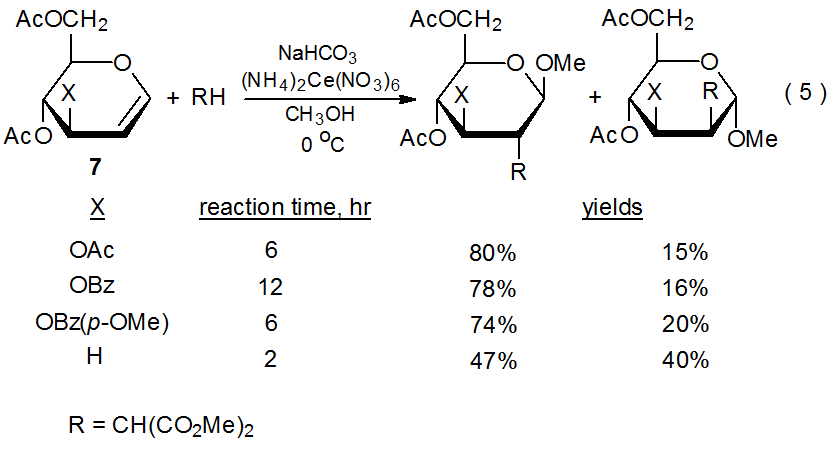
La importancia de los sustituyentes aceptores de electrones para la reactividad glical también es evidente cuando se unen diferentes sustituyentes a C-3 (eq 5). 25 Las reacciones mostradas en la eq 5 confirman los hallazgos anteriormente mencionados (Secciones III.a.1.a y III.a.1.b) sobre regioselectividad (el radical malonilo 9 se suma exclusivamente a C-2) y estereoselectividad (9 se agrega preferentemente a la cara del anillo piranoide opuesto al que contiene el sustituyente C-3). Estas reacciones también demuestran el efecto del carácter aceptor de electrones de un sustituyente C-3 sobre la velocidad de reacción (eq 5). Dado que las reacciones implican que el radical malonilo electrofílico se suma a un doble enlace rico en electrones, aumentar el carácter aceptor de electrones del grupo R disminuye la velocidad de reacción al reducir la densidad de electrones en el doble enlace; así, un grupo O-benzoilo, que es más electrón- retirando que un grupo O-acetilo, provoca una velocidad de reacción más lenta. La velocidad de reacción de un glical sustituido con O-benzoilo puede aumentarse colocando un grupo metoxi donador de electrones en el anillo de benceno. La reacción se puede hacer aún más rápida eliminando cualquier grupo aceptor de electrones de C-3 (eq 5).
.png)
2. Nitroacetato de etilo
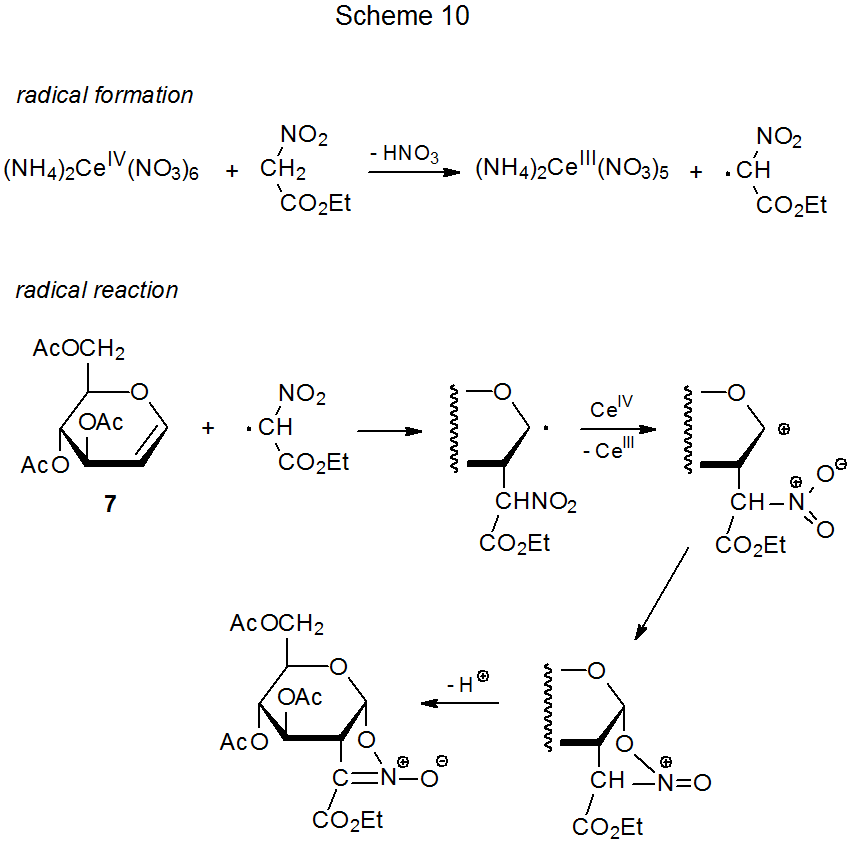
Cuando el nitroacetato de etilo reacciona con (NH 4) 2 Ce (NO 3) 6 en presencia del D-glucal 7 (eq 6), 20 tiene lugar una transformación que es similar en sus etapas tempranas a la reacción de malonato de dimetilo mostrada en eq 3. Estos dos procesos siguen diferentes vías una vez que el radical aducto se ha oxidado a un catión. En la reacción de nitroacetato de etilo, se produce la ciclación (Esquema 10) en lugar de la captura de disolvente que caracteriza la reacción con malonato de dimetilo (Esquema 7).
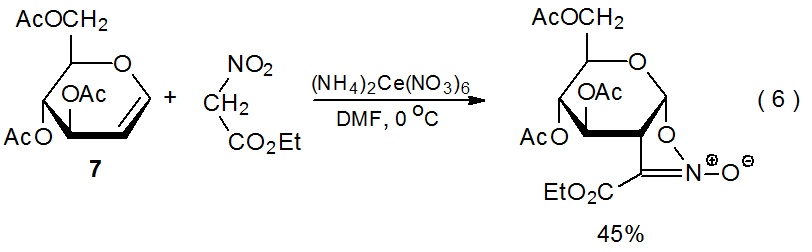.png)
3. Nitrometano
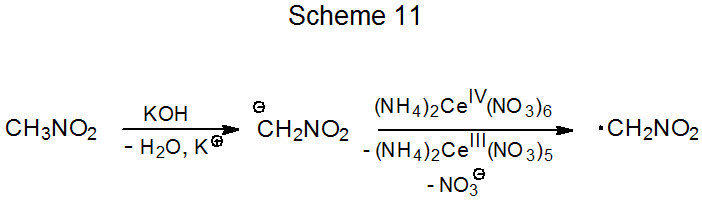
El nitrometano es un compuesto ácido CH que reacciona con hidróxido de potasio para formar un anión nitronato. La oxidación de este anión con nitrato de amonio cerio (IV) produce el radical electrófílico ·CH 2 NO 2 (Esquema 11). Si un compuesto con un doble enlace rico en electrones está presente en la mezcla de reacción, tiene lugar la adición de radicales (eq 7). 26
.png)
B. Adición del Radical Azida a un D-Glycal
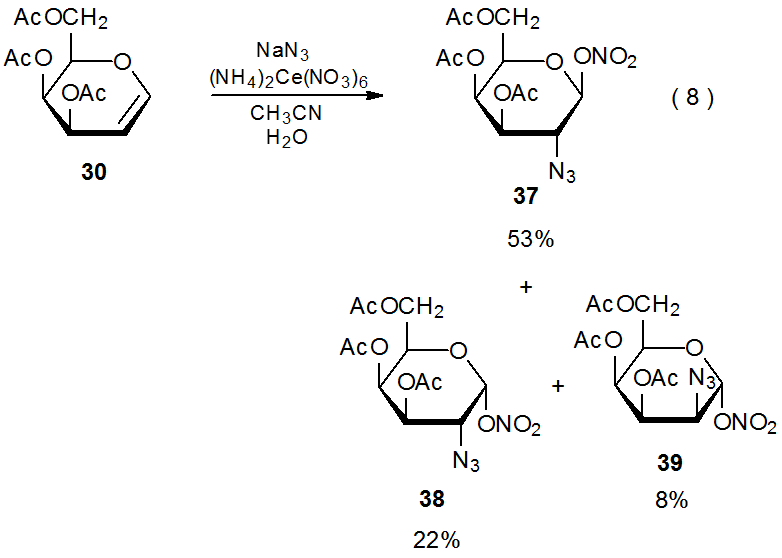
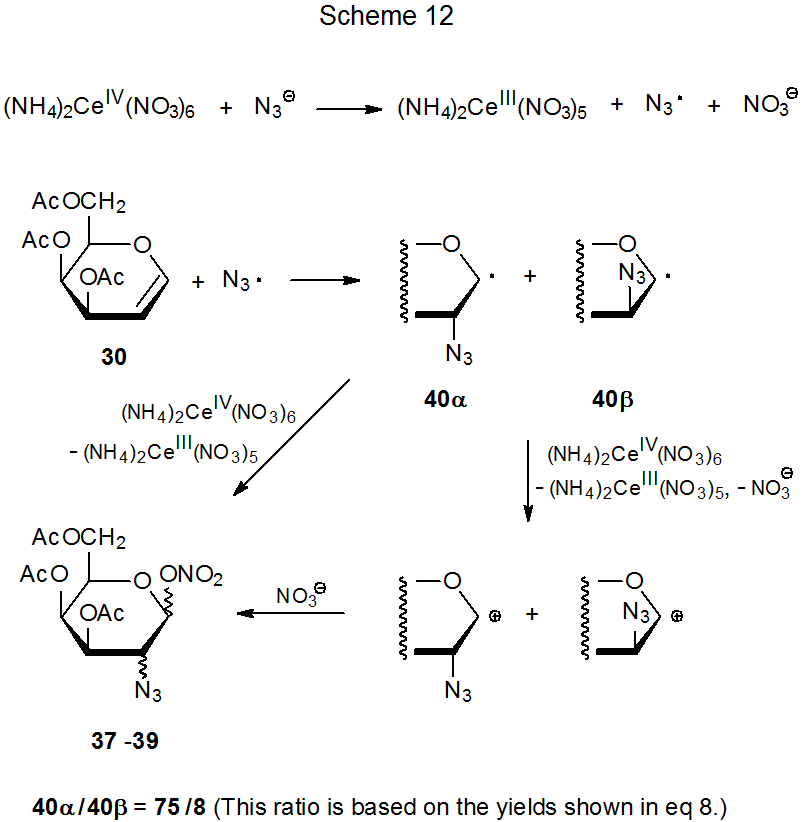
La reacción del nitrato amónico cerio (IV) con azida sódica en presencia del D-galactal 30 produce los nitratos azido diastereoméricos 37 - 39 (eq 8). 27 Existe evidencia convincente de que (NH 4) 2 Ce (NO 3) 6 oxida NaN 3 para producir el radical azida (Esquema 12). 28 La adición altamente estereoselectiva de este radical a 30 da los radicales aductos 40α y 40β en una proporción de 75:8. Los nitratos azido 37 - 39 entonces se forman ya sea indirectamente por reacción del ion nitrato con los cationes producidos por oxidación de 40α y 40β o directamente por transferencia de ligando de (NH 4) 2 Ce (NO 3) 6 a estos radicales. 29 (La sección II.B.2 del Capítulo 15 contiene más información sobre la azidonitración y referencias adicionales a esta reacción.)
.png)
C. Adición de un radical fosfonilo a un D-glical
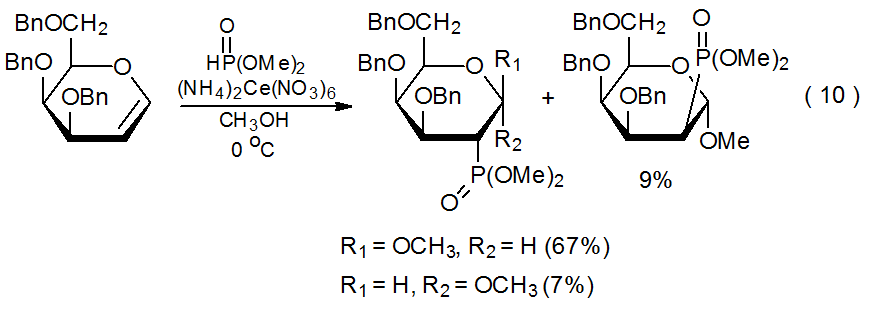
El fosfito de dimetilo reacciona con (NH 4) 2 Ce (NO 3) 6 para producir el radical 41 centrado en fósforo (eq 9). 30 Este radical luego se suma a las D-glicales de una manera regioespecífica, altamente estereoselectiva (eq 10).
.png)
.png)

