II. Transferencia de electrones de una pareja redox
- Page ID
- 80182
A. Donación directa de electrones
La donación de electrones del metal en un par redox a un carbohidrato halogenado puede ocurrir directa o indirectamente. Con la reacción directa, el papel del ion metálico es principalmente preparar la superficie del metal para la interacción con el compuesto halogenado. Se cree que este es el propósito del ion cobre en un par zinc-cobre, un reactivo que ha sido descrito como una forma activa de zinc metálico. 1 La Ecuación 1 representa una reacción de adición en la que el radical de adición se genera por reacción de un azúcar desoxiyodo con un par zinc-cobre (Zn y CuI) suspendido en una solución etanol-agua. 2
.png)
B. Donación indirecta de electrones
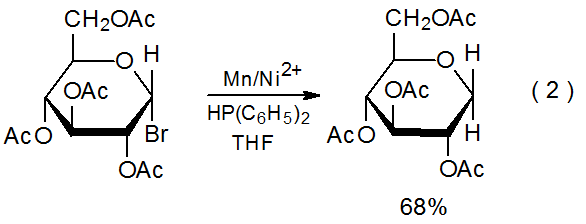
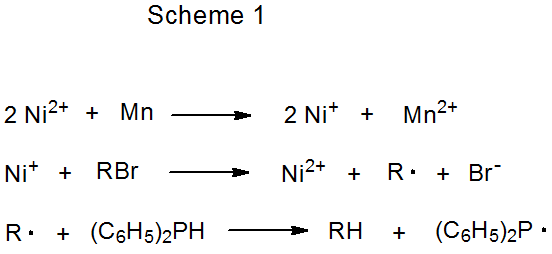
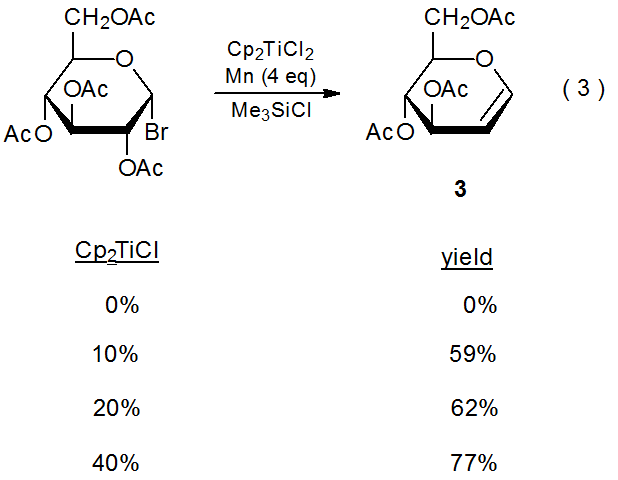
La donación indirecta de electrones del metal en un par redox ocurre cuando el ion metálico participa activamente en el proceso de transferencia. 3—5 Un ejemplo de este tipo de participación se muestra en la ecuación 2, donde Ni (I) se oxida a Ni (II) durante la reacción con un carbohidrato halogenado, y el Ni (II) luego se reduce a Ni (I) por el metal manganeso. 3 Dado que los electrones que se transfieren al carbohidrato provienen indirectamente del manganeso, el ion níquel desempeña un papel de suministro en la reacción y el manganeso es el reactivo estequiométrico (Esquema 1). En reacciones de este tipo el ión metálico necesita estar presente solo en cantidades catalíticas; por ejemplo, en la formación de glicales que se muestra en la ecuación 3, el complejo que contiene el ión titanio se agrega en tan solo un 10% molar. 4
.png)
.png)

