4.5: Tasas de rotación alrededor de enlaces -CO-N- de amidas
- Page ID
- 78260
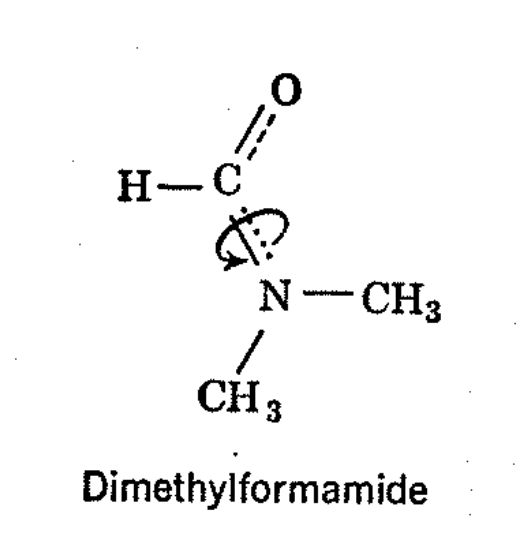
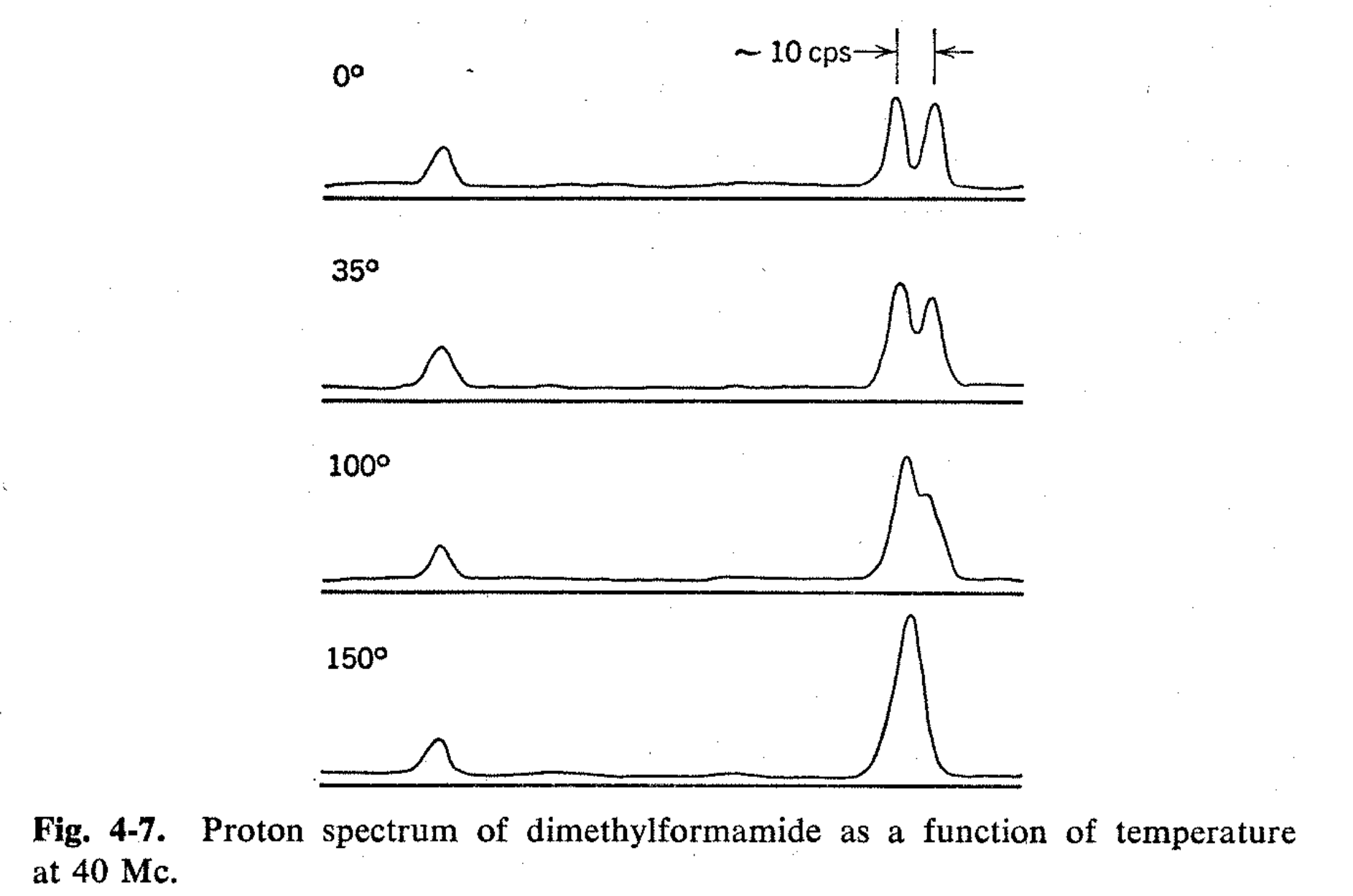
De extraordinario interés e importancia es el uso de métodos de RMN para determinar las tasas de rotación alrededor de los enlaces simples. 4 Las primeras observaciones de este tipo se realizaron con dimetilformamida. El espectro de dimetilformamida a temperatura ambiente se muestra en la Fig. 4-7. En campos bajos, hay una resonancia de un protón que surge del hidrógeno tipo aldehído del grupo formilo. Las resonancias de protones N-metilo ocurren como dos líneas espaciadas aproximadamente 10 cps a 40 Mc. La resonancia de metilo doblete podría surgir de grupos metilo químicamente diferentes o del acoplamiento espín-espín con el protón formilo. Se observará a partir de la Fig. 4-7 que la resonancia de protones formilo no está dividida, por lo que esta última explicación es insostenible. Se ha establecido una diferencia de desplazamiento químico por el hecho de que a 30 Mc los dos picos de metilo están separados solo por 7 cps. El conocimiento de que las resonancias de metilo separadas surgen de grupos metilo en diferentes ambientes químicos y magnéticos obliga a concluir que existe una rotación restringida alrededor del enlace -CO-N: de la dimetilformamida. Esto es bastante razonable porque la interacción de resonancia entre el grupo carbonilo y el par de electrones no compartidos sobre el nitrógeno tenderá a hacer que todos los átomos de la molécula se encuentren en un plano, excepto los protones en el grupo metilo. Si el grupo amida es plano, un grupo metilo debe ser cis y el otro trans al oxígeno carbonilo, y si la rotación es lenta alrededor del enlace -CO-N:, entonces los protones de cada metilo darán una línea de resonancia separada. Al calentar, la velocidad de rotación alrededor del enlace -CO-N: aumenta y finalmente las resonancias de metilo separadas se unen a una sola línea, como se muestra en la Fig. 4-7. Se ha realizado un trabajo considerable para determinar la energía de activación para rotación en dimetilformamida, y aunque la precisión obtenida por un investigador dado es satisfactoria, existen discrepancias considerables entre los valores reportados. 2,6 Esto posiblemente se deba a los efectos de las impurezas.
Phillips 7 ha hecho uso elegante de la lentitud de rotación alrededor del enlace -CO-N: de la dimetilformamida para aprender cómo la molécula acepta un protón en la formación del ácido conjugado. Como se muestra en la siguiente ecuación, el protón podría agregarse ya sea al oxígeno o al nitrógeno.
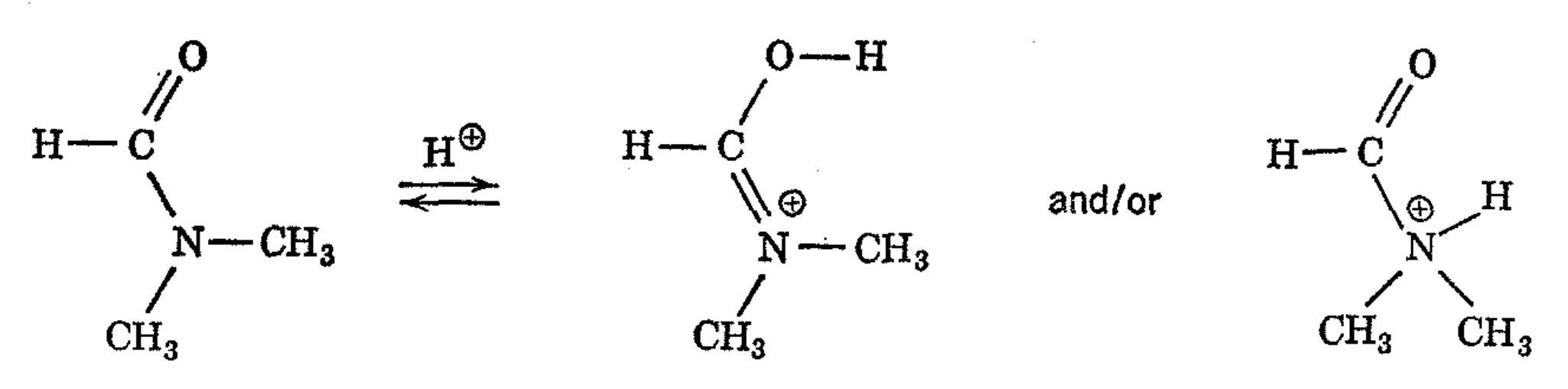
Se podría argumentar que el nitrógeno es intrínsecamente más básico que el oxígeno, por lo que el nitrógeno podría ser la posición favorecida, aunque la adición del protón al nitrógeno significaría la pérdida de energía de resonancia asociada a la interacción del par de electrones no compartidos de nitrógeno con el grupo carbonilo. Por otro lado, se podría argumentar que el oxígeno amida sería más propenso a aceptar un protón de lo habitual para el oxígeno carbonílico debido a que el ácido conjugado resultante se estabilizaría sustancialmente por resonancia involucrando al par de electrones no compartidos sobre nitrógeno.
Phillips reconoció que si el protón se suma al nitrógeno, esto destruiría el carácter de doble enlace del enlace -CO-N: y reduciría la barrera a la rotación al valor muy bajo esperado para un enlace sencillo C-N. Por otro lado, si el protón se suma al oxígeno, entonces se incrementaría la cantidad de carácter de doble enlace en el enlace -CO-N: y la rotación sería más difícil. Experimentalmente, se observa que la velocidad de rotación alrededor del enlace sencillo en dimetilformamida en solución ácida fuerte no se incrementa en comparación con la solución neutra, por lo que el protón agregado se une preferentemente al oxígeno.
Una serie de estudios interesantes de rotación restringida en nitritos, N-nitrosaminas y oximas han sido revisados por Phillips. 4
4 W. D. Phillips, Ann. N.Y. Acad. Sci., 70, 817 (1958).
5 W. D. Phillips, J. Chem. Phys., 23, 1363 (1955).
6 Investigación de J. N. Shoolery reportada en Varian Associates Tech. Bol., 2, 7 (1957).
7 Comunicación privada de W. D. Phillips. Estudios similares han sido realizados por G. Fraenkel y C. Niemann, Proc. Tuerca. Acad. Sci., 44, 688 (1958).


