3.6F: Solución de problemas
- Page ID
- 74006
La cristalización es demasiado rápida
Se desaconseja la cristalización rápida debido a que las impurezas tienden a incorporarse al cristal, derrotando el propósito de esta técnica de purificación. Puede ser aceptable que la cristalización comience inmediatamente después de retirar el matraz de la fuente de calor, pero si se forma una gran cantidad de sólido entonces el compuesto está cristalizando demasiado rápido.
Una cristalización ideal tiene algunos cristales que se forman en aproximadamente 5 minutos, y el crecimiento continúa durante un período de 20 minutos. A continuación se presentan los métodos que se pueden utilizar para frenar el crecimiento de los cristales:
- Vuelva a colocar el sólido sobre la fuente de calor y agregue disolvente adicional (quizás\(1\) -\(2 \: \text{mL}\) para\(100 \: \text{mg}\) de sólido), para que haya excedido la cantidad mínima de disolvente caliente necesaria para disolver el sólido. Aunque más compuesto se disolverá en las aguas madres, el compuesto permanecerá soluble por más tiempo una vez que se reserve para enfriar.
Por ejemplo, en la cristalización del ácido trans-cinámico con un disolvente mixto de metanol y agua, el uso de la cantidad mínima de disolvente caliente para disolver el sólido (Figura 3.60a) dio como resultado que el sólido se estrellara inmediatamente de la solución cuando la solución se retiró de la fuente de calor (Figura 3.60b). Para remediar este problema, el sólido se volvió a colocar en el baño de vapor, se añadió metanol adicional (disolvente soluble), se llevó a ebullición para disolver el sólido, y luego se enfrió. Entonces el sólido comenzó a cristalizar mucho más lentamente (Figura 3.60c), tardando un periodo de 15 minutos para cristalizar completamente.

- Si la cantidad mínima de disolvente caliente necesaria para disolver el sólido alcanzó una altura menor que\(1 \: \text{cm}\) en el matraz, el matraz puede ser demasiado grande para la cristalización. Una piscina de solvente poco profunda tiene una alta área de superficie, lo que conduce a un enfriamiento rápido. Transfiera la solución a un matraz más pequeño (usando algún disolvente para enjuagar el matraz, y luego hervir la misma cantidad de disolvente utilizada para el enjuague) y repita la cristalización.
- Asegúrese de usar un vidrio de reloj sobre la parte superior del matraz Erlenmeyer para atrapar el calor y coloque el matraz encima de algún material para aislar el fondo (varias toallas de papel, un bloque de madera o un anillo de corcho). También se podría intentar un vaso de precipitados invertido para crear una atmósfera aislante alrededor del matraz de enfriamiento.
La cristalización no sucede
Puede ser bastante frustrante dejar de lado la solución disuelta para que se enfríe y no tener ninguna forma de cristales. Los métodos para iniciar la cristalización se discutieron con gran detalle previamente. Para resumir, aquí están los métodos que se pueden probar (en orden jerárquico) para formar cristales dependiendo de la apariencia de la solución:
- Si la solución está turbia, rasque el matraz con una varilla agitadora de vidrio.
- Si la solución es clara,
- Primero intenta rascar el matraz con una varilla agitadora de vidrio.
- Agregue un cristal semilla (una pequeña mota de sólido crudo guardado antes de que comenzara la cristalización, o un poco de sólido puro del frasco de reactivo).
- Sumerja una varilla agitadora de vidrio en la solución, retírela y deje que el disolvente se evapore para producir un residuo delgado de cristales en la varilla (Figura 3.61). Luego toque la varilla a la superficie de la solución, o revuelva la solución con la varilla para desalojar pequeños cristales de semilla.
- Devuelva la solución a la fuente de calor y hierva una porción de disolvente (quizás la mitad), luego vuelva a enfriar.
- Baje la temperatura del baño de enfriamiento.
- Si se ven muy pocos cristales, es probable que haya demasiado disolvente. Devuelva la solución a la fuente de calor y hierva una porción de disolvente, luego vuelva a enfriar.
- Si todo lo demás falla, el disolvente siempre se puede eliminar por evaporación rotatoria para recuperar el sólido crudo. Se puede intentar otra cristalización, quizás con un sistema disolvente diferente.

El rendimiento es pobre
Una cristalización puede resultar con un rendimiento realmente pobre (por ejemplo, menor que\(20\%\)). Hay varias razones por las que esto podría suceder:
- Se pudo haber usado demasiado disolvente durante la cristalización y, por lo tanto, se perdieron grandes cantidades de compuesto en las aguas madres. Si el licor madre (el filtrado después de la filtración por succión) no se ha desechado, esto se puede probar sumergiendo una varilla de agitación de vidrio en el licor madre y dejándolo secar. Si el disolvente se evapora para dejar un residuo grande en la varilla, queda mucho compuesto en solución. El compuesto adicional se puede recuperar eliminando por ebullición parte del disolvente y repitiendo la cristalización (esto se llama “cristalización de segunda cosecha”), o eliminando todo el disolvente por evaporación rotatoria y repitiendo la cristalización con un disolvente diferente.
- Se puede haber usado demasiado disolvente al intentar disolver impurezas semiinsolubles. Si este pudo haber sido el caso, se podría haber intentado una filtración en caliente para eliminar las impurezas. (El sólido tendría que ser recuperado de las aguas madres primero a través de evaporación rotatoria para intentar nuevamente la cristalización).
- Se puede haber usado demasiado carbón para decolorar la solución (una solución de brea negra tiene demasiado carbón vegetal). Demasiado carbón vegetal disminuye el rendimiento ya que el carbón puede adsorber el compuesto deseado junto con las impurezas. No hay manera de recuperar el producto una vez que es adsorbido por carbón vegetal.
- Si se utilizó una etapa de filtración en caliente, el compuesto puede haberse perdido en el papel de filtro y/o en el tallo del embudo. Además, es posible que se haya usado demasiado disolvente al agregar una porción para calentar el sistema antes de la filtración. El disolvente extra antes de la filtración se suma a la “cantidad mínima de disolvente caliente” y si está en exceso sustancial, puede causar una pérdida de compuesto a las aguas madres.
- Si el sólido impuro era producto de una reacción química, es posible que la reacción no haya funcionado bien. Esto podría evaluarse si se hubiera obtenido una masa bruta: si la masa bruta era muy baja para empezar, entonces el bajo rendimiento cristalizado se debió a problemas con la reacción, no a la cristalización.
Si no se obtuvo una masa bruta, se puede utilizar la evaluación de los volúmenes rugosos de sólido antes y después de la cristalización. Si los volúmenes fueran similares, la pérdida de rendimiento puede no deberse a problemas con la cristalización. Tenga en cuenta que los sólidos cristalizados tienden a ser mucho más “esponjosos” que los sólidos crudos (Figura 3.62), por lo que “observar” los volúmenes de sólidos es solo una evaluación muy aproximada de la cantidad.

Forma De Gotas Líquidas (Los Sólidos “Aceites Fuera”)
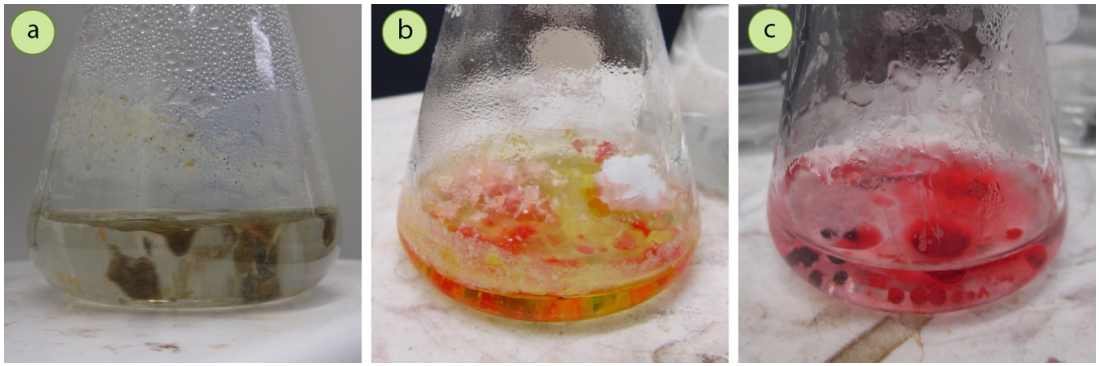
Al enfriarse, un compuesto puede salir de la solución como un líquido en lugar de un sólido (Figura 3.63). Este proceso se llama “engrasado” y ocurre cuando el punto de fusión del sólido es inferior a la temperatura de la solución. Esto es un problema en la cristalización porque cuando los compuestos se licuan primero, rara vez forman cristales puros. Esto se debe a que las impurezas a menudo se disuelven mejor en las gotitas líquidas que en el disolvente. La Figura 3.63c muestra una muestra de acetanilida cruda que se ha aceitado (las gotitas son acetanilida líquida impura), y la muestra está contaminada con una impureza de rojo de metilo (que aparece roja en el pH bajo de la solución, artefacto de cómo se sintetizó el sólido crudo). Las gotas oleosas de acetanilida aparecen más coloreadas que la solución, lo que indica una mayor cantidad de impureza de rojo de metilo disuelta. Si un líquido aceitado finalmente se solidifica, a menudo forma un sólido no cristalino impuro similar al vidrio.
Las razones para engrasar son varias, y puede suceder mientras se disuelve el sólido y durante la cristalización. Puede ser que el punto de fusión del sólido sea naturalmente bajo. También puede ser que un sólido sea tan impuro que su punto de fusión se reduzca drásticamente (ya que las impurezas bajan el punto de fusión).
Hay varias formas de intentar arreglar una solución engrasada:
- Devuelva la muestra a la fuente de calor y agregue un poco más de disolvente, luego vuelva a enfriar la solución. (Si usa un sistema de disolvente mixto, agregue más del “solvente soluble”). El sólido puede haber salido de la solución demasiado rápido (y por lo tanto a una temperatura por encima de su punto de fusión), por lo que puede permanecer soluble por más tiempo si hay más disolvente.
- Agrega un paso de carbón si no era ya parte de la cristalización. El sólido puede estar fundiendo porque hay grandes cantidades de impurezas, que el carbón vegetal puede eliminar. Esto especialmente podría funcionar si se nota un tinte de color en la solución caliente.
Si alguno de estos métodos falla, recuperar el sólido crudo por evaporación rotatoria e intentar otra cristalización. Si el intento fallido utilizó un disolvente mixto, pruebe con un solo disolvente si es posible. O elija otro disolvente con propiedades de solubilidad similares, pero con un punto de ebullición más bajo. Por ejemplo, si se utilizó etanol como disolvente la primera vez, repetir la cristalización usando metanol. El metanol tiene propiedades de solubilidad similares a las del etanol, pero su punto de ebullición más bajo puede permitir que el sólido salga de la solución por encima de su punto de fusión.


