4.4: ¿Qué Capa es Cuál?
- Page ID
- 73808
Densidad
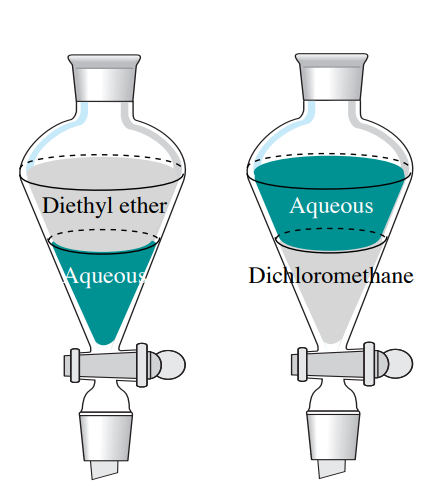
Es fundamental que se sepa si la capa acuosa está por encima o por debajo de la capa orgánica en el embudo de separación, ya que dicta qué capa se mantiene y cuál es finalmente desechada. Dos disolventes inmiscibles se apilarán uno encima del otro en función de las diferencias de densidad. La solución con menor densidad descansará en la parte superior, y la solución más densa descansará en la parte inferior.
La mayoría de los disolventes orgánicos no halogenados tienen densidades menores a 1 g/mL, por lo que flotarán sobre una solución acuosa (si son inmiscibles). Una excepción notable es que los disolventes halogenados son más densos que el agua (tienen densidades mayores a 1 g/mL), y así se hundirán por debajo de las soluciones acuosas (Cuadro 4.1 y Figura 4.8).
| Solvente | Densidad (g/mL) |
|---|---|
| Pentano | 0.626 |
| Éter de petróleo (mezcla de hidrocarburos C5 - C6) | 0.653 |
| Hexanos (mezcla de 6 hidrocarburos) | 0.655 |
| Éter dietílico | 0.713 |
| Acetato de etilo | 0.902 |
| Agua | 0.998 |
| Diclorometano (CH 2 Cl 2) | 1.33 |
| Cloroformo (CHCl 3) | 1.49 |
Muchas soluciones utilizadas en embudos separatorios están bastante diluidas, por lo que la densidad de la solución es aproximadamente la misma que la densidad del disolvente. Por ejemplo, si se mezcla éter dietílico y una\(10\% \: \ce{NaOH} \left( aq \right)\) solución en un embudo separador, no es necesario conocer la densidad exacta de la\(10\% \: \ce{NaOH}\) solución. Una\(10\% \: \ce{NaOH} \left( aq \right)\) solución es\(90\%\) agua (en masa), lo que significa que la densidad debe estar bastante cerca de la densidad del agua (aproximadamente\(1 \: \text{g/mL}\)). La densidad real de una\(10\% \: \ce{NaOH} \left( aq \right)\) solución es\(1.1089 \: \text{g/mL}\), un valor sólo ligeramente mayor que la densidad del agua. El éter dietílico será la capa superior en esta situación.
Sin embargo, hay momentos en los que pueden disolverse las partículas de soluto que la densidad de una solución es mucho mayor que la densidad del disolvente. Por ejemplo, una\(\ce{NaCl} \left( aq \right)\) solución saturada tiene una densidad alrededor\(1.2 \: \text{g/mL}\) (significativamente mayor que la densidad del agua), y puede causar problemas de separación con disolventes de densidades similares como el diclorometano.
Cómo Determinar la Capa Acuosa
Se pueden usar densidades de solventes para predecir qué capa es orgánica y cuál es acuosa en un embudo separador, pero existen otros métodos que pueden ser útiles en esta determinación. Si no está seguro de qué capa es acuosa y qué capa es orgánica, haga una de las siguientes cosas:
- Agrega un poco de agua de una botella de chorro al embudo separador (Figura 4.9a) y observa a dónde van las gotas de agua.
Si la capa superior es acuosa, las gotas de agua deben mezclarse con la capa superior, y se verán como si desaparecieran. Si la capa inferior es acuosa, las gotas de agua caerán a través de la capa superior para mezclarse con la capa inferior (como lo indica una flecha en la Figura 4.9b+c). Si es difícil rastrear hacia dónde van las gotas de agua, también realice un seguimiento del volumen de las capas: cualquiera que sea la capa que aumente con la adición de agua es la capa acuosa.

- Considerar volúmenes relativos de disolventes acuosos y orgánicos, con base en las cantidades utilizadas en el experimento.
La Figura 4.10a muestra un\(125 \: \text{mL}\) embudo separador que contiene\(10 \: \text{mL}\) hexano y\(100 \: \text{mL}\) agua (teñida con tinte azul). Si estas fueran las cantidades utilizadas en un experimento, la capa acuosa tendría que ser la capa inferior ya que es mucho más grande. Aunque inequívoco en este caso, es importante saber que la extraña forma del embudo separador puede hacer que juzgues mal los volúmenes. En la Figura 4.10b se muestra un embudo separador con volúmenes iguales de capas acuosa y orgánica, aunque las capas se elevan a diferentes alturas en el embudo.

\(^1\)Los disolventes enumerados en el Cuadro 4.1 son compuestos puros excepto para éter de petróleo y hexanos. “Éter de Petróleo” contiene pentano, 2-metilbutano, 2,2-dimetilpropano, n-hexano, 2-metilpentano, 3-metilpentano, 2,2-dimetilbutano y 2,3-dimetilbutano. “Hexanos” contiene 2-metilpentano, 3-metilpentano, n-hexano y metilciclopentano.


