4.5: Teoría de la Extracción
- Page ID
- 73809
Coeficiente de partición/distribución\(\left( K \right)\)
Cuando una solución se coloca en un embudo separador y se agita con un disolvente inmiscible, los solutos a menudo se disuelven en parte en ambas capas. Se dice que los componentes se “dividen” entre las dos capas, o se “distribuyen” entre las dos capas. Cuando se ha establecido el equilibrio, la relación de concentración de soluto en cada capa es constante para cada sistema, y esto puede ser representado por un valor\(K\) (denominado coeficiente de partición o coeficiente de distribución).
\[K = \dfrac{\text{Molarity in organic phase}}{\text{Molarity in aqueous phase}}\]
Por ejemplo, la morfina tiene un coeficiente de reparto de aproximadamente 6 en acetato de etilo y agua. \(^2\)Si las ojeras representan moléculas de morfina,\(1.00 \: \text{g}\) la morfina se distribuiría como se muestra en la Figura 4.11.
![Diagrama de morfina junto al diagrama de separación. Imagen A: 50 mililitros de acetato de etilo por encima de 50 mililitros de agua en matraz, puntos negros (que representan morfina) disueltos en ambos. A continuación, la ecuación dice K = [morfina] acetato de etilo/[morfina] agua = 0.0600 Moles/0.0101 Moles = 5.95. B: 25 mililitros de acetato de etilo sobre 50 mililitros de agua en matraz, puntos negros en ambos. A continuación, la ecuación dice K = 0.105 moles por encima de 0.0177 moles = 5.93.](https://chem.libretexts.org/@api/deki/files/126150/Nichols_Screenshot_4-4-1.png)
Obsérvese que con volúmenes iguales de fases orgánica y acuosa, el coeficiente de reparto representa la relación de partículas en cada capa (Figura 4.11a). Al usar volúmenes iguales, a\(K\) de\(\sim 6\) significa que habrá seis veces más moléculas de morfina en la capa orgánica que en la capa acuosa. La relación de partículas no es tan simple cuando los volúmenes de capa son diferentes, pero la relación de concentraciones siempre es igual a la\(K\) (Figura 4.11b).
Los coeficientes de partición reflejan la solubilidad de un compuesto en las capas orgánica y acuosa, y por lo tanto depende del sistema disolvente utilizado. Por ejemplo, la morfina tiene una\(K\) de aproximadamente 2 en éter de petróleo y agua, y una\(K\) de aproximadamente 0.33 en éter dietílico y agua. \(^2\)Cuando el\(K\) es menor de uno, significa que el compuesto se divide en la capa acuosa más que la capa orgánica.
Elección de un Solvente con Datos de Solubilidad
El coeficiente de partición\(K\) es la relación de la concentración del compuesto en la capa orgánica en comparación con la capa acuosa. Los coeficientes de partición reales son experimentales, pero se pueden estimar usando datos de solubilidad.
\[\begin{align} K &= \dfrac{\text{Molarity in organic phase}}{\text{Molarity in aqueous phase}} \\[4pt] & \approx \dfrac{\text{Solubility in organic phase}}{\text{Solubility in aqueous phase}} \end{align}\]
Los\(K\) 's calculados usando valores de molaridad y solubilidad no son idénticos ya que están involucrados diferentes equilibrios. El verdadero\(K\) representa el equilibrio entre soluciones acuosas y orgánicas, mientras que los datos de solubilidad representan el equilibrio entre una solución saturada y la fase sólida. Sin embargo, los dos sistemas están relacionados, y los derivados\(K\) de los datos de solubilidad deben ser similares a\(K\) los reales.
| Solvente | 1 g de caffeno se disuelve en disolvente (a 25 °C) |
|---|---|
| agua | 45 mL |
| Éter dietílico | 530 mL |
| Benceno | 100 mL |
| cloroformo | 5.5 mL |
Por lo tanto, los datos de solubilidad se pueden usar para elegir un disolvente apropiado para una extracción. Por ejemplo, imagínese que la cafeína (Figura 4.12) está destinada a ser extraída de los posos de té en agua hirviendo, posteriormente extraída en un disolvente orgánico. Los datos de solubilidad para la cafeína se muestran en el Cuadro 4.2.

Tanto el éter dietílico como el benceno a primera vista parecen ser malas opciones para la extracción porque la cafeína es más soluble en agua que en cualquiera de los disolventes (si un gramo de cafeína se disuelve en\(46 \: \text{mL}\) agua, pero\(100 \: \text{mL}\) de benceno, la cafeína es más soluble en agua). Al extraer con cualquiera de estos solventes, el\(K\) sería menos de uno (ver cálculo a continuación) y sería una “batalla cuesta arriba” sacar la cafeína del agua. Sin embargo, la cafeína es más soluble en cloroformo que en agua, por lo que el cloroformo sería la mejor opción de los solventes mostrados en términos de la máxima extracción de cafeína.
\[\begin{align} K_\text{benzene} &\sim \dfrac{\left( \dfrac{1 \: \text{g caffeine}}{100 \: \text{mL benzene}} \right)}{\left( \dfrac{1 \: \text{g caffeine}}{46 \: \text{mL water}} \right)} \sim 0.46 \\[4pt] K_\text{chloroform} &\sim \dfrac{\left( \dfrac{1 \: \text{g caffeine}}{5.5 \: \text{mL chloroform}} \right)}{\left( \dfrac{1 \: \text{g caffeine}}{46 \: \text{mL water}} \right)} \sim 8.4 \end{align}\]
Otra consideración a la hora de elegir un disolvente para la extracción es la toxicidad: el cloroformo es cancerígeno y por lo tanto probablemente no sea la mejor opción a pesar de su excelente capacidad de solvatación. Otra consideración es la solubilidad de otros componentes presentes en una mezcla. Si el objetivo es extraer la cafeína preferentemente y dejar atrás otros componentes en el té, un disolvente puede ser más selectivo en este sentido.
Cuantificación de Extracción Única
La hiosciamina es un alcaloide de una planta de la familia de las soláceas (Figura 4.13a), y se usa medicinalmente para proporcionar alivio para una variedad de trastornos gastrointestinales. Sus datos de solubilidad se muestran en la Figura 4.13b.
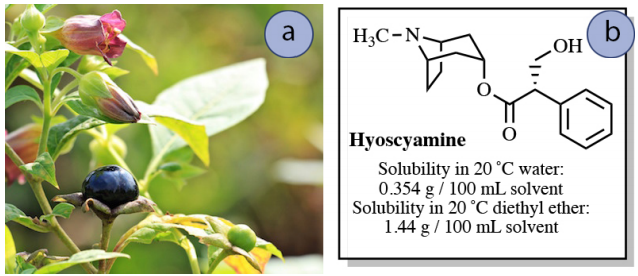
Imagínese que una solución casi saturada de \(0.50 \: \text{g}\)hiosciamina en\(150 \: \text{mL}\) agua se va a extraer en éter\(150 \: \text{mL}\) dietílico. ¿Cuánta hiosciamina se extraería en la capa de éter dietílico en este proceso?
Esta cantidad se puede aproximar usando los datos de solubilidad. Tomando la relación de solubilidad del compuesto en éter dietílico en comparación con el agua da un aproximado\(K\) de 4.
\[\begin{align} K &\sim \dfrac{\text{organic solubility}}{\text{water solubility}} \\[4pt] &\sim \dfrac{\left( 1.44 \: \text{g hyoscyamine}/100 \: \text{mL diethyl ether} \right)}{\left( 0.354 \: \text{g hyoscyamine}/100 \: \text{mL water} \right)} \\[4pt] &\sim \textbf{4.07} \: \text{(approximate} K \text{)} \end{align}\]
Si "\(x\)" es la cantidad en gramos de hiosciamina extraída en la capa de éter dietílico, entonces "\(0.50 \: \text{g} - x\)"” permanecería en la capa acuosa después de que se establezca el equilibrio. Conociendo el valor de\(K\), el valor de se\(x\) puede resolver por usar la siguiente ecuación.
\[4.07 = \dfrac{\left( \dfrac{x}{150 \: \text{mL ether}} \right)}{\left( \dfrac{0.50 \: \text{g} - x}{150 \: \text{mL water}} \right)}\]
Después de resolver el álgebra,\(x = \textbf{0.40 g}\). Este resultado significa que\(0.40 \: \text{g}\) del original\(0.50 \: \text{g}\) de hiosciamina se extrae en el éter dietílico mediante una sola extracción. Este proceso se resume en la Figura 4.14.
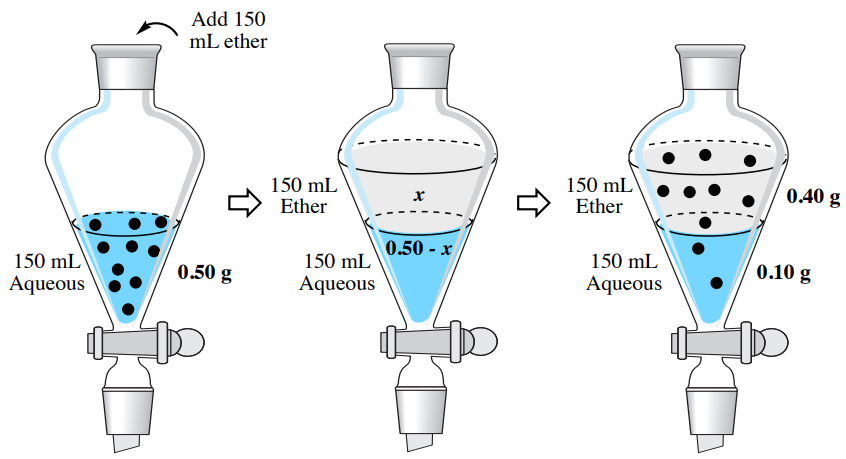
En este ejemplo, una sola extracción resultó en la extracción\(80\%\) de la hiosciamina\(\left( 100\% \times 0.40 \: \text{g}/0.50 \: \text{g} \right)\) de la capa acuosa a la capa orgánica. El reparto del compuesto entre las dos capas provocó la extracción incompleta de la muestra.
Extracciones múltiples
Descripción general de las extracciones múltiples
Dependiendo del coeficiente de reparto para un compuesto en un disolvente, una sola extracción puede ser todo lo que se necesita para extraer efectivamente un compuesto. Sin embargo, la mayoría de las veces un procedimiento requiere que una solución se extraiga varias veces para aislar un compuesto deseado, ya que este método es más eficiente que una sola extracción (ver artículo de revista en la Figura 4.15b para un ejemplo de dónde se usa este proceso).

En un procedimiento de extracción múltiple, se utiliza una cantidad de disolvente para extraer una capa (a menudo la capa acuosa) varias veces sucesivamente. La extracción se repite de dos a tres veces, o quizás más veces si el compuesto tiene un bajo coeficiente de reparto en el disolvente orgánico. La Figura 4.16 muestra un diagrama de una solución acuosa que se extrae dos veces con éter dietílico. El éter dietílico tiene una densidad menor que\(1 \: \text{g/mL}\), por lo que es la capa orgánica superior en el embudo.
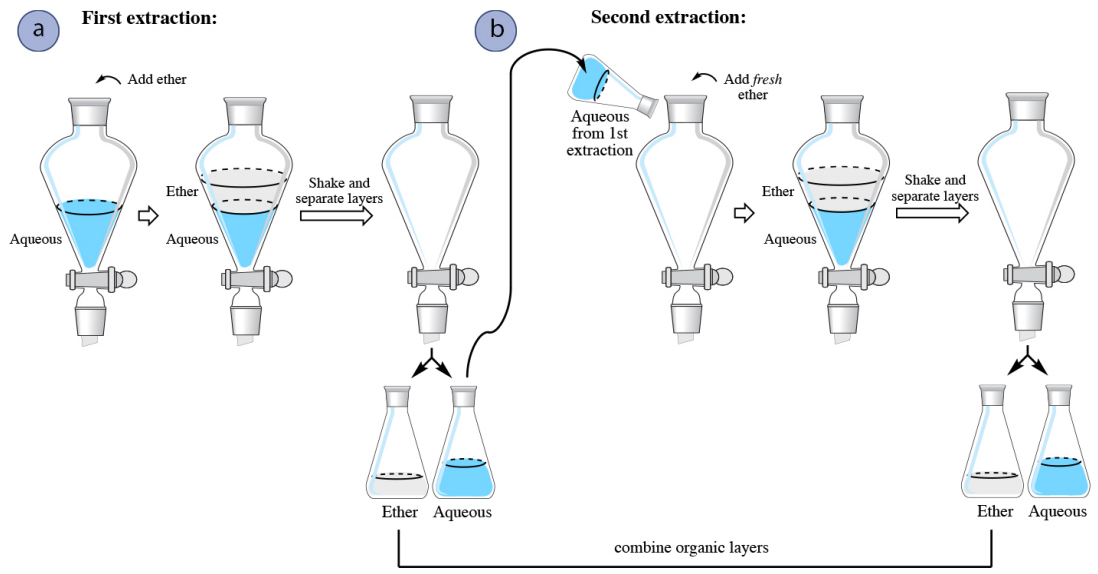
En una extracción múltiple de una capa acuosa, la primera extracción es procesalmente idéntica a una sola extracción. En la segunda extracción, la capa acuosa de la primera extracción se devuelve al embudo separador (Figura 4.16b), con el objetivo de extraer compuesto adicional. Dado que la capa orgánica de la primera extracción ya había alcanzado el equilibrio con la capa acuosa, haría poco bien devolverla al embudo separador y exponerla nuevamente a la capa acuosa. En cambio, se agrega éter dietílico fresco a la capa acuosa, ya que tiene el potencial de extraer más compuesto.
El proceso suele repetirse con una tercera extracción (no mostrada en la Figura 4.16), retornando la capa acuosa de la segunda extracción al embudo de separación, seguida de otra porción de disolvente orgánico fresco. En múltiples extracciones, las capas orgánicas se combinan entre sí, ya que el objetivo es extraer el compuesto en el disolvente orgánico.
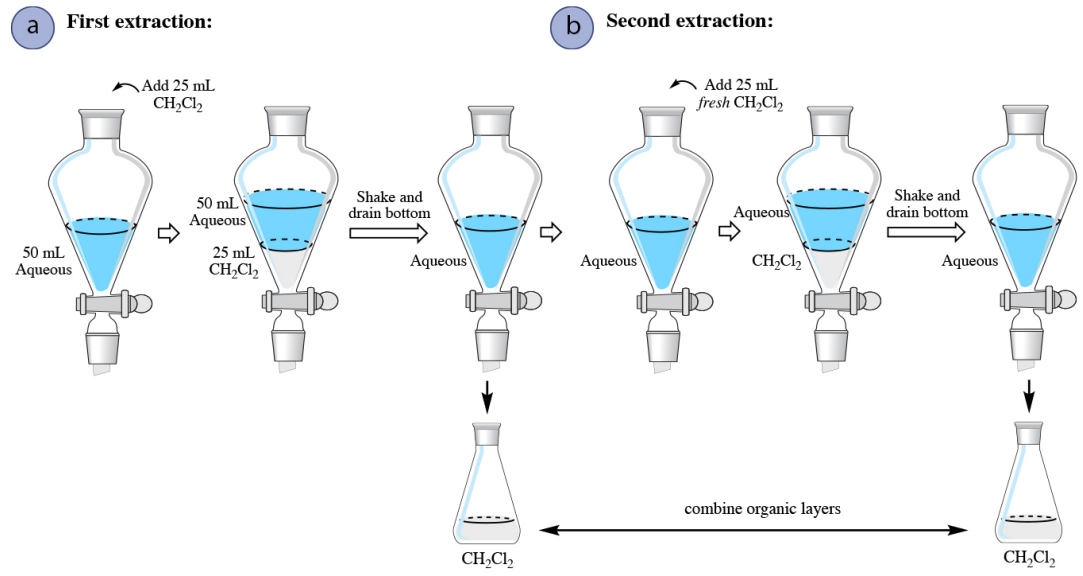
Cuando se extrae una solución acuosa con un disolvente orgánico que es más denso que el agua (por ejemplo diclorometano\(\ce{CH_2Cl_2}\)), la única diferencia de procedimiento es que no hay necesidad de drenar nunca la capa acuosa del embudo separador. Después de drenar la capa orgánica de la primera extracción, se puede agregar disolvente fresco a la capa acuosa que queda en el embudo para comenzar la segunda extracción (Figura 4.17b).
Cuantificación de extracción múltiple
Para demostrar la efectividad de una extracción múltiple, volvamos al problema desde la sección de extracción única, donde una solución de \(0.50 \: \text{g}\)hiosciamina en\(150 \: \text{mL}\) agua se va a extraer en éter dietílico. En lugar de usar una\(150 \: \text{mL}\) porción, dividamos el disolvente en tres\(50 \: \text{mL}\) porciones de éter dietílico. ¿Cuánta hiosciamina se extraería con este método?
En el apartado anterior se utilizaron datos de solubilidad para estimar el coeficiente de partición\(K\), y se encontró que era de 4.07. Como antes, podemos asignar a la cantidad de hiosciamina extraída en el éter dietílico el valor\(x\) "”, lo que dejaría "\(0.50 \: \text{g} - x\)" "restante en la capa acuosa de la primera extracción. Utilizando\(K\), el cálculo es idéntico a la discusión anterior, difiriendo solo en el menor volumen de la capa orgánica (\(50 \: \text{mL}\)en lugar de\(150 \: \text{mL}\)).
\[4.07 = \dfrac{\left( \dfrac{x}{50 \: \text{mL ether}} \right)}{\left( \dfrac{0.50 \: \text{g} - x}{150 \: \text{mL water}} \right)}\]
Después de resolver el álgebra,\(x = 0.29 \: \text{g}\). Este resultado significa que\(0.29 \: \text{g}\) se extrae en el éter dietílico en la primera extracción y\(0.21 \: \text{g}\) permanece en la capa acuosa\(\left( 0.50 \: \text{g} - 0.29 \: \text{g} \right)\). A medida que la capa acuosa se devuelve al embudo separador, el residuo\(0.21 \: \text{g}\) es la cantidad a extraer más, lo que altera el cálculo para la segunda extracción al reemplazar el\(0.50 \: \text{g}\) valor.
\[4.07 = \dfrac{\left( \dfrac{x}{50 \: \text{mL ether}} \right)}{\left( \dfrac{0.21 \: \text{g} - x}{150 \: \text{mL water}} \right)}\]
Después de resolver el álgebra,\(x = 0.12 \: \text{g}\). Este resultado significa que\(0.12 \: \text{g}\) se extrae en el éter dietílico en la segunda extracción y\(0.09 \: \text{g}\) permanece en la capa acuosa\(\left( 0.21 \: \text{g} - 0.12 \: \text{g} \right)\). El cálculo para la tercera extracción es el siguiente:
\[4.07 = \dfrac{\left( \dfrac{x}{50 \: \text{mL ether}} \right)}{\left( \dfrac{0.09 \: \text{g} - x}{150 \: \text{mL water}} \right)}\]
Después de resolver el álgebra,\(x = 0.05 \: \text{g}\). Este resultado significa que\(0.04 \: \text{g}\) permanece en la capa acuosa\(\left( 0.09 \: \text{g} - 0.05 \: \text{g} \right)\) después de la tercera extracción. Los resultados de los cálculos de esta sección se resumen en la Figura 4.18.
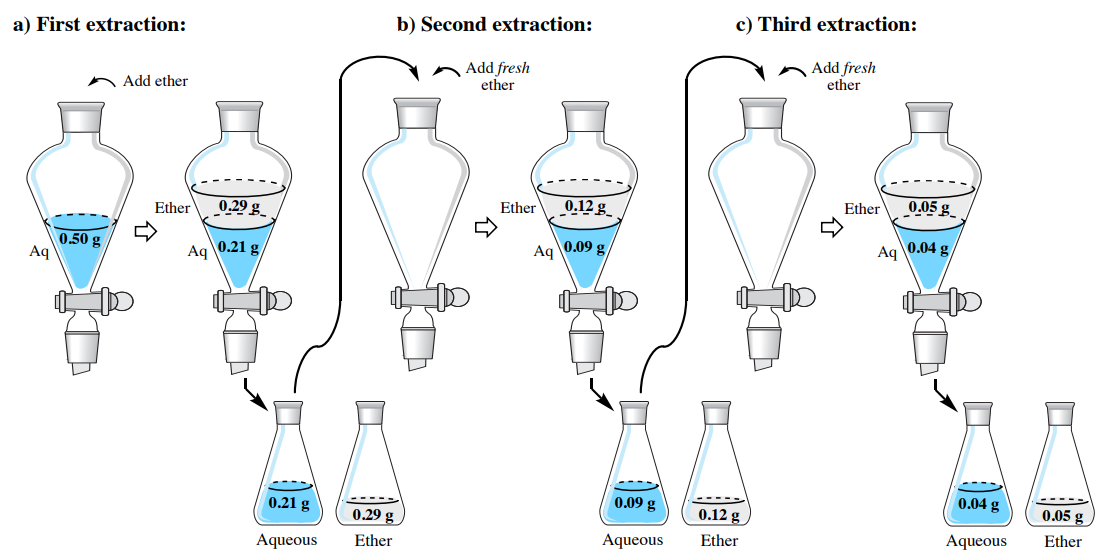
Si los extractos de éter\(50 \: \text{mL}\) dietílico se combinan en este ejemplo (Figura 4.19), habría un total\(0.46 \: \text{g}\) de hiosciamina en los extractos orgánicos combinados. De\(0.50 \: \text{g}\) la hiosciamina en la capa acuosa original, \(92\%\)del material se extrae en la capa orgánica\(\left( 100\% \times 0.46 \: \text{g}/0.50 \: \text{g} \right)\). Esta es una cantidad mayor a la que se obtuvo usando una sola extracción de éter\(150 \: \text{mL}\) dietílico, lo que resultó en solo\(0.40 \: \text{g}\) de hiosciamina extraída (\(80\%\)).
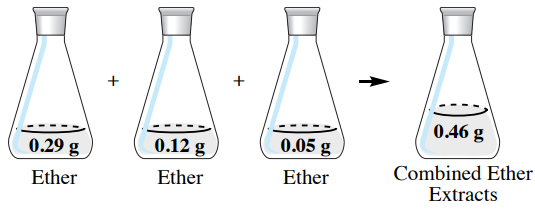
Estos cálculos demuestran que el uso de múltiples porciones de un solvente maximiza el poder extractivo del solvente. En general, tres extracciones son el compromiso óptimo entre el esfuerzo realizado y la maximización de la recuperación del material.
\(^2\)Los coeficientes de partición se aproximaron utilizando los datos de solubilidad encontrados en: A. Seidell, Solubilidades de Sustancias Inorgánicas y Orgánicas, D. Van. Compañía Nostrand, 1907.
\(^3\)De: The Merck Index, 12\(^\text{th}\) edición, Laboratorios de Investigación Merck, 1996.


