5.2A: Usos de la destilación simple
- Page ID
- 73879
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Concentración de Alcohol
Los granos fermentados pueden producir un contenido máximo de alcohol de aproximadamente\(16\%\), el límite superior de la mayoría de las cervezas y vinos, ya que el organismo de levadura utilizado en la fermentación no puede sobrevivir en soluciones alcohólicas más concentradas. Sin embargo, los licores como la ginebra, el vodka y el ron suelen tener un contenido de alcohol de aproximadamente\(40\%\) por volumen. La destilación es el método utilizado para concentrar soluciones fermentadas y producir licores duros. Una destilación de jugo de uva fermentada se realiza comúnmente en laboratorios académicos (Figura 5.2).

La Figura 5.3 muestra la destilación del vino tinto. Observe cómo el vino se purifica notablemente en el proceso ya que el destilado es claro (Figura 5.3d). Todos los productos alcohólicos concentrados al principio destilan claros, pero algunos se colorean durante el proceso de envejecimiento (de los componentes que se lixivian de los barriles en los que se almacenan, o de la oxidación).

Se puede probar que la destilación del vino tinto ha concentrado el alcohol a través de una prueba de llama, que es el origen del término “prueba”. En el\(^\text{th}\) siglo 16 cuando el ron era un artículo de trueque, se probaba regularmente para asegurarse de que no se había regado. Una muestra alcohólica que es\(57\%\) alcohol por volumen es capaz de prenderse fuego, mientras que las soluciones más diluidas no pueden, permitiendo que la ignición sirva como “prueba” del contenido de alcohol. El vino tinto utilizado en la Figura 5.3 no se encendió, lo cual es consistente con su etiqueta que indica que es solo\(13\%\) alcohol (Figura 5.4a). El destilado se incendió fácilmente (Figura 5.4c+d), y el análisis de densidad mostró que era\(67\%\) alcohol.

Agua Destilada
El acceso a agua limpia y dulce es un problema importante que enfrenta el mundo hoy en día. En los países vecinos del océano, la desalinización de agua de mar se utiliza a veces para proporcionar al país agua potable. La destilación es uno de los principales métodos\(^1\) utilizados para purificar el agua del océano y funciona bien ya que la sal, los microorganismos y otros componentes del agua de mar son no volátiles. La principal desventaja de destilar el agua es que el proceso requiere mucha energía, y a menos que se diseñe creativamente, la economía puede ser un gran disuasivo para usar el método. El calor liberado de una planta de energía a menudo se usa para proporcionar la energía para la destilación del agua de mar, y Arabia Saudita e Israel utilizan principalmente centrales eléctricas acopladas y destilerías para obtener aproximadamente la mitad del agua dulce necesaria para sus países. \(^2\)
Junto con el agua potable, el agua destilada es necesaria para el trabajo de laboratorio científico ya que las sales disueltas en el agua del grifo pueden interferir con algunos experimentos. Muchos edificios científicos tienen sus propios generadores de agua destilada (Figura 5.5a), lo que permite llenar botellas de lavado y bombonas con un giro de la espita (Figura 5.5b).

Purificación de Reactivos y Productos
La destilación es una excelente herramienta de purificación para muchos líquidos, y se puede utilizar para purificar productos de una reacción química. La Figura 5.6 muestra la destilación de una muestra bruta de acetato de isoamilo, formada a través de una reacción de esterificación de Fischer. La muestra cruda era originalmente amarilla (Figura 5.6a), pero el destilado era incoloro (Figura 5.6d), haciendo evidente la eliminación de algunos materiales a través del proceso.

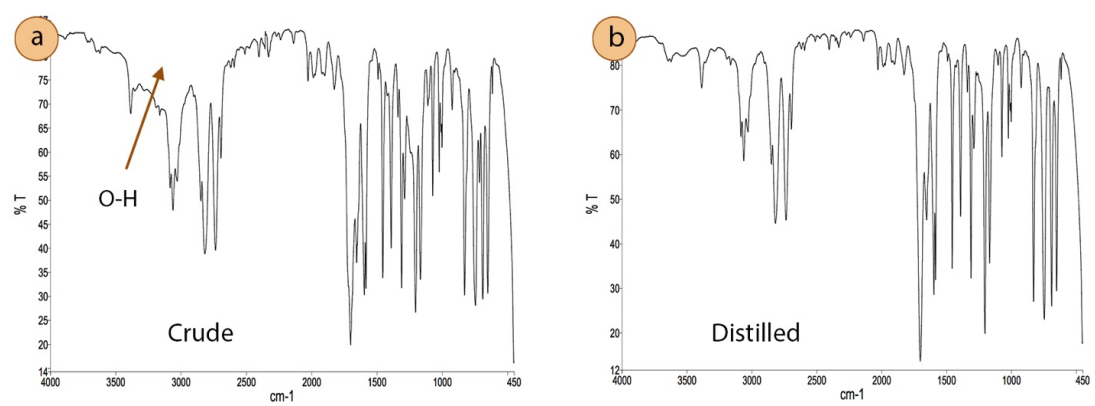
La destilación también se puede utilizar para purificar reactivos que se han degradado con el tiempo. La Figura 5.7a muestra una botella de benzaldehído que se ha oxidado parcialmente, como lo demuestran los cristales de ácido benzoico vistos adheridos al interior del vidrio (indicado con una flecha). Una simple destilación purificó la muestra de benzaldehído, y su efectividad se demostró a través de la comparación de los espectros infrarrojos (IR) del material original (Figura 5.8a) y el destilado (Figura 5.8b). La amplia región indicada por una flecha en la Figura 5.8a representa el\(\ce{O-H}\) tramo de un ácido carboxílico (ácido benzoico), y el espectro IR del destilado carece de esta característica.

\(^1\)Más a menudo, la destilación al vacío se utiliza para la desalinización, ya que la presión más baja permite que la ebullición ocurra a una temperatura más baja (lo que requiere menos energía). La destilación al vacío del agua de mar sigue siendo intensiva en energía. La ósmosis inversa también se utiliza para la desalinización de agua de mar.
\(^2\)Pyper, Julia, “Israel está creando un excedente de agua utilizando la desalinización”, E+E News, 7 de febrero de 2014.


