6.3A: Descripción general de la sublimación
- Page ID
- 74177
Algunos compuestos son capaces de sublimación, que es el cambio directo de fase de sólido a gas. El dióxido de carbono sólido es un ejemplo de una sustancia que se sublima fácilmente a presión atmosférica, ya que un pedazo de hielo seco no se derretirá, sino que parecerá “desaparecer” a medida que se convierte directamente en gas dióxido de carbono. La sublimación es un proceso análogo a la ebullición, ya que ocurre cuando la presión de vapor de un compuesto es igual a su presión aplicada (a menudo la presión atmosférica). La diferencia es que la sublimación implica la presión de vapor de un sólido en lugar de la de un líquido. La mayoría de los sólidos no tienen una presión de vapor apreciable a temperaturas de fácil acceso, y por esta razón la capacidad de sublime es poco común. Los compuestos que son capaces de sublimación tienden a ser aquellos con fuerzas intermoleculares débiles en estado sólido. Estos incluyen compuestos con estructuras simétricas o esféricas. Ejemplos de compuestos que pueden ser sublimados están en la Figura 6.28.
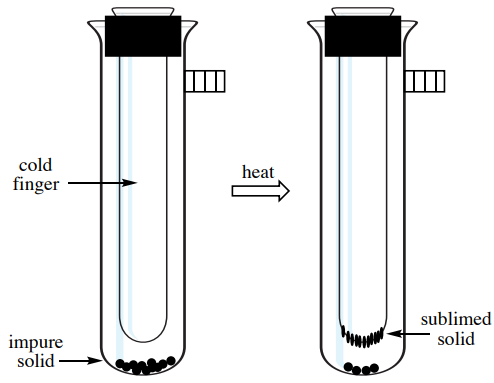
Como relativamente pocos sólidos son capaces de sublimación, el proceso puede ser un excelente método de purificación cuando un sólido volátil está contaminado con impurezas no volátiles. El sólido impuro se calienta en el fondo de un recipiente muy próximo a una superficie fría, llamada "dedo frío" (Figura 6.29). A medida que el sólido volátil se sublima, se deposita sobre la superficie del dedo frío (donde posteriormente se puede recuperar), y así se separa de la sustancia no volátil que queda en el recipiente. La sublimación es un ejemplo de una técnica de “química verde”, ya que no se utilizan disolventes y no se generan residuos. El proceso, sin embargo, no es particularmente eficiente para separar sólidos volátiles entre sí.
De los sólidos con presiones de vapor apreciables a temperatura ambiente, muchos aún requieren temperaturas bastante altas para sublimes activamente (cuando su presión de vapor es igual a la presión atmosférica de casi\(760 \: \text{mm} \: \ce{Hg}\)). Si estos sólidos se calientan a sus puntos de sublimación bajo presión atmosférica, algunos se cargarán y se descompondrán durante el proceso. Por esta razón, es muy común realizar sublimación bajo presión reducida (sublimación al vacío). Análogamente a la destilación al vacío en la que el líquido hierve cuando su presión de vapor es igual a la presión reducida en el aparato, en la sublimación al vacío el sólido sublima cuando su presión de vapor es igual a la presión reducida en el aparato. En la destilación al vacío, la reducción de la presión permite que los líquidos hiervan a una temperatura más baja. De igual manera, reducir la presión en la sublimación al vacío permite que los sólidos se sublimen a una temperatura más baja, lo que evita la descomposición.
\(^8\)Según lo reportado en D. D. Perrin, W. L. F. Armarego, Purificación de Químicos Orgánicos, Pergamon Press, 3\(^\text{rd}\) edición, 1988.


