3.1: Introducción
- Page ID
- 54655
Las proteínas son los caballos de batalla de las células, responsables de casi todos los aspectos de la vida (¡mira la oxitocina en la caricatura)! Comprendidos por uno o más polipéptidos, estos:
- son los catalizadores que hacen posibles las reacciones bioquímicas.
- son componentes de membrana que permiten selectivamente que las sustancias entren y salgan de la célula.
- permitir la comunicación célula-célula y la respuesta de la célula al cambio ambiental.
- forman la estructura interna de las células (citoesqueleto) y los núcleos (nucleoesqueleto).
- permitir la motilidad de las células y las cosas dentro de las células.
- son de hecho responsables de otras funciones celulares demasiado numerosas para resumirlas aquí!
Se debe mucho de lo que sabemos sobre la estructura biomolecular al desarrollo de la cristalografía de rayos X. De hecho, una determinación temprana de la estructura de la insulina (así como la penicilina y la vitamina B12) mediante cristalografía de rayos X le valió a Dorothy Hodgkins el Premio Nobel de Química de 1964. En este capítulo, nos fijamos en los diferentes niveles de estructura proteica..., de hecho lo que se necesita para ser una proteína funcional.
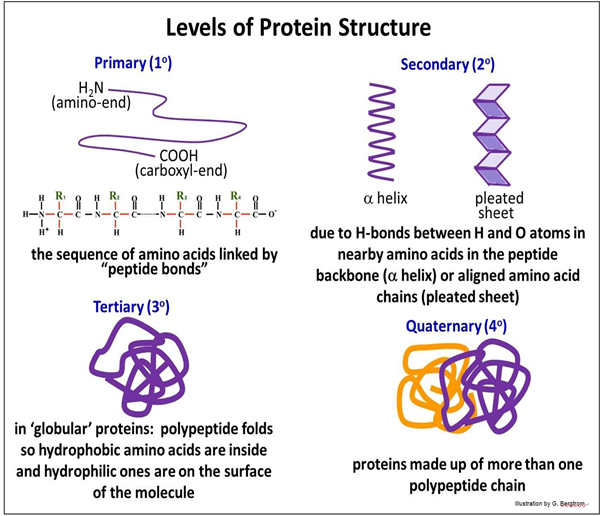
La estructura primaria (1 o estructura) de un polipéptido es su secuencia de aminoácidos. Las interacciones entre aminoácidos cercanos entre sí en la secuencia hacen que el polipéptido se pliegue en estructuras secundarias (2 o), incluyendo una hélice y conformaciones de lámina b- o plisada. Las estructuras terciarias (3 o) se forman cuando las interacciones no covalentes entre las cadenas laterales de aminoácidos a cierta distancia entre sí en la secuencia primaria hacen que el polipéptido se pliegue aún más en un complejo tridimensional estructura. Otras proteínas (¡llamadas chaperonas!) facilitar el plegado preciso de un polipéptido en conformaciones correctas, bioactivas y tridimensionales. La estructura cuaternaria (4 o) se refiere a proteínas compuestas por dos o más polipéptidos. Consulte los cuatro niveles de estructura en la página siguiente mientras exploramos cómo cada nivel afecta la forma y la función biológica/bioquímica de la proteína.
Los enlaces covalentes entre aminoácidos específicos (por ejemplo, cisteínas) que terminan cerca uno del otro después del plegamiento pueden estabilizar estructuras terciarias y cuaternarias. Muchas proteínas también se unen a iones metálicos (por ejemplo, Mg++, Mn++) o pequeñas moléculas orgánicas (por ejemplo, hemo) antes de que se vuelvan funcionalmente activas. Finalmente, miramos más allá de estos órdenes de estructura en sus dominios y motivos que han evolucionado para realizar una u otra función proteica específica.
Claramente, al tratar de entender la función molecular (especialmente macromolecular), surge un tema recurrente: la función de una proteína depende de su conformación. A su vez, la conformación de proteínas se basa en la ubicación y las propiedades físicas y químicas de los grupos funcionales críticos, generalmente cadenas laterales de aminoácidos. Esté atento a este tema mientras miramos la catálisis enzimática, el movimiento de moléculas dentro y fuera de las células, la respuesta de las células en su entorno, la capacidad de las células y orgánulos para moverse, cómo se replica el ADN, cómo se regulan la transcripción génica y la síntesis de proteínas..., ¡casi todo lo que hace una célula! Concluiremos este capítulo con una mirada a algunas técnicas para estudiar la estructura proteica.
Objetivos de aprendizaje
Cuando hayas dominado la información de este capítulo, deberías ser capaz de:
1. definir y distinguir entre los órdenes de estructura proteica.
2. diferenciar entre lámina beta, hélice alfa y estructura de bobina aleatoria en función de las interacciones atómicas involucradas en cada una.
3. trazar el camino hacia la formación de un polipéptido; definir su estructura primaria y cómo se determina por 'secuenciación de proteínas'.
4. describir cómo las proteínas globulares surgen de las interacciones hidrofóbicas e hidrofílicas que impulsan el plegamiento de proteínas y cómo los cambios en la forma de las proteínas
5. formular una hipótesis (o buscar una) para explicar por qué el aminoácido glicina es un disruptor de la estructura del polipéptido alfa helicoidal.
6. comparar y contrastar el motivo y la estructura de dominios de proteínas y polipéptidos, y su contribución a la función proteica.
describir diferentes técnicas para el estudio de proteínas y las diferencias físico-químicas entre proteínas que hacen posible cada técnica.


