3.3: Los cambios en la forma de las proteínas pueden causar enfermedades
- Page ID
- 54638
Si bien la conformación de una proteína determina su función biológica, un cambio alostérico (cambio de forma) puede moderar o alterar su función. En circunstancias normales, las células utilizan cambios en la forma de las proteínas para regular el metabolismo. Dicha regulación alostérica está bien documentada en vías bioquímicas familiares como la glucólisis y se discute con más detalle en otra parte. Menos bien entendido es cómo (o por qué) es por qué el cambio conformacional en algunas células de proteínas tiene efectos devastadores.
A. Anemia drepanocítica
Los genes mutantes para las globinas pueden resultar en trastornos de hemoglobina caracterizados por un suministro ineficiente de oxígeno por la sangre. En la década de 1940, el bioquímico británico J.B.S. Haldane hizo una correlación entre regiones del sur de África con altas incidencias de trastornos de hemoglobina y malaria, sugiriendo que los individuos heterocigotos (es decir, aquellos que tenían solo una copia de un gen de hemoglobina mutante), estaban protegidos de alguna manera de la malaria. Otro ejemplo bien conocido de un trastorno de hemoglobina es la anemia falciforme, causada por un cambio de una sola base en el gen de la b-hemoglobina humana, uno de los polipéptidos en la hemoglobina. Dado que los glóbulos rojos son ricos en hemoglobina, las hemoglobinas falciformes pueden hacer que las células mismas se vuelvan en forma de hoz. Las células falciformes interrumpen el flujo capilar y la entrega de oxígeno, resultando en los síntomas de anemia La anemia falciforme se originó en África y se extendió a Estados Unidos durante la trata de esclavos. Una vez fuera de África y regiones donde el paludismo era epidémico, la mutación no tenía ningún valor, y era solo una fuente de enfermedad. Los individuos heterocigotos para la mutación de células falciformes tienen rasgo de células falciformes y generalmente no se ven afectados porque al menos parte de su hemoglobina es normal. Los individuos homocigotos producen solo la variante falciforme de la b-hemoglobina; sufrirán episodios más frecuentes y severos de la enfermedad. Los factores estresantes que pueden desencadenar la hoz incluyen infección o deshidratación. Compara los glóbulos rojos normales con una célula falciforme a continuación.
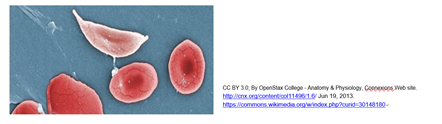
El gen de células falciformes afecta quizás a más de 100 millones de personas en todo el mundo, incluyendo 8-10% de los afroamericanos. Para obtener más información demográfica, consulte el artículo Demografía del rasgo de células falciformes y Datos de células falciformes de los CDC. En África, los heterocigotos con rasgo de células falciformes están protegidos de la malaria, lo que confirma la hipótesis de Haldane. Pero los pacientes homocigotos para la mutación b-hemoglobina obtienen poco beneficio de sus efectos antipalúdicos.
Mientras tanto, a pesar de una reducción de 33% en los casos de malaria, la enfermedad (causada por un parásito transmitido por mosquitos) sigue amenazando a la mitad de las personas en el planeta, causando más de medio millón de muertes al año. Hay tratamientos distintos a los mosquiteros y matar mosquitos, pero en este momento, todavía no existe una vacuna preventiva.
B. El mal plegamiento de los priones y la enfermedad de Alzheimer
1. La Proteína Priónica
Cuando se descubrieron por primera vez, las proteínas prión parecían comportarse como agentes infecciosos que podían reproducirse sin ADN u otro ácido nucleico. Como se puede imaginar, este mecanismo hereditario altamente poco ortodoxo y novedoso generó su parte de controversia. Lea sobre la investigación sobre la proteína priónica celular PrP c en es.wikipedia.org/wiki/Prion.
Por supuesto, los priones resultaron no ser agentes reproductivos de infección después de todo. Estudios recientes de priones han revelado varias funciones normales de la proteína priónica, como los papeles en la formación de memoria en ratones y en la esporulación en levaduras (Check out Prion Proteins May Play a Role in Memory Formation). Una versión mutante de la proteína priónica (PrP Sc) es capaz de plegarse mal, asumiendo una forma anormal. El PrP Sc deformado puede entonces inducir plegamiento anormal ¡incluso PrPC normal! Estos eventos, ilustrados a continuación, dan como resultado la formación de las llamadas placas amiloides.

En su estado anormalmente plegado, los priones se han asociado a la Enfermedad de Alzheimer (que afecta a alrededor de 5.5 millones de estadounidenses, así como con la enfermedad de la Vaca Loca y la Enfermedad de Creutzfeldt-Jakob (enfermedad de las vacas locas en humanos), así como con la Scrapie en ovejas, entre otras. Estamos empezando a entender que el papel de las proteínas priónicas en la enfermedad de Alzheimer es menos causal y algo indirecto.
2. El péptido beta amiloide (A b)
Los cerebros post mortem de pacientes que padecían la enfermedad de Alzheimer presentan placas amiloides extracelulares características compuestas principalmente por el péptido beta amiloide (A b). La escisión enzimática de la proteína APP (proteína precursora amiloide) genera péptidos extracelulares de 39-43 aminoácidos A b. En condiciones normales, los péptidos A b en exceso se digieren ellos mismos.
Sin embargo, la formación no regulada del péptido A b conduce a la formación de placas beta amiloides observadas en la enfermedad de Alzheimer, como se ilustra a continuación.
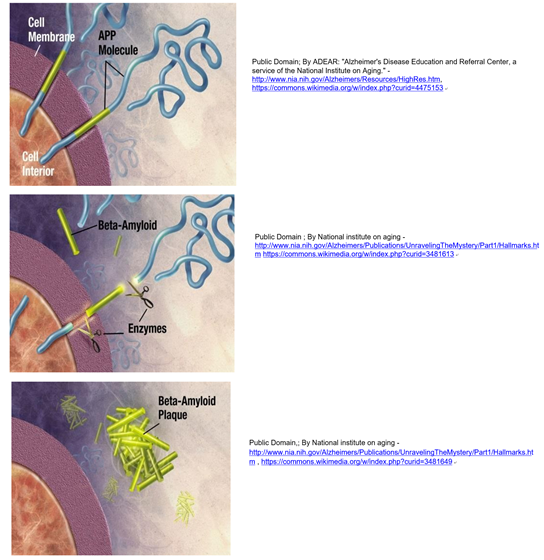
Las tijeras en la ilustración representan dos enzimas que digieren la APP. Las proteínas prión no son una causa proximal de la enfermedad de Alzheimer, pero pueden tener un papel en el inicio de eventos que conducen a ella. Se cree que la proteína priónica normal (PrP c), en sí misma un receptor de membrana, se une a los péptidos A b, previniendo eficazmente su agregación en placas. Se demostró que una reducción experimental de PrP c aumenta los péptidos A b extracelulares. Presumiblemente, la agregación de proteínas priónicas inducida por PrP mutante (PrPSc) impide que las proteínas priónicas se unan al péptido A b, lo que lleva a su acumulación y finalmente a la formación de placas amiloides y neurodegeneración.
3. La proteína Tau
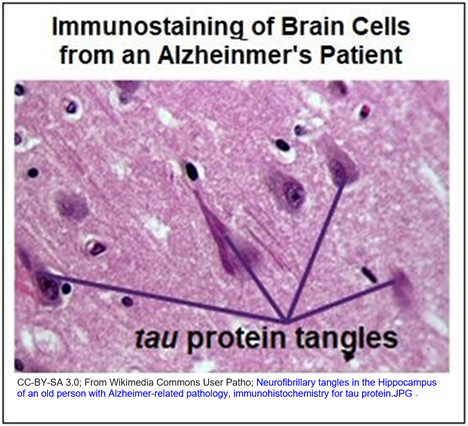
Una proteína llamada tau también se asocia con la enfermedad de Alzheimer. La tau deforme que se acumula en ovillos neurofibrilares en las neuronas cerebrales del hipocampo puede ser una causa más inmediata de la disfunción neuronal asociada a la enfermedad. En las neuronas normales, una Proteína Tau asociada a icrotúbulos M (MAP-T) es fosforilada y luego se une a, y estabiliza los microtúbulos. Pero cuando la tau neuronal se hiperfosforila, su conformación cambia. Ya no se estabilizan, los microtúbulos se desensamblan y las proteínas tau deformadas forman enredos neurofibrilares. La inmunotinción de neuronas del hipocampo con anticuerpos contra la proteína tau localiza los ovillos neurofibrilares como se ve en la micrografía a continuación.
La formación de enredos de proteína tau neurofibrilar en una neurona enferma se compara con las neuronas normales en la siguiente ilustración.
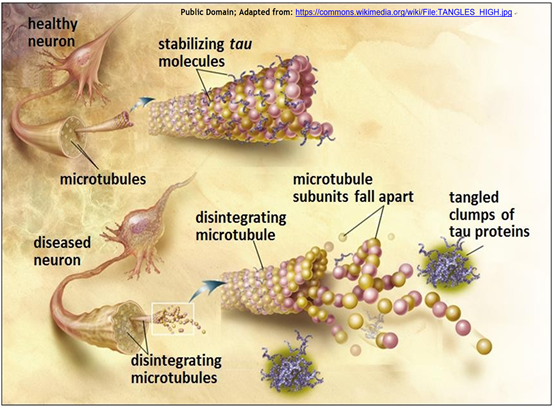
Los “grupos de enredos de proteínas tau” en esta ilustración son los que tiñen de púrpura oscuro en la micrografía de neuronas inmunotingidas en la micrografía de luz.
No existe cura para la enfermedad de Alzheimer, aunque los tratamientos con inhibidores de la colinesterasa parecen ralentizar su avance. Por ejemplo, el fármaco Aricept inhibe la descomposición de la acetilcolina por la acetilcolinesterasa, potenciando así la neurotransmisión colinérgica, que a su vez puede prolongar la función neural cerebral. Desafortunadamente, todavía no hay tratamiento para restaurar los recuerdos perdidos y el significativo deterioro cognitivo asociado a la enfermedad de Alzheimer. Quizás más prometedor en este sentido, el reciente desarrollo de un análisis de sangre puede detectar personas en riesgo de padecer la enfermedad de Alzheimer. Al suceder, las moléculas A β escapan al torrente sanguíneo hasta 8 años antes de que aparezcan los síntomas de Alzheimer. La perspectiva de la detección temprana de A β ha generado esperanzas de que nuevas terapias puedan estar en el horizonte. Para una breve reseña, consulte Detección temprana de la enfermedad de Alzheimer.
C. Algunos familiares de la enfermedad de Alzheimer
Algunas de las mismas anomalías proteicas que se observan en la enfermedad de Alzheimer también caracterizan otras enfermedades neurodegenerativas así como el daño cerebral traumático, como se analiza a continuación.
1. Encefalopatía Traumática Crónica
Una acumulación anormal de proteína tau es diagnóstico de CTE (Encefalopatía Traumática Crónica). A principios del siglo XX, los boxeadores desorientados que se tambaleaban después de una pelea se llamaban 'borrachos ponches', que padecían demencia pugilistica. Ahora sabemos que padecían de CTE, al igual que otros deportistas expuestos a traumatismos cerebrales repetitivos de leve a grave, como son los futbolistas. La inmunotinción de cerebros completos y tejido cerebral de pacientes con CTE autopsiados con anticuerpos contra la proteína tau muestran acumulaciones de proteínas tau anormales y enredos neurofibrilares de tau muy similares a los encontrados en pacientes con Alzheimer. Muchos jugadores de la Liga Nacional de Fútbol y otros futbolistas han sido diagnosticados post-mortem con CTE, y muchos que aún viven muestran signos de cognición degenerativa y comportamiento consistente con CTE (ver una Lista de_NFL_Players_with_Chronic_Traumatic_encefalopatía para ver cuántos!
2. Enfermedad de Parkinson
Este es otro ejemplo más de una enfermedad neurodegenerativa que resulta cuando una sola proteína cambia de forma en las células cerebrales. Aunque no se caracterizan como placas, se pueden formar agregados en las células cerebrales cuando la proteína alfa-sinucleína experimenta un cambio conformacional anómalo. El cambio da como resultado MSA (Atrofia Multisistémica) o Enfermedad de Parkinson (haga clic en Alosterio de sinucleína y agregación en la enfermedad de Parkinson para leer más detalles sobre esta investigación reciente). Gran parte de la microscopía electrónica de alta resolución que revela la estructura proteica y que puede capturar los cambios conformacionales que ahora reconocemos, proviene del trabajo de Jacques Dubochet, Joachim Frank y Richard Henderson quienes recibieron el Premio Nobel de Química 2017 por desarrollar y refinar crio-criografías microscopía electrónica para imágenes biomoleculares (ver Premio Nobel de Química 2017 para más).


