3.1: Síntesis de Macromoléculas Biológicas
- Page ID
- 59179
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para Desarrollar
- Comprender la síntesis de macromoléculas
- Explicar las reacciones de deshidratación (o condensación) e hidrólisis
Como ya has aprendido, las macromoléculas biológicas son moléculas grandes, necesarias para la vida, que se construyen a partir de moléculas orgánicas más pequeñas. Hay cuatro clases principales de macromoléculas biológicas (carbohidratos, lípidos, proteínas y ácidos nucleicos); cada una es un componente celular importante y realiza una amplia gama de funciones. Combinadas, estas moléculas constituyen la mayor parte de la masa seca de una célula (recordemos que el agua constituye la mayor parte de su masa completa). Las macromoléculas biológicas son orgánicas, es decir, contienen carbono. Además, pueden contener hidrógeno, oxígeno, nitrógeno y elementos menores adicionales.
Síntesis de deshidratación
La mayoría de las macromoléculas están hechas de subunidades individuales, o bloques de construcción, llamados monómeros. Los monómeros se combinan entre sí usando enlaces covalentes para formar moléculas más grandes conocidas como polímeros. Al hacerlo, los monómeros liberan moléculas de agua como subproductos. Este tipo de reacción se conoce como síntesis de deshidratación, lo que significa “armar mientras se pierde agua”.
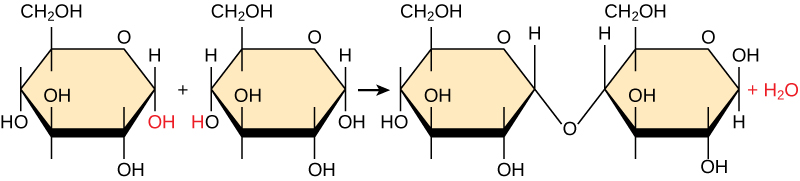
En una reacción de síntesis por deshidratación (Figura\(\PageIndex{1}\)), el hidrógeno de un monómero se combina con el grupo hidroxilo de otro monómero, liberando una molécula de agua. Al mismo tiempo, los monómeros comparten electrones y forman enlaces covalentes. A medida que se unen monómeros adicionales, esta cadena de monómeros repetitivos forma un polímero. Diferentes tipos de monómeros se pueden combinar en muchas configuraciones, dando lugar a un grupo diverso de macromoléculas. Incluso un tipo de monómero puede combinarse de diversas maneras para formar varios polímeros diferentes: por ejemplo, los monómeros de glucosa son los constituyentes del almidón, el glucógeno y la celulosa.
Hidrólisis
Los polímeros se descomponen en monómeros en un proceso conocido como hidrólisis, lo que significa “dividir el agua”, reacción en la que se usa una molécula de agua durante la descomposición (Figura\(\PageIndex{2}\)). Durante estas reacciones, el polímero se divide en dos componentes: una parte gana un átomo de hidrógeno (H+) y la otra obtiene una molécula de hidroxilo (OH—) de una molécula de agua dividida.
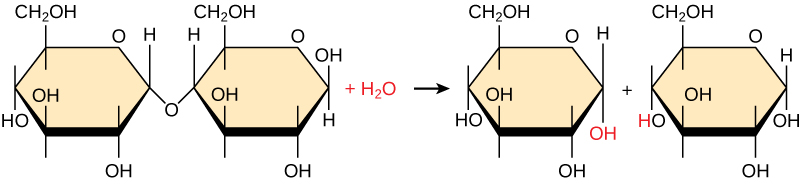
Las reacciones de deshidratación e hidrólisis son catalizadas, o “aceleradas”, por enzimas específicas; las reacciones de deshidratación implican la formación de nuevos enlaces, que requieren energía, mientras que las reacciones de hidrólisis rompen los enlaces y liberan energía. Estas reacciones son similares para la mayoría de las macromoléculas, pero cada reacción de monómero y polímero es específica para su clase. Por ejemplo, en nuestros cuerpos, los alimentos se hidrolizan, o se descomponen, en moléculas más pequeñas por enzimas catalíticas en el sistema digestivo. Esto permite una fácil absorción de nutrientes por las células en el intestino. Cada macromolécula es descompuesta por una enzima específica. Por ejemplo, los carbohidratos se descomponen por amilasa, sacarasa, lactasa o maltasa. Las proteínas son descompuestas por las enzimas pepsina y peptidasa, y por ácido clorhídrico. Los lípidos se descomponen por las lipasas. La descomposición de estas macromoléculas proporciona energía para las actividades celulares.
Enlace al aprendizaje
Visite este sitio para ver representaciones visuales de la síntesis de deshidratación e hidrólisis.
Resumen
Las proteínas, los carbohidratos, los ácidos nucleicos y los lípidos son las cuatro clases principales de macromoléculas biológicas, moléculas grandes necesarias para la vida que se construyen a partir de moléculas orgánicas más pequeñas. Las macromoléculas están compuestas por unidades simples conocidas como monómeros que se unen por enlaces covalentes para formar polímeros más grandes. El polímero es más que la suma de sus partes: adquiere nuevas características, y conduce a una presión osmótica que es muy inferior a la que forman sus ingredientes; esta es una ventaja importante en el mantenimiento de las condiciones osmóticas celulares. Un monómero se une con otro monómero con la liberación de una molécula de agua, lo que lleva a la formación de un enlace covalente. Este tipo de reacciones se conocen como reacciones de deshidratación o condensación. Cuando los polímeros se descomponen en unidades más pequeñas (monómeros), se utiliza una molécula de agua por cada enlace roto por estas reacciones; tales reacciones se conocen como reacciones de hidrólisis. Las reacciones de deshidratación e hidrólisis son similares para todas las macromoléculas, pero cada reacción de monómero y polímero es específica de su clase. Las reacciones de deshidratación generalmente requieren una inversión de energía para la formación de nuevos enlaces, mientras que las reacciones de hidrólisis generalmente liberan energía al romper los enlaces.
Glosario
- macromolécula biológica
- molécula grande necesaria para la vida que se construye a partir de moléculas orgánicas más pequeñas
- síntesis de deshidratación
- (también, condensación) reacción que une moléculas de monómero entre sí, liberando una molécula de agua por cada enlace formado
- hidrólisis
- la reacción provoca la descomposición de moléculas más grandes en moléculas más pequeñas con la utilización de agua
- monómero
- unidad más pequeña de moléculas más grandes llamadas polímeros
- polímero
- cadena de residuos de monómero que está unida por enlaces covalentes; la polimerización es el proceso de formación de polímeros a partir de monómeros por condensación


