6.5: Enzimas
- Page ID
- 59509
Habilidades para Desarrollar
- Describir el papel de las enzimas en las vías metabólicas
- Explicar cómo funcionan las enzimas como catalizadores moleculares
- Discutir la regulación enzimática por diversos factores
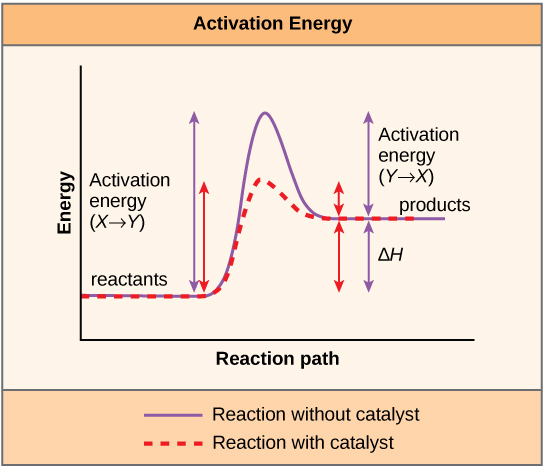
Una sustancia que ayuda a que ocurra una reacción química es un catalizador, y las moléculas especiales que catalizan las reacciones bioquímicas se llaman enzimas. Casi todas las enzimas son proteínas, compuestas por cadenas de aminoácidos, y realizan la tarea crítica de disminuir las energías de activación de las reacciones químicas dentro de la célula. Las enzimas hacen esto uniéndose a las moléculas reaccionantes, y sujetándolas de tal manera que los procesos químicos de ruptura de enlaces y formación de enlaces se lleven a cabo más fácilmente. Es importante recordar que las enzimas no cambian el ∆G de una reacción. En otras palabras, no cambian si una reacción es exergónica (espontánea) o endergónica. Esto se debe a que no cambian la energía libre de los reactivos o productos. Solo reducen la energía de activación requerida para alcanzar el estado de transición (Figura\(\PageIndex{1}\)).
Especificidad de sustrato y sitio activo enzimático
Los reactivos químicos a los que se une una enzima son los sustratos de la enzima. Puede haber uno o más sustratos, dependiendo de la reacción química particular. En algunas reacciones, un sustrato de un solo reactivo se descompone en múltiples productos. En otros, dos sustratos pueden unirse para crear una molécula más grande. Dos reactivos también pueden entrar en una reacción, ambos se modifican y dejan la reacción como dos productos. La ubicación dentro de la enzima donde se une el sustrato se llama sitio activo de la enzima. El sitio activo es donde ocurre la “acción”, por así decirlo. Dado que las enzimas son proteínas, existe una combinación única de residuos de aminoácidos (también llamados cadenas laterales, o grupos R) dentro del sitio activo. Cada residuo se caracteriza por diferentes propiedades. Los residuos pueden ser grandes o pequeños, débilmente ácidos o básicos, hidrófilos o hidrófobos, cargados positiva o negativamente, o neutros. La combinación única de residuos de aminoácidos, sus posiciones, secuencias, estructuras y propiedades, crea un ambiente químico muy específico dentro del sitio activo. Este entorno específico es adecuado para unirse, aunque brevemente, a un sustrato químico específico (o sustratos). Debido a esta coincidencia similar a rompecabezas entre una enzima y sus sustratos (que se adapta para encontrar el mejor ajuste entre el estado de transición y el sitio activo), las enzimas son conocidas por su especificidad. El “mejor ajuste” resulta de la forma y la atracción del grupo funcional aminoácido hacia el sustrato. Hay una enzima específicamente emparejada para cada sustrato y, por lo tanto, para cada reacción química; sin embargo, también hay flexibilidad.
El hecho de que los sitios activos estén tan perfectamente adaptados para proporcionar condiciones ambientales específicas también significa que están sujetos a influencias del entorno local. Es cierto que al aumentar la temperatura ambiental generalmente se incrementan las velocidades de reacción, catalizadas por enzimas o de otra manera. Sin embargo, aumentar o disminuir la temperatura fuera de un rango óptimo puede afectar a los enlaces químicos dentro del sitio activo de tal manera que son menos adecuados para unir sustratos. Las altas temperaturas eventualmente harán que las enzimas, como otras moléculas biológicas, se desnaturalicen, un proceso que cambia las propiedades naturales de una sustancia. Asimismo, el pH del ambiente local también puede afectar la función enzimática. Los residuos de aminoácidos del sitio activo tienen sus propias propiedades ácidas o básicas que son óptimas para la catálisis. Estos residuos son sensibles a cambios en el pH que pueden afectar la forma en que las moléculas de sustrato se unen. Las enzimas son adecuadas para funcionar mejor dentro de un cierto rango de pH y, al igual que con la temperatura, los valores extremos de pH (ácidos o básicos) del ambiente pueden causar que las enzimas se desnaturalicen.
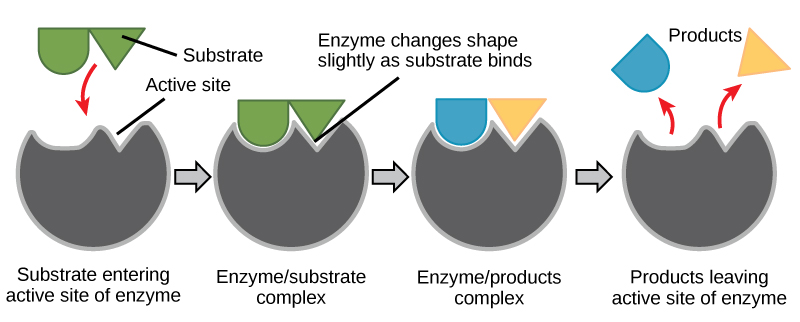
Ajuste inducido y función enzimática
Durante muchos años, los científicos pensaron que la unión enzima-sustrato se realizaba de una manera simple de “bloqueo y llave”. Este modelo aseveró que la enzima y el sustrato encajan perfectamente en un solo paso instantáneo. Sin embargo, la investigación actual apoya una visión más refinada llamada ajuste inducido (Figura\(\PageIndex{2}\)). El modelo de ajuste inducido se expande sobre el modelo de bloqueo y llave al describir una interacción más dinámica entre la enzima y el sustrato. A medida que la enzima y el sustrato se unen, su interacción provoca un leve cambio en la estructura de la enzima que confirma una disposición de unión ideal entre la enzima y el estado de transición del sustrato. Esta unión ideal maximiza la capacidad de la enzima para catalizar su reacción.
Cuando una enzima se une a su sustrato, se forma un complejo enzima-sustrato. Este complejo disminuye la energía de activación de la reacción y promueve su rápida progresión de una de muchas maneras. A nivel básico, las enzimas promueven reacciones químicas que involucran a más de un sustrato al unir los sustratos en una orientación óptima. La región apropiada (átomos y enlaces) de una molécula se yuxtapone a la región apropiada de la otra molécula con la que debe reaccionar. Otra forma en la que las enzimas promueven la reacción de sus sustratos es creando un ambiente óptimo dentro del sitio activo para que se produzca la reacción. Ciertas reacciones químicas pueden proceder mejor en un ambiente ligeramente ácido o no polar. Las propiedades químicas que emergen de la disposición particular de los residuos de aminoácidos dentro de un sitio activo crean el ambiente perfecto para que los sustratos específicos de una enzima reaccionen.
Has aprendido que la energía de activación requerida para muchas reacciones incluye la energía involucrada en manipular o ligeramente contorsionarse los enlaces químicos para que puedan romperse fácilmente y permitir que otros se reformen. La acción enzimática puede ayudar a este proceso. El complejo enzima-sustrato puede disminuir la energía de activación contorsionando las moléculas de sustrato de tal manera que se facilite la ruptura del enlace, ayudando a alcanzar el estado de transición. Finalmente, las enzimas también pueden reducir las energías de activación al participar en la reacción química misma. Los residuos de aminoácidos pueden proporcionar ciertos iones o grupos químicos que realmente forman enlaces covalentes con moléculas de sustrato como una etapa necesaria del proceso de reacción. En estos casos, es importante recordar que la enzima siempre volverá a su estado original al finalizar la reacción. Una de las propiedades distintivas de las enzimas es que finalmente permanecen inalteradas por las reacciones que catalizan. Después de que una enzima se realiza catalizando una reacción, libera su (s) producto (s).
Control del metabolismo a través de la regulación enzimática
Parecería ideal tener un escenario en el que todas las enzimas codificadas en el genoma de un organismo existieran en abundante suministro y funcionaran de manera óptima en todas las condiciones celulares, en todas las células, en todo momento. En realidad, esto está lejos de ser el caso. Una variedad de mecanismos aseguran que esto no suceda. Las necesidades y condiciones celulares varían de una célula a otra, y cambian dentro de las células individuales a lo largo del tiempo. Las enzimas requeridas y las demandas energéticas de las células estomacales son diferentes a las de las células de almacenamiento de grasa, células de la piel, células sanguíneas y células nerviosas. Además, una célula digestiva trabaja mucho más duro para procesar y descomponer los nutrientes durante el tiempo que sigue de cerca una comida en comparación con muchas horas después de una comida. Como estas demandas y condiciones celulares varían, también lo hacen las cantidades y funcionalidad de diferentes enzimas.
Dado que las tasas de reacciones bioquímicas están controladas por la energía de activación, y las enzimas disminuyen y determinan las energías de activación para las reacciones químicas, las cantidades relativas y el funcionamiento de la variedad de enzimas dentro de una célula finalmente determinan qué reacciones procederán y a qué velocidades. Esta determinación está estrechamente controlada. En ciertos ambientes celulares, la actividad enzimática está parcialmente controlada por factores ambientales, como el pH y la temperatura. Existen otros mecanismos a través de los cuales las células controlan la actividad de las enzimas y determinan las velocidades a las que se producirán diversas reacciones bioquímicas.
Regulación de enzimas por moléculas
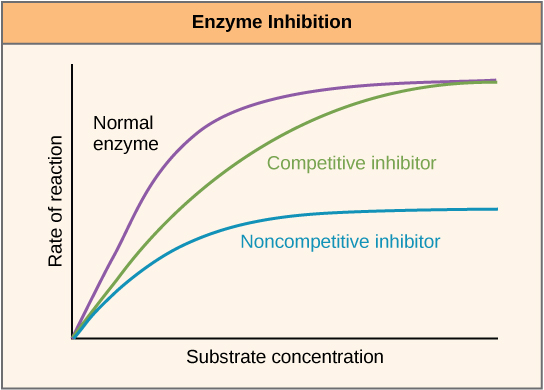
Las enzimas pueden regularse de manera que promuevan o reduzcan su actividad. Existen muchos tipos diferentes de moléculas que inhiben o promueven la función enzimática, y existen diversos mecanismos para hacerlo. En algunos casos de inhibición enzimática, por ejemplo, una molécula inhibidora es lo suficientemente similar a un sustrato como para que pueda unirse al sitio activo y simplemente bloquear la unión del sustrato. Cuando esto sucede, la enzima se inhibe a través de la inhibición competitiva, debido a que una molécula inhibidora compite con el sustrato por la unión al sitio activo (Figura\(\PageIndex{3}\)). Por otro lado, en la inhibición no competitiva, una molécula inhibidora se une a la enzima en una ubicación distinta a un sitio alostérico y aún logra bloquear la unión del sustrato al sitio activo.
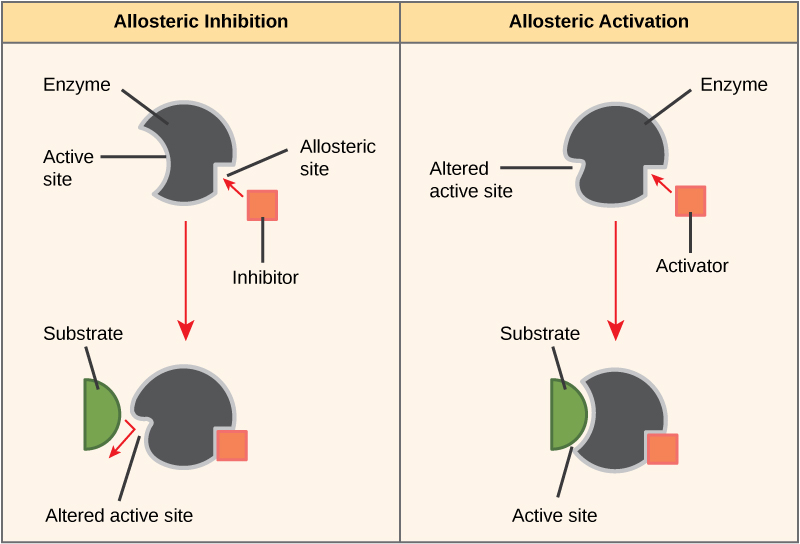
Algunas moléculas inhibidoras se unen a enzimas en un lugar donde su unión induce un cambio conformacional que reduce la afinidad de la enzima por su sustrato. Este tipo de inhibición se denomina inhibición alostérica (Figura\(\PageIndex{4}\)). La mayoría de las enzimas reguladas alostéricamente están compuestas por más de un polipéptido, lo que significa que tienen más de una subunidad proteica. Cuando un inhibidor alostérico se une a una enzima, todos los sitios activos en las subunidades de proteína cambian ligeramente de tal manera que se unen a sus sustratos con menos eficiencia. Existen activadores alostéricos así como inhibidores. Los activadores alostéricos se unen a ubicaciones en una enzima lejos del sitio activo, induciendo un cambio conformacional que aumenta la afinidad del sitio o sitios activos de la enzima por su sustrato o sustratos.
Conexión cotidiana: Descubrimiento de fármacos mediante la búsqueda de inhibidores de enzimas clave en vías específicas

Las enzimas son componentes clave de las vías metabólicas. Comprender cómo funcionan las enzimas y cómo pueden regularse es un principio clave detrás del desarrollo de muchos de los medicamentos farmacéuticos (Figura\(\PageIndex{5}\)) en el mercado actual. Los biólogos que trabajan en este campo colaboran con otros científicos, generalmente químicos, para diseñar medicamentos.
Considere las estatinas por ejemplo, que es el nombre que se le da a la clase de medicamentos que reducen los niveles de colesterol. Estos compuestos son esencialmente inhibidores de la enzima HMG-CoA reductasa. La HMG-CoA reductasa es la enzima que sintetiza el colesterol a partir de lípidos en el cuerpo. Al inhibir esta enzima, se pueden reducir los niveles de colesterol sintetizado en el organismo. De igual manera, el acetaminofén, comercializado popularmente bajo la marca Tylenol, es un inhibidor de la enzima ciclooxigenasa. Si bien es eficaz para proporcionar alivio de la fiebre y la inflamación (dolor), su mecanismo de acción aún no se entiende completamente.
¿Cómo se desarrollan los medicamentos? Uno de los primeros desafíos en el desarrollo de fármacos es identificar la molécula específica a la que se pretende dirigir el fármaco. En el caso de las estatinas, la HMG-CoA reductasa es el fármaco diana. Las dianas farmacológicas se identifican a través de una minuciosa investigación en el laboratorio. Identificar el objetivo por sí solo no es suficiente; los científicos también necesitan saber cómo actúa el objetivo dentro de la célula y qué reacciones salen mal en el caso de la enfermedad. Una vez que se identifica el objetivo y la vía, entonces comienza el proceso real de diseño de fármacos. Durante esta etapa, químicos y biólogos trabajan juntos para diseñar y sintetizar moléculas que pueden bloquear o activar una reacción en particular. Sin embargo, esto es solo el comienzo: tanto si como cuando un prototipo de medicamento tiene éxito en el desempeño de su función, entonces debe someterse a muchas pruebas, desde experimentos in vitro hasta ensayos clínicos antes de que pueda obtener la aprobación de la FDA para estar en el mercado.
Muchas enzimas no funcionan de manera óptima, o incluso en absoluto, a menos que se unan a otras moléculas colaboradoras específicas no proteicas, ya sea temporalmente a través de enlaces iónicos o de hidrógeno o permanentemente a través de enlaces covalentes más fuertes. Dos tipos de moléculas colaboradoras son cofactores y coenzimas. La unión a estas moléculas promueve una conformación y función óptimas para sus respectivas enzimas. Los cofactores son iones inorgánicos como el hierro (Fe++) y el magnesio (Mg++). Un ejemplo de una enzima que requiere un ión metálico como cofactor es la enzima que construye moléculas de ADN, la ADN polimerasa, que requiere el ion zinc unido (Zn++) para funcionar. Las coenzimas son moléculas colaboradoras orgánicas, con una estructura atómica básica compuesta por carbono e hidrógeno, que son necesarias para la acción enzimática. Las fuentes más comunes de coenzimas son las vitaminas dietéticas (Figura\(\PageIndex{6}\)). Algunas vitaminas son precursoras de las coenzimas y otras actúan directamente como coenzimas. La vitamina C es una coenzima para múltiples enzimas que participan en la construcción del importante componente del tejido conectivo, el colágeno. Un paso importante en la descomposición de la glucosa para producir energía es la catálisis por un complejo multienzimático llamado piruvato deshidrogenasa. La piruvato deshidrogenasa es un complejo de varias enzimas que en realidad requiere un cofactor (un ion magnesio) y cinco coenzimas orgánicas diferentes para catalizar su reacción química específica. Por lo tanto, la función enzimática está, en parte, regulada por una abundancia de diversos cofactores y coenzimas, las cuales son suministradas principalmente por las dietas de la mayoría de los organismos.
Compartimentación enzimática
En las células eucariotas, las moléculas como las enzimas suelen compartimentarse en diferentes orgánulos. Esto permite otro nivel más de regulación de la actividad enzimática. Las enzimas requeridas solo para ciertos procesos celulares pueden alojarse por separado junto con sus sustratos, lo que permite reacciones químicas más eficientes. Ejemplos de este tipo de regulación enzimática basada en la ubicación y proximidad incluyen las enzimas involucradas en las últimas etapas de la respiración celular, que tienen lugar exclusivamente en las mitocondrias, y las enzimas involucradas en la digestión de desechos celulares y materiales extraños, localizados dentro de los lisosomas.
Inhibición de retroalimentación en vías metabólicas
Las moléculas pueden regular la función enzimática de muchas maneras. Sin embargo, queda una pregunta importante: ¿Qué son estas moléculas y de dónde provienen? Algunos son cofactores y coenzimas, iones y moléculas orgánicas, como ya has aprendido. ¿Qué otras moléculas en la célula proporcionan regulación enzimática, como la modulación alostérica, y la inhibición competitiva y no competitiva? La respuesta es que una amplia variedad de moléculas pueden desempeñar estos roles. Algunas de estas moléculas incluyen medicamentos farmacéuticos y no farmacéuticos, toxinas y venenos del medio ambiente. Quizás las fuentes más relevantes de moléculas reguladoras enzimáticas, con respecto al metabolismo celular, son los productos de las propias reacciones metabólicas celulares. De una manera más eficiente y elegante, las células han evolucionado para utilizar los productos de sus propias reacciones para la inhibición por retroalimentación de la actividad enzimática. La inhibición de retroalimentación implica el uso de un producto de reacción para regular su propia producción adicional (Figura\(\PageIndex{7}\)). La célula responde a la abundancia de productos específicos al ralentizar la producción durante las reacciones anabólicas o catabólicas. Dichos productos de reacción pueden inhibir las enzimas que catalizaron su producción a través de los mecanismos descritos anteriormente.
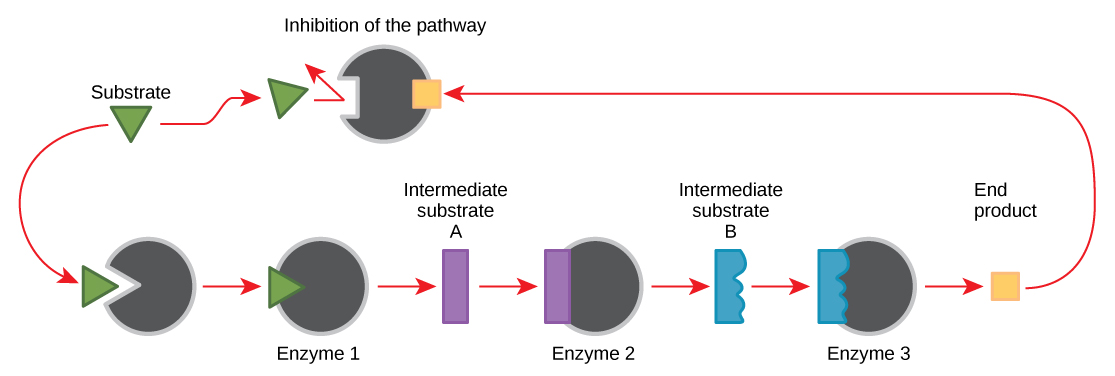
La producción de aminoácidos y nucleótidos se controla a través de la inhibición por retroalimentación. Adicionalmente, el ATP es un regulador alostérico de algunas de las enzimas involucradas en la descomposición catabólica del azúcar, el proceso que produce ATP. De esta manera, cuando el ATP es abundante, la célula puede impedir su posterior producción. Recuerde que el ATP es una molécula inestable que puede disociarse espontáneamente en ADP. Si demasiado ATP estuviera presente en una celda, gran parte de él se desperdiciaría. Por otro lado, el ADP sirve como regulador alostérico positivo (un activador alostérico) para algunas de las mismas enzimas que son inhibidas por el ATP. Así, cuando los niveles relativos de ADP son altos en comparación con ATP, la célula se activa para producir más ATP a través del catabolismo del azúcar.
Resumen
Las enzimas son catalizadores químicos que aceleran las reacciones químicas a temperaturas fisiológicas al disminuir su energía de activación. Las enzimas suelen ser proteínas que consisten en una o más cadenas polipeptídicas. Las enzimas tienen un sitio activo que proporciona un entorno químico único, compuesto por ciertos grupos de aminoácidos R (residuos). Este entorno único es perfectamente adecuado para convertir reactivos químicos particulares para esa enzima, llamados sustratos, en intermedios inestables llamados estados de transición. Se cree que las enzimas y los sustratos se unen con un ajuste inducido, lo que significa que las enzimas experimentan ligeros ajustes conformacionales al entrar en contacto con el sustrato, lo que conduce a una unión completa y óptima. Las enzimas se unen a los sustratos y catalizan las reacciones de cuatro maneras diferentes: juntando sustratos en una orientación óptima, comprometiendo las estructuras de unión de los sustratos para que los enlaces puedan romperse más fácilmente, proporcionar condiciones ambientales óptimas para que ocurra una reacción, o participar directamente en su reacción química mediante la formación de enlaces covalentes transitorios con los sustratos.
La acción enzimática debe ser regulada para que en una célula dada en un momento dado, las reacciones deseadas estén siendo catalizadas y las reacciones no deseadas no lo sean. Las enzimas están reguladas por condiciones celulares, como la temperatura y el pH. También se regulan a través de su ubicación dentro de una célula, a veces se compartimentan para que solo puedan catalizar reacciones bajo ciertas circunstancias. La inhibición y activación de enzimas a través de otras moléculas son otras formas importantes de regular las enzimas. Los inhibidores pueden actuar de manera competitiva, no competitiva o alostérica; los inhibidores no competitivos suelen ser alostéricos. Los activadores también pueden potenciar la función de las enzimas alostéricamente. El método más común por el cual las células regulan las enzimas en las vías metabólicas es a través de la inhibición por retroalimentación. Durante la inhibición por retroalimentación, los productos de una vía metabólica sirven como inhibidores (generalmente alostéricos) de una o más de las enzimas (generalmente la primera enzima comprometida de la ruta) involucradas en la vía que las produce.
Glosario
- sitio activo
- región específica de la enzima a la que se une el sustrato
- inhibición alostérica
- inhibición por un evento de unión en un sitio diferente del sitio activo, que induce un cambio conformacional y reduce la afinidad de la enzima por su sustrato
- coenzima
- molécula orgánica pequeña, como una vitamina o su derivado, que se requiere para potenciar la actividad de una enzima
- cofactor
- iones inorgánicos, tales como iones hierro y magnesio, necesarios para una regulación óptima de la actividad enzimática
- inhibición competitiva
- tipo de inhibición en la que el inhibidor compite con la molécula sustrato al unirse al sitio activo de la enzima
- desnaturalizar
- proceso que cambia las propiedades naturales de una sustancia
- inhibición de retroalimentación
- efecto de un producto de una secuencia de reacción para disminuir su posterior producción inhibiendo la actividad de la primera enzima en la vía que la produce
- ajuste inducido
- ajuste dinámico entre la enzima y su sustrato, en el que ambos componentes modifican sus estructuras para permitir una unión ideal
- sustrato
- molécula sobre la que actúa la enzima


