4.1: Energía y Metabolismo
- Page ID
- 54325
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los científicos utilizan el término bioenergética para describir el concepto de flujo de energía (Figura\(\PageIndex{1}\)) a través de sistemas vivos, como las células. Los procesos celulares como la construcción y descomposición de moléculas complejas ocurren a través de reacciones químicas escalonadas. Algunas de estas reacciones químicas son espontáneas y liberan energía, mientras que otras requieren energía para proceder. Así como los seres vivos deben consumir continuamente alimentos para reponer sus suministros de energía, las células deben producir continuamente más energía para reponer la utilizada por las muchas reacciones químicas que requieren energía que ocurren constantemente. En conjunto, todas las reacciones químicas que tienen lugar dentro de las células, incluidas las que consumen o generan energía, se denominan el metabolismo de la célula.
Vías Metabólicas
Considera el metabolismo del azúcar. Este es un ejemplo clásico de uno de los muchos procesos celulares que utilizan y producen energía. Los seres vivos consumen azúcares como fuente de energía importante, porque las moléculas de azúcar tienen una gran cantidad de energía almacenada dentro de sus enlaces. En su mayor parte, los organismos fotosintetizadores como las plantas producen estos azúcares. Durante la fotosíntesis, las plantas utilizan energía (originaria de la luz solar) para convertir el gas dióxido de carbono (CO 2) en moléculas de azúcar (como la glucosa: C 6 H 12 O 6). Consumen dióxido de carbono y producen oxígeno como producto de desecho. Esta reacción se resume como:
\[\ce{6CO2 + 6H2O -> C6H12O6 + 6O2}\nonumber\]
Debido a que este proceso implica sintetizar una molécula que almacena energía, requiere un aporte de energía para continuar. Durante las reacciones lumínicas de la fotosíntesis, la energía es proporcionada por una molécula llamada trifosfato de adenosina (ATP), que es la moneda de energía primaria de todas las células. Así como el dólar se usa como moneda para comprar bienes, las células utilizan moléculas de ATP como moneda de energía para realizar un trabajo inmediato. En contraste, las moléculas de almacenamiento de energía como la glucosa se consumen solo para ser descompuestas para usar su energía. La reacción que recoge la energía de una molécula de azúcar en células que requieren oxígeno para sobrevivir puede resumirse por la reacción inversa a la fotosíntesis. En esta reacción, se consume oxígeno y se libera dióxido de carbono como producto de desecho. La reacción se resume como:
\[\ce{C6H12O6 + 6O2 -> 6H2O + 6CO2}\nonumber\]
Ambas reacciones implican muchos pasos.
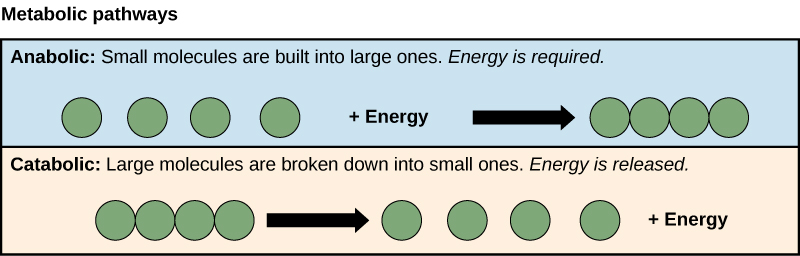
Los procesos de elaboración y descomposición de las moléculas de azúcar ilustran dos ejemplos de vías metabólicas. Una vía metabólica es una serie de reacciones químicas que toman una molécula de partida y la modifican, paso a paso, a través de una serie de intermedios metabólicos, dando finalmente un producto final. En el ejemplo del metabolismo del azúcar, la primera vía metabólica sintetizó azúcar a partir de moléculas más pequeñas, y la otra vía dividió el azúcar en moléculas más pequeñas. Estos dos procesos opuestos, el primero que requiere energía y el segundo que produce energía, se conocen como vías anabólicas (polímeros de construcción) y vías catabólicas (descomponiendo los polímeros en sus monómeros), respectivamente. En consecuencia, el metabolismo está compuesto por síntesis (anabolismo) y degradación (catabolismo) (Figura\(\PageIndex{2}\)).
Es importante saber que las reacciones químicas de las vías metabólicas no tienen lugar por sí mismas. Cada etapa de reacción es facilitada, o catalizada, por una proteína llamada enzima. Las enzimas son importantes para catalizar todo tipo de reacciones biológicas, las que requieren energía y las que liberan energía.
Energía
La termodinámica se refiere al estudio de la energía y la transferencia de energía que involucra la materia física. El asunto relevante para un caso particular de transferencia de energía se llama sistema, y todo lo que está fuera de esa materia se llama el entorno. Por ejemplo, al calentar una olla con agua en la estufa, el sistema incluye la estufa, la olla y el agua. La energía se transfiere dentro del sistema (entre la estufa, la olla y el agua). Existen dos tipos de sistemas: abierto y cerrado. En un sistema abierto, la energía se puede intercambiar con su entorno. El sistema de estufa está abierto porque el calor se puede perder en el aire. Un sistema cerrado no puede intercambiar energía con su entorno.
Los organismos biológicos son sistemas abiertos. La energía se intercambia entre ellos y su entorno ya que utilizan la energía del sol para realizar la fotosíntesis o consumen moléculas de almacenamiento de energía y liberan energía al ambiente haciendo trabajo y liberando calor. Como todas las cosas en el mundo físico, la energía está sujeta a las leyes físicas. Las leyes de la termodinámica rigen la transferencia de energía en y entre todos los sistemas del universo.
En general, la energía se define como la capacidad de hacer trabajo, o de crear algún tipo de cambio. La energía existe en diferentes formas. Por ejemplo, la energía eléctrica, la energía luminosa y la energía térmica son todos diferentes tipos de energía. Para apreciar la forma en que la energía fluye dentro y fuera de los sistemas biológicos, es importante comprender dos de las leyes físicas que rigen la energía.
Termodinámica
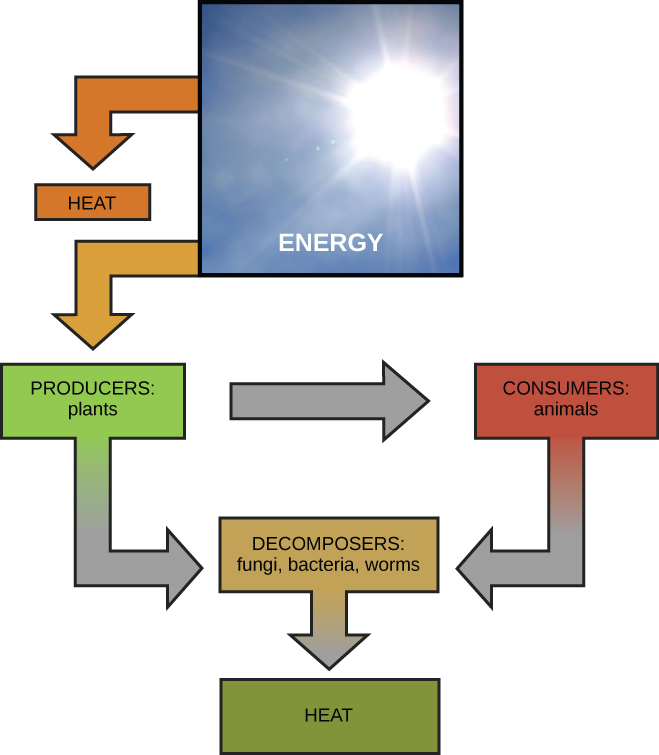
La primera ley de la termodinámica establece que la cantidad total de energía en el universo es constante y conservada. Es decir, siempre ha habido, y siempre habrá, exactamente la misma cantidad de energía en el universo. La energía existe en muchas formas diferentes. Según la primera ley de la termodinámica, la energía puede transferirse de un lugar a otro o transformarse en diferentes formas, pero no puede crearse ni destruirse. Las transferencias y transformaciones de la energía ocurren a nuestro alrededor todo el tiempo. Las bombillas transforman la energía eléctrica en energía lumínica y térmica. Las estufas de gas transforman la energía química del gas natural en energía térmica. Las plantas realizan una de las transformaciones energéticas más útiles biológicamente en la tierra: la de convertir la energía de la luz solar en energía química almacenada dentro de moléculas orgánicas (Figura\(\PageIndex{1}\)). Algunos ejemplos de transformaciones energéticas se muestran en la Figura\(\PageIndex{3}\).
El reto para todos los organismos vivos es obtener energía de su entorno en formas que puedan transferir o transformar en energía utilizable para hacer el trabajo. Las células vivas han evolucionado para hacer frente a este reto. La energía química almacenada dentro de moléculas orgánicas como azúcares y grasas se transfiere y transforma a través de una serie de reacciones químicas celulares en energía dentro de moléculas de ATP. La energía en las moléculas de ATP es fácilmente accesible para hacer el trabajo. Ejemplos de los tipos de trabajo que las células necesitan hacer incluyen construir moléculas complejas, transportar materiales, impulsar el movimiento de cilios o flagelos y contraer fibras musculares para crear movimiento.

Las tareas primarias de una célula viva de obtener, transformar y usar energía para hacer el trabajo pueden parecer simples. No obstante, la segunda ley de la termodinámica explica por qué estas tareas son más difíciles de lo que parecen. Todas las transferencias y transformaciones de energía nunca son completamente eficientes. En cada transferencia de energía, se pierde cierta cantidad de energía en una forma que es inutilizable. En la mayoría de los casos, esta forma es energía térmica. Termodinámicamente, la energía térmica se define como la energía transferida de un sistema a otro que no es trabajo. Por ejemplo, cuando se enciende una bombilla, parte de la energía que se convierte de energía eléctrica en energía lumínica se pierde como energía térmica. Asimismo, se pierde algo de energía como energía térmica durante las reacciones metabólicas celulares.
Un concepto importante en los sistemas físicos es el de orden y desorden. Cuanta más energía pierde un sistema a su entorno, menos ordenado y más aleatorio es el sistema. Los científicos se refieren a la medida de aleatoriedad o trastorno dentro de un sistema como entropía. Alta entropía significa trastorno alto y baja energía. Las moléculas y las reacciones químicas también tienen entropía variable. Por ejemplo, la entropía aumenta a medida que las moléculas a alta concentración en un lugar se difunden y se extienden. La segunda ley de la termodinámica dice que la energía siempre se perderá como calor en las transferencias o transformaciones de energía.
Los seres vivos están altamente ordenados, requiriendo un aporte de energía constante para mantenerse en un estado de baja entropía.
Energía potencial y cinética
Cuando un objeto está en movimiento, hay energía asociada a ese objeto. Piensa en una bola de naufragio. Incluso una bola de naufragio de movimiento lento puede hacer mucho daño a otros objetos. La energía asociada con los objetos en movimiento se llama energía cinética (Figura\(\PageIndex{4}\)). Una bala a exceso de velocidad, una persona que camina y el rápido movimiento de las moléculas en el aire (que produce calor) tienen energía cinética.
Ahora, ¿y si esa misma bola de naufragio inmóvil se levanta dos pisos sobre el suelo con una grúa? Si la bola de naufragio suspendida es inmóvil, ¿hay energía asociada a ella? La respuesta es sí. La energía que se requería para levantar la bola de naufragio no desapareció, sino que ahora se almacena en la bola de naufragio en virtud de su posición y la fuerza de gravedad que actúa sobre ella. Este tipo de energía se llama energía potencial (Figura\(\PageIndex{4}\)). Si la pelota cayera, la energía potencial se transformaría en energía cinética hasta que se agotara toda la energía potencial cuando la pelota descansara en el suelo. Las bolas de naufragio también se balancean como un péndulo; a través del columpio, hay un cambio constante de energía potencial (más alta en la parte superior del columpio) a energía cinética (más alta en la parte inferior del columpio). Otros ejemplos de energía potencial incluyen la energía del agua contenida detrás de una presa o una persona a punto de saltar en paracaidismo fuera de un avión.

La energía potencial no sólo está asociada con la ubicación de la materia, sino también con la estructura de la materia. Incluso un resorte en el suelo tiene energía potencial si se comprime; también lo hace una banda de goma que se tira tensa. A nivel molecular, los enlaces que mantienen unidos los átomos de las moléculas existen en una estructura particular que tiene energía potencial. Recuerde que las vías celulares anabólicas requieren energía para sintetizar moléculas complejas a partir de otras más simples y las vías catabólicas liberan energía cuando las moléculas complejas se descomponen. El hecho de que la energía pueda ser liberada por la ruptura de ciertos enlaces químicos implica que esos enlaces tienen energía potencial. De hecho, hay energía potencial almacenada dentro de los enlaces de todas las moléculas de alimentos que comemos, que finalmente se aprovecha para su uso. Esto se debe a que estos enlaces pueden liberar energía cuando se rompen. El tipo de energía potencial que existe dentro de los enlaces químicos, y se libera cuando esos enlaces se rompen, se llama energía química. La energía química es responsable de proporcionar a las células vivas energía de los alimentos. La liberación de energía ocurre cuando se rompen los enlaces moleculares dentro de las moléculas de los alimentos.
CONCEPT EN ACCIÓN
Visite el sitio y seleccione “Péndulo” del menú “Trabajo y Energía” para ver la energía cinética y potencial cambiante de un péndulo en movimiento.
Energía Libre y de Activación
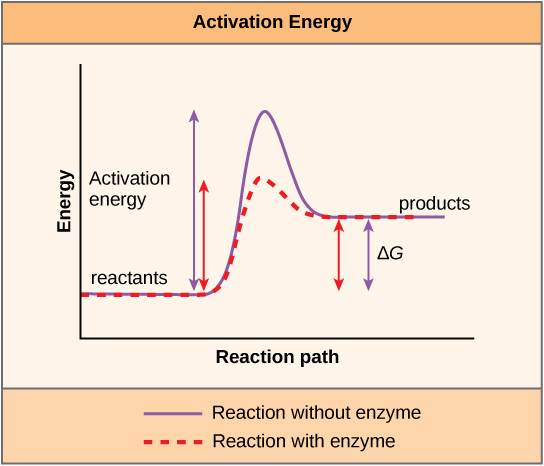
Después de enterarse de que las reacciones químicas liberan energía cuando se rompen los enlaces de almacenamiento de energía, una siguiente pregunta importante es la siguiente: ¿Cómo se cuantifica y expresa la energía asociada a estas reacciones químicas? ¿Cómo se puede comparar la energía liberada de una reacción con la de otra reacción? Se utiliza una medición de la energía libre para cuantificar estas transferencias de energía. Recordemos que según la segunda ley de la termodinámica, todas las transferencias de energía implican la pérdida de alguna cantidad de energía en una forma inutilizable como el calor. La energía libre se refiere específicamente a la energía asociada a una reacción química que está disponible después de contabilizar las pérdidas. En otras palabras, la energía libre es energía utilizable, o energía que está disponible para hacer el trabajo.
Si se libera energía durante una reacción química, entonces el cambio en la energía libre, significada como ∆G (delta G) será un número negativo. Un cambio negativo en la energía libre también significa que los productos de la reacción tienen menos energía libre que los reactivos, porque liberan algo de energía libre durante la reacción. Las reacciones que tienen un cambio negativo en la energía libre y en consecuencia liberan energía libre se denominan reacciones exergónicas. Piensa: ex ergónico significa que la energía está exitando el sistema. Estas reacciones también se denominan reacciones espontáneas, y sus productos tienen menos energía almacenada que los reactivos. Se debe hacer una distinción importante entre el término espontáneo y la idea de una reacción química que se produce inmediatamente. Contrario al uso cotidiano del término, una reacción espontánea no es aquella que ocurre súbita o rápidamente. La oxidación del hierro es un ejemplo de una reacción espontánea que se produce lentamente, poco a poco, a lo largo del tiempo.
Si una reacción química absorbe energía en lugar de liberar energía en balance, entonces el ∆G para esa reacción será un valor positivo. En este caso, los productos tienen más energía libre que los reactivos. Así, los productos de estas reacciones pueden considerarse como moléculas que almacenan energía. Estas reacciones químicas se denominan reacciones endergónicas y no son espontáneas. Una reacción endergónica no tendrá lugar por sí sola sin la adición de energía libre.
CONEXIÓN ART

Mira cada uno de los procesos mostrados y decide si es endergónico o exergónico.
Existe otro concepto importante que debe considerarse respecto a las reacciones endergónicas y exergónicas. Las reacciones exergónicas requieren una pequeña cantidad de entrada de energía para ponerse en marcha, antes de que puedan continuar con sus pasos de liberación de energía. Estas reacciones tienen una liberación neta de energía, pero aún así requieren algún aporte de energía al principio. Esta pequeña cantidad de entrada de energía necesaria para que ocurran todas las reacciones químicas se llama energía de activación.
CONCEPT EN ACCIÓN
Vea una animación del paso de la energía libre al estado de transición de la reacción.
Enzimas
Una sustancia que ayuda a que ocurra una reacción química se llama catalizador, y las moléculas que catalizan las reacciones bioquímicas se llaman enzimas. La mayoría de las enzimas son proteínas y realizan la tarea crítica de disminuir las energías de activación de las reacciones químicas dentro de la célula. La mayoría de las reacciones críticas para una célula viva ocurren demasiado lentamente a temperaturas normales para ser de alguna utilidad para la célula. Sin enzimas para acelerar estas reacciones, la vida no podría persistir. Las enzimas hacen esto uniéndose a las moléculas reaccionantes y manteniéndolas de tal manera que los procesos químicos de ruptura y formación de enlaces se lleven a cabo más fácilmente. Es importante recordar que las enzimas no cambian si una reacción es exergónica (espontánea) o endergónica. Esto se debe a que no cambian la energía libre de los reactivos o productos. Solo reducen la energía de activación requerida para que la reacción avance (Figura\(\PageIndex{6}\)). Además, una enzima en sí misma permanece inalterada por la reacción que cataliza. Una vez catalizada una reacción, la enzima es capaz de participar en otras reacciones.
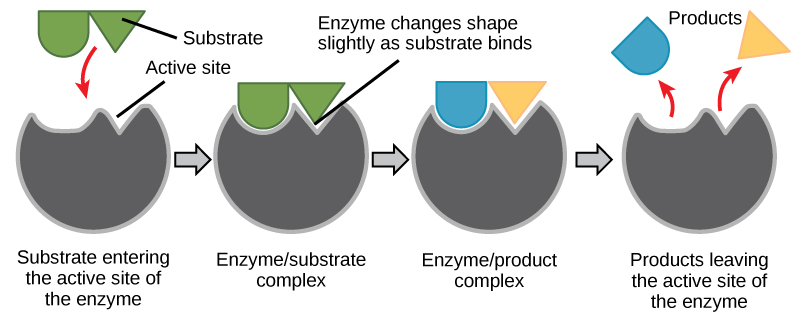
Los reactivos químicos a los que se une una enzima se denominan sustratos de la enzima. Puede haber uno o más sustratos, dependiendo de la reacción química particular. En algunas reacciones, un solo sustrato reactivo se descompone en múltiples productos. En otros, dos sustratos pueden unirse para crear una molécula más grande. Dos reactivos también pueden entrar en una reacción y ambos se modifican, pero dejan la reacción como dos productos. La ubicación dentro de la enzima donde se une el sustrato se llama sitio activo de la enzima. El sitio activo es donde ocurre la “acción”. Dado que las enzimas son proteínas, existe una combinación única de cadenas laterales de aminoácidos dentro del sitio activo. Cada cadena lateral se caracteriza por diferentes propiedades. Pueden ser grandes o pequeños, débilmente ácidos o básicos, hidrófilos o hidrófobos, cargados positiva o negativamente, o neutros. La combinación única de cadenas laterales crea un ambiente químico muy específico dentro del sitio activo. Este entorno específico es adecuado para unirse a un sustrato químico específico (o sustratos).
Los sitios activos están sujetos a influencias del entorno local. El aumento de la temperatura ambiental generalmente aumenta las velocidades de reacción, catalizadas por enzimas o de otra manera. Sin embargo, las temperaturas fuera de un rango óptimo reducen la velocidad a la que una enzima cataliza una reacción. Las temperaturas calientes eventualmente harán que las enzimas se desnaturalicen, un cambio irreversible en la forma tridimensional y por lo tanto en la función de la enzima. Las enzimas también son adecuadas para funcionar mejor dentro de un cierto rango de pH y concentración de sal, y, al igual que con la temperatura, el pH extremo y las concentraciones de sal pueden causar que las enzimas se desnaturalicen.
Durante muchos años, los científicos pensaron que la unión enzima-sustrato se realizaba de una manera simple de “cerradura y llave”. Este modelo aseveró que la enzima y el sustrato encajan perfectamente en un solo paso instantáneo. Sin embargo, la investigación actual apoya un modelo llamado ajuste inducido (Figura\(\PageIndex{7}\)). El modelo de ajuste inducido amplía el modelo de bloqueo y llave al describir una unión más dinámica entre la enzima y el sustrato. A medida que la enzima y el sustrato se unen, su interacción provoca un leve cambio en la estructura de la enzima que forma un arreglo de unión ideal entre la enzima y el sustrato.
CONCEPT EN ACCIÓN
Visualizar una animación de ajuste inducido.
Cuando una enzima se une a su sustrato, se forma un complejo enzima-sustrato. Este complejo disminuye la energía de activación de la reacción y promueve su rápida progresión en una de las múltiples formas posibles. A nivel básico, las enzimas promueven reacciones químicas que involucran a más de un sustrato al unir los sustratos en una orientación óptima para la reacción. Otra forma en la que las enzimas promueven la reacción de sus sustratos es creando un ambiente óptimo dentro del sitio activo para que se produzca la reacción. Las propiedades químicas que emergen de la disposición particular de los grupos de aminoácidos R dentro de un sitio activo crean el ambiente perfecto para que los sustratos específicos de una enzima reaccionen.
El complejo enzima-sustrato también puede reducir la energía de activación comprometiendo la estructura de enlace para que sea más fácil de romper. Finalmente, las enzimas también pueden reducir las energías de activación al participar en la reacción química misma. En estos casos, es importante recordar que la enzima siempre volverá a su estado original al finalizar la reacción. Una de las propiedades distintivas de las enzimas es que finalmente permanecen inalteradas por las reacciones que catalizan. Después de que una enzima ha catalizado una reacción, libera su (s) producto (s) y puede catalizar una nueva reacción.
Parecería ideal tener un escenario en el que todas las enzimas de un organismo existieran en abundante suministro y funcionaran de manera óptima en todas las condiciones celulares, en todas las células, en todo momento. Sin embargo, una variedad de mecanismos asegura que esto no suceda. Las necesidades y condiciones celulares varían constantemente de una célula a otra, y cambian dentro de las células individuales con el tiempo. Las enzimas requeridas de las células estomacales difieren de las células de almacenamiento de grasa, células de la piel, células sanguíneas y células nerviosas. Además, una célula de un órgano digestivo trabaja mucho más duro para procesar y descomponer los nutrientes durante el tiempo que sigue de cerca a una comida en comparación con muchas horas después de una comida. Como estas demandas y condiciones celulares varían, también deben ser las cantidades y funcionalidad de las diferentes enzimas.
Dado que las tasas de reacciones bioquímicas están controladas por la energía de activación, y las enzimas disminuyen y determinan las energías de activación para las reacciones químicas, las cantidades relativas y el funcionamiento de la variedad de enzimas dentro de una célula determinan en última instancia qué reacciones procederán y a qué velocidades. Esta determinación está estrechamente controlada en las células. En ciertos ambientes celulares, la actividad enzimática está parcialmente controlada por factores ambientales como el pH, la temperatura, la concentración de sal y, en algunos casos, los cofactores o coenzimas.
Las enzimas también pueden regularse de manera que promuevan o reduzcan la actividad enzimática. Existen muchos tipos de moléculas que inhiben o promueven la función enzimática, y diversos mecanismos por los cuales lo hacen. En algunos casos de inhibición enzimática, una molécula inhibidora es lo suficientemente similar a un sustrato como para que pueda unirse al sitio activo y simplemente bloquear la unión del sustrato. Cuando esto sucede, la enzima se inhibe a través de la inhibición competitiva, debido a que una molécula inhibidora compite con el sustrato por unirse al sitio activo.
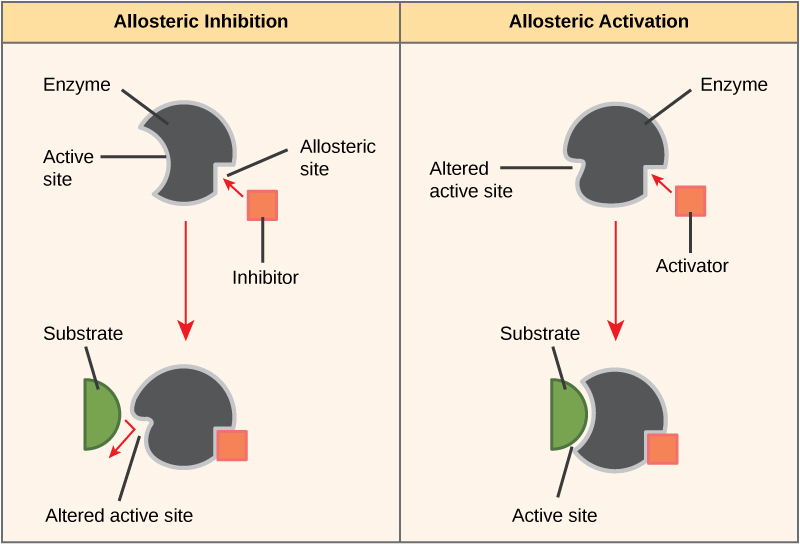
Por otro lado, en la inhibición no competitiva, una molécula inhibidora se une a la enzima en una ubicación distinta al sitio activo, denominado sitio alostérico, pero aún así logra bloquear la unión del sustrato al sitio activo. Algunas moléculas inhibidoras se unen a enzimas en un lugar donde su unión induce un cambio conformacional que reduce la afinidad de la enzima por su sustrato. Este tipo de inhibición se denomina inhibición alostérica (Figura\(\PageIndex{8}\)). La mayoría de las enzimas reguladas alostéricamente están compuestas por más de un polipéptido, lo que significa que tienen más de una subunidad proteica. Cuando un inhibidor alostérico se une a una región en una enzima, todos los sitios activos en las subunidades de proteína se cambian ligeramente de tal manera que se unen a sus sustratos con menos eficiencia. Existen activadores alostéricos así como inhibidores. Los activadores alostéricos se unen a ubicaciones en una enzima lejos del sitio activo, induciendo un cambio conformacional que aumenta la afinidad del sitio o sitios activos de la enzima por su sustrato (s) (Figura\(\PageIndex{8}\)).
CARRERAS EN ACCIÓN: Desarrollador de fármacos

Las enzimas son componentes clave de las vías metabólicas. Comprender cómo funcionan las enzimas y cómo pueden regularse son principios clave detrás del desarrollo de muchos de los medicamentos farmacéuticos en el mercado actual. Los biólogos que trabajan en este campo colaboran con otros científicos para diseñar fármacos (Figura\(\PageIndex{9}\)).
Considere las estatinas por ejemplo: las estatinas es el nombre que se le da a una clase de medicamentos que pueden reducir los niveles de colesterol. Estos compuestos son inhibidores de la enzima HMG-CoA reductasa, que es la enzima que sintetiza el colesterol a partir de lípidos en el organismo. Al inhibir esta enzima, se puede reducir el nivel de colesterol sintetizado en el cuerpo. De igual manera, el acetaminofén, comercializado popularmente bajo la marca Tylenol, es un inhibidor de la enzima ciclooxigenasa. Si bien se utiliza para proporcionar alivio de la fiebre y la inflamación (dolor), su mecanismo de acción aún no se entiende completamente.
¿Cómo se descubren las drogas? Uno de los mayores desafíos en el descubrimiento de fármacos es identificar un objetivo farmacológico. Una diana farmacológica es una molécula que es literalmente la diana de la droga. En el caso de las estatinas, la HMG-CoA reductasa es el fármaco diana. Las dianas farmacológicas se identifican a través de una minuciosa investigación en el laboratorio. Identificar el objetivo por sí solo no es suficiente; los científicos también necesitan saber cómo actúa el objetivo dentro de la célula y qué reacciones salen mal en el caso de la enfermedad. Una vez que se identifica el objetivo y la vía, entonces comienza el proceso real de diseño de fármacos. En esta etapa, químicos y biólogos trabajan juntos para diseñar y sintetizar moléculas que puedan bloquear o activar una reacción en particular. Sin embargo, esto es solo el comienzo: Si y cuando un prototipo de medicamento tiene éxito en el desempeño de su función, entonces es sometido a muchas pruebas desde experimentos in vitro hasta ensayos clínicos antes de que pueda obtener la aprobación de la Administración de Alimentos y Medicamentos de Estados Unidos para estar en el mercado.
Muchas enzimas no funcionan de manera óptima, o incluso en absoluto, a menos que se unan a otras moléculas auxiliares específicas que no son proteínas. Pueden unirse temporalmente a través de enlaces iónicos o de hidrógeno, o permanentemente a través de enlaces covalentes más fuertes. La unión a estas moléculas promueve la forma y función óptimas de sus respectivas enzimas. Dos ejemplos de este tipo de moléculas colaboradoras son cofactores y coenzimas. Los cofactores son iones inorgánicos como iones de hierro y magnesio. Las coenzimas son moléculas auxiliares orgánicas, aquellas con una estructura atómica básica compuesta por carbono e hidrógeno. Al igual que las enzimas, estas moléculas participan en reacciones sin ser cambiadas ellas mismas y en última instancia son recicladas y reutilizadas. Las vitaminas son la fuente de las coenzimas. Algunas vitaminas son las precursoras de las coenzimas y otras actúan directamente como coenzimas. La vitamina C es una coenzima directa para múltiples enzimas que participan en la construcción del importante tejido conectivo, el colágeno. Por lo tanto, la función enzimática está, en parte, regulada por la abundancia de diversos cofactores y coenzimas, que pueden ser suministrados por la dieta de un organismo o, en algunos casos, producidos por el organismo.
Inhibición de retroalimentación en vías metabólicas
Las moléculas pueden regular la función enzimática de muchas maneras. La mayor pregunta sigue siendo, sin embargo: ¿Cuáles son estas moléculas y de dónde provienen? Algunos son cofactores y coenzimas, como has aprendido. ¿Qué otras moléculas en la célula proporcionan regulación enzimática como la modulación alostérica, y la inhibición competitiva y no competitiva? Quizás las fuentes más relevantes de moléculas reguladoras, con respecto al metabolismo celular enzimático, son los productos de las propias reacciones metabólicas celulares. De una manera más eficiente y elegante, las células han evolucionado para utilizar los productos de sus propias reacciones para la inhibición por retroalimentación de la actividad enzimática. La inhibición de retroalimentación implica el uso de un producto de reacción para regular su propia producción adicional (Figura\(\PageIndex{10}\)). La célula responde a la abundancia de los productos al ralentizar la producción durante las reacciones anabólicas o catabólicas. Dichos productos de reacción pueden inhibir las enzimas que catalizaron su producción a través de los mecanismos descritos anteriormente.
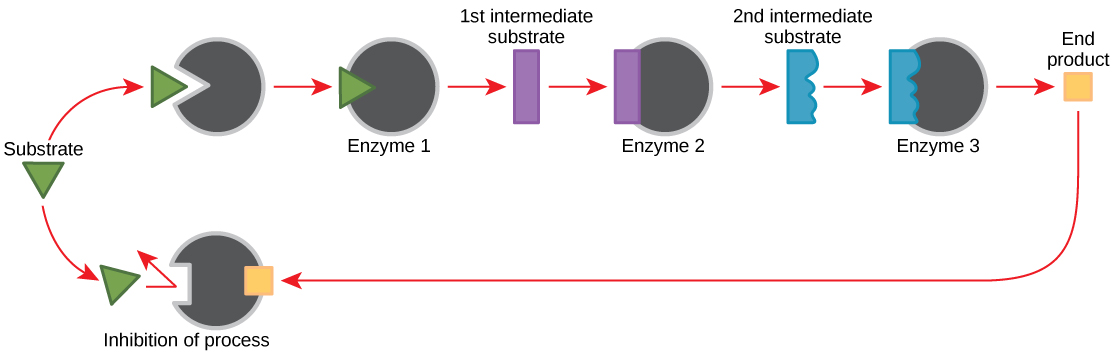
La producción de aminoácidos y nucleótidos se controla a través de la inhibición por retroalimentación. Adicionalmente, el ATP es un regulador alostérico de algunas de las enzimas involucradas en la descomposición catabólica del azúcar, el proceso que crea ATP. De esta manera, cuando el ATP está en abundante suministro, la célula puede impedir la producción de ATP. Por otro lado, el ADP sirve como regulador alostérico positivo (un activador alostérico) para algunas de las mismas enzimas que son inhibidas por el ATP. Así, cuando los niveles relativos de ADP son altos en comparación con ATP, la célula se activa para producir más ATP a través del catabolismo del azúcar.
Resumen de la Sección
Las células realizan las funciones de la vida a través de diversas reacciones químicas. El metabolismo de una célula se refiere a la combinación de reacciones químicas que tienen lugar dentro de ella. Las reacciones catabólicas descomponen los químicos complejos en otros más simples y están asociados con la liberación de energía. Los procesos anabólicos construyen moléculas complejas a partir de otras más simples y requieren energía.
Al estudiar la energía, el término sistema se refiere a la materia y al medio ambiente involucrados en las transferencias de energía. La entropía es una medida del trastorno de un sistema. Las leyes físicas que describen la transferencia de energía son las leyes de la termodinámica. La primera ley establece que la cantidad total de energía en el universo es constante. La segunda ley de la termodinámica establece que toda transferencia de energía implica alguna pérdida de energía en una forma inutilizable, como la energía térmica. La energía viene en diferentes formas: cinética, potencial y libre. El cambio en la energía libre de una reacción puede ser negativo (libera energía, exergónico) o positivo (consume energía, endergónico). Todas las reacciones requieren una entrada inicial de energía para proceder, llamada energía de activación.
Las enzimas son catalizadores químicos que aceleran las reacciones químicas al disminuir su energía de activación. Las enzimas tienen un sitio activo con un entorno químico único que se adapta a reactivos químicos particulares para esa enzima, llamados sustratos. Se cree que las enzimas y los sustratos se unen de acuerdo con un modelo de ajuste inducido. La acción enzimática está regulada para conservar los recursos y responder de manera óptima al medio ambiente.
Conexiones de arte
Figura\(\PageIndex{5}\): Observe cada uno de los procesos mostrados y decida si es endergónico o exergónico.
- Responder
-
La descomposición de una pila de compost es un proceso exergónico. Un bebé que se desarrolla a partir de un óvulo fertilizado es un proceso endergónico. El té que se disuelve en agua es un proceso exergónico. Una bola rodando cuesta abajo es un proceso exergónico.
Glosario
- energía de activación
- la cantidad de energía inicial necesaria para que ocurran las reacciones
- sitio activo
- una región específica en la enzima donde se une el sustrato
- inhibición alostérica
- el mecanismo para inhibir la acción enzimática en el que una molécula reguladora se une a un segundo sitio (no al sitio activo) e inicia un cambio de conformación en el sitio activo, evitando la unión con el sustrato
- anabólica
- describe la vía que requiere una entrada neta de energía para sintetizar moléculas complejas a partir de moléculas más simples
- bioenergética
- el concepto de flujo de energía a través de sistemas vivos
- catabólico
- describe la vía en la que las moléculas complejas se descomponen en otras más simples, produciendo energía como un producto adicional de la reacción
- inhibición competitiva
- un mecanismo general de regulación de la actividad enzimática en el que una molécula distinta del sustrato de la enzima es capaz de unirse al sitio activo y evitar que el propio sustrato se una, inhibiendo así la velocidad global de reacción de la enzima
- endergónico
- describe una reacción química que da como resultado productos que almacenan más energía potencial química que los reactivos
- enzima
- una molécula que cataliza una reacción bioquímica
- exergónico
- describe una reacción química que da como resultado productos con menos energía potencial química que los reactivos, más la liberación de energía libre
- inhibición de retroalimentación
- un mecanismo de regulación de la actividad enzimática en el que el producto de una reacción o el producto final de una serie de reacciones secuenciales inhibe una enzima para una etapa anterior en la serie de reacciones
- energía térmica
- la energía transferida de un sistema a otro que no es trabajo
- energía cinética
- el tipo de energía asociada con los objetos en movimiento
- metabolismo
- todas las reacciones químicas que tienen lugar dentro de las células, incluidas las que usan energía y las que liberan energía
- inhibición no competitiva
- un mecanismo general de regulación de la actividad enzimática en el que una molécula reguladora se une a un sitio distinto del sitio activo y evita que el sitio activo se una al sustrato; así, la molécula inhibidora no compite con el sustrato por el sitio activo; la inhibición alostérica es una forma de inhibición no competitiva
- energía potencial
- el tipo de energía que se refiere al potencial para hacer trabajo
- sustrato
- una molécula sobre la que actúa la enzima
- termodinámica
- la ciencia de las relaciones entre el calor, la energía y el trabajo


