8.5: Energía Libre y de Activación
- Page ID
- 58706
Después de enterarse de que las reacciones químicas liberan energía cuando se rompen los enlaces de almacenamiento de energía, una siguiente pregunta importante es la siguiente: ¿Cómo se cuantifica y expresa la energía asociada a estas reacciones químicas? ¿Cómo se puede comparar la energía liberada de una reacción con la de otra reacción? Se utiliza una medición de la energía libre para cuantificar estas transferencias de energía. Recordemos que según la segunda ley de la termodinámica, todas las transferencias de energía implican la pérdida de alguna cantidad de energía en una forma inutilizable como el calor. La energía libre se refiere específicamente a la energía asociada a una reacción química que está disponible después de contabilizar las pérdidas. En otras palabras, la energía libre es energía utilizable, o energía que está disponible para hacer el trabajo. Mirando este concepto en un sentido biológico, la energía libre es la energía dentro de una molécula que puede ser utilizada para realizar trabajos. La glucosa tiene mucha energía libre porque hay mucha energía almacenada dentro de los enlaces de la molécula de glucosa. El dióxido de carbono tiene una energía libre mucho menor porque hay mucha menos energía almacenada en sus enlaces.
Si se libera energía durante una reacción química, entonces el cambio en la energía libre de la conversión de los reactivos a los productos, significada como ΔG (delta G) será un número negativo. Un cambio negativo en la energía libre también significa que los productos de la reacción tienen menos energía libre que los reactivos, porque liberan algo de energía libre durante la reacción. Las reacciones que tienen un cambio negativo en la energía libre y en consecuencia liberan energía libre se denominan reacciones exergónicas. Piense: ex ergónico significa que la energía está exitando el sistema. Estas reacciones también se denominan reacciones espontáneas, y sus productos tienen menos energía almacenada que los reactivos. Se debe hacer una distinción importante entre el término espontáneo y la idea de una reacción química que ocurra inmediatamente. Contrario al uso cotidiano del término, una reacción espontánea no es aquella que ocurre súbita o rápidamente. La oxidación del hierro es un ejemplo de una reacción espontánea que se produce lentamente, poco a poco, a lo largo del tiempo.
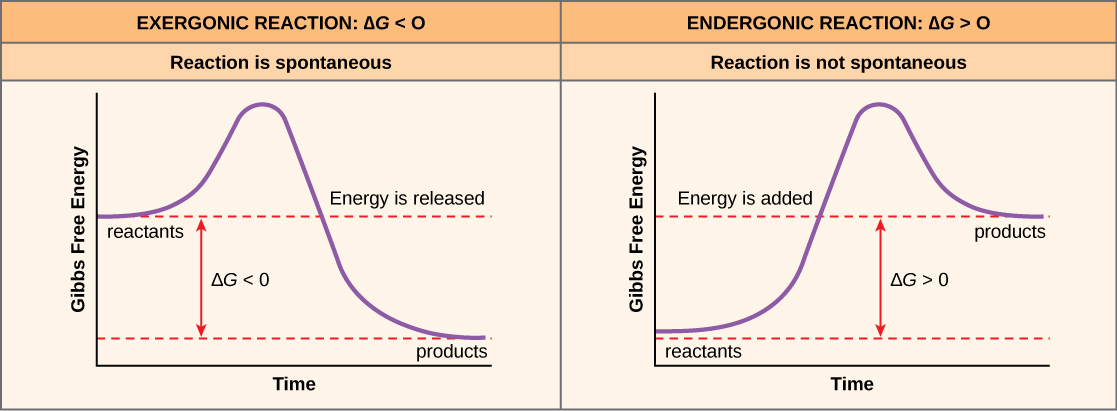
Si una reacción química absorbe energía en lugar de liberar energía en balance, entonces el ΔG para esa reacción será un valor positivo. En este caso, los productos tienen más energía libre que los reactivos. Así, los productos de estas reacciones pueden considerarse como moléculas que almacenan energía. Estas reacciones químicas se denominan reacciones endergónicas y son no espontáneas.
Una reacción endergónica no tendrá lugar por sí sola sin la adición de energía libre.

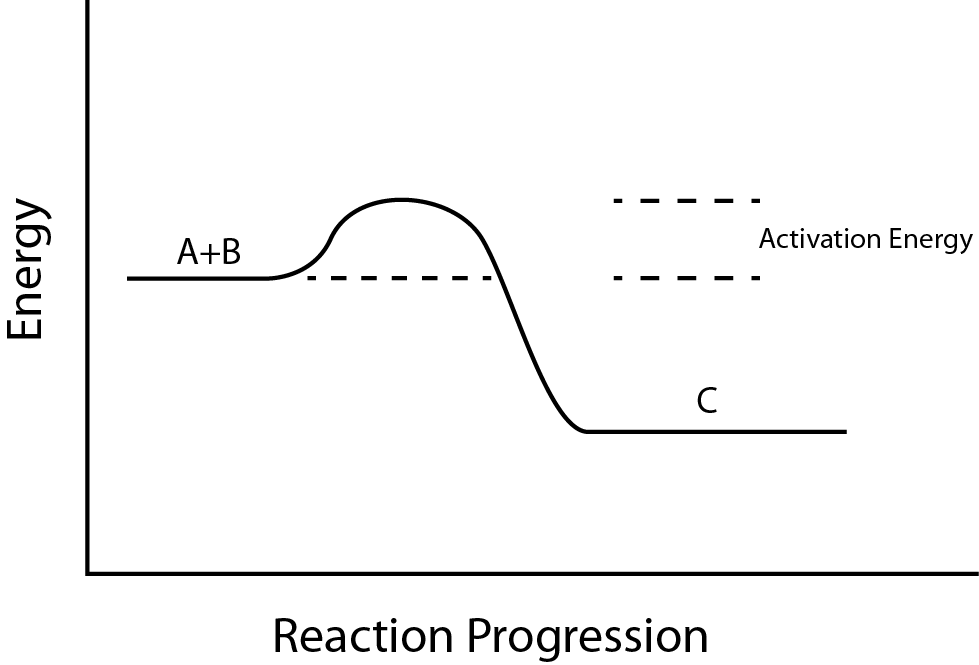
Existe otro concepto importante que debe considerarse respecto a las reacciones endergónicas y exergónicas. Las reacciones exergónicas requieren una pequeña cantidad de entrada de energía para ponerse en marcha, antes de que puedan continuar con sus pasos de liberación de energía.
Estas reacciones tienen una liberación neta de energía, pero aún así requieren algún aporte de energía al principio. Esta pequeña cantidad de entrada de energía necesaria para que ocurran todas las reacciones químicas se denomina energía de activación (Figura\(\PageIndex{3}\)).
Referencias
A menos que se indique lo contrario, las imágenes de esta página están bajo licencia CC-BY 4.0 de OpenStax.
Texto adaptado de: OpenStax, Conceptos de Biología. OpenStax CNX. mayo 18, 2016 http://cnx.org/contents/b3c1e1d2-839...9a8aafbdd@9.10

