8.6: Enzimas
- Page ID
- 58687
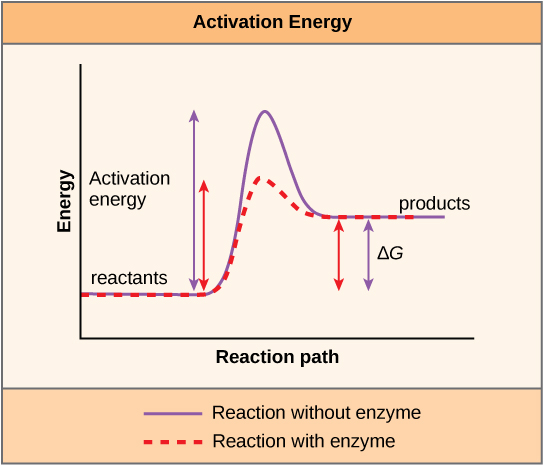
Una sustancia que ayuda a que ocurra una reacción química se llama catalizador, y las moléculas que catalizan las reacciones bioquímicas se llaman enzimas. La mayoría de las enzimas son proteínas y realizan la tarea crítica de disminuir las energías de activación de las reacciones químicas dentro de la célula. La mayoría de las reacciones críticas para una célula viva ocurren demasiado lentamente a temperaturas normales para ser de alguna utilidad para la célula. Sin enzimas para acelerar estas reacciones, la vida no podría persistir. Las enzimas hacen esto uniéndose a las moléculas reaccionantes y manteniéndolas de tal manera que los procesos químicos de ruptura y formación de enlaces se lleven a cabo más fácilmente. Es importante recordar que las enzimas no cambian si una reacción es exergónica (espontánea) o endergónica. Esto se debe a que no cambian la energía libre de los reactivos o productos. Solo reducen la energía de activación requerida para que la reacción avance (Figura\(\PageIndex{1}\)). Además, una enzima misma permanece inalterada por la reacción que cataliza. Una vez catalizada una reacción, la enzima es capaz de participar en otras reacciones.
Los reactivos químicos a los que se une una enzima se denominan sustratos de la enzima. Puede haber uno o más sustratos, dependiendo de la reacción química particular. En algunas reacciones, un solo sustrato reactivo se descompone en múltiples productos. En otros, dos sustratos pueden unirse para crear una molécula más grande. Dos reactivos también pueden entrar en una reacción y ambos se modifican, pero dejan la reacción como dos productos. La ubicación dentro de la enzima donde se une el sustrato se llama sitio activo de la enzima. El sitio activo es donde ocurre la “acción”. Dado que las enzimas son proteínas, existe una combinación única de cadenas laterales de aminoácidos dentro del sitio activo. Cada cadena lateral se caracteriza por diferentes propiedades. Pueden ser grandes o pequeños, débilmente ácidos o básicos, hidrófilos o hidrófobos, cargados positiva o negativamente, o neutros. La combinación única de cadenas laterales crea un ambiente químico muy específico dentro del sitio activo. Este entorno específico es adecuado para unirse a un sustrato químico específico (o sustratos).
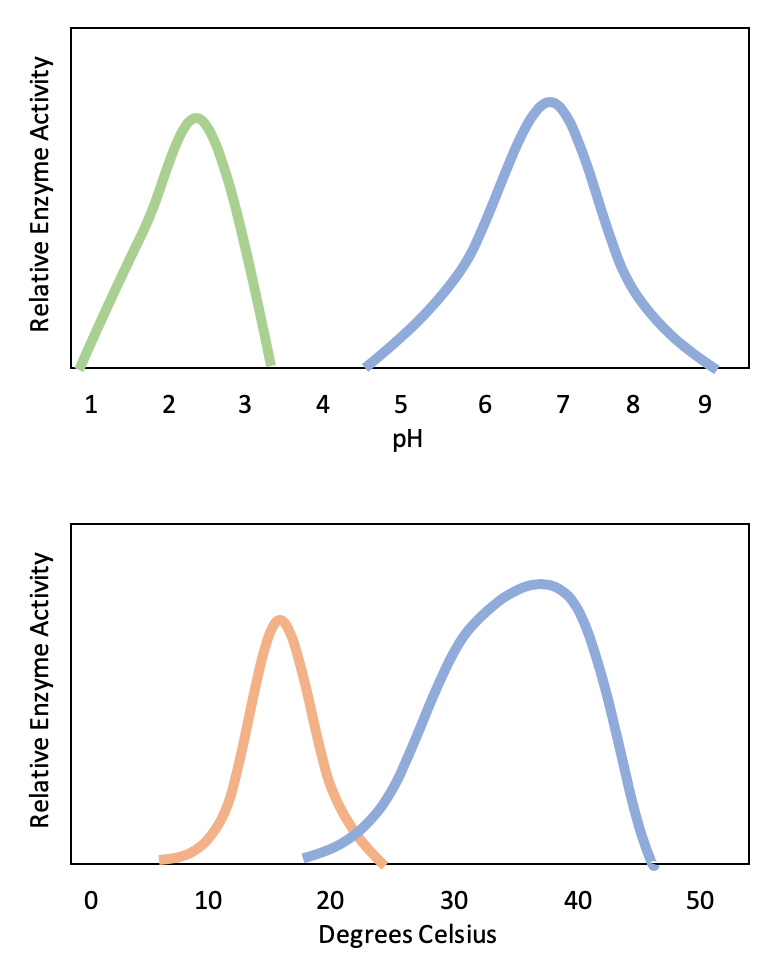
Los sitios activos están sujetos a influencias del entorno local. El aumento de la temperatura ambiental generalmente aumenta las velocidades de reacción, catalizadas por enzimas o de otra manera. Sin embargo, las temperaturas fuera de un rango óptimo reducen la velocidad a la que una enzima cataliza una reacción. Las temperaturas calientes eventualmente harán que las enzimas se desnaturalicen, un cambio irreversible en la forma tridimensional y por lo tanto en la función de la enzima (Figura\(\PageIndex{2}\)). Las enzimas también son adecuadas para funcionar mejor dentro de un cierto rango de pH y concentración de sal, y, al igual que con la temperatura, el pH extremo y las concentraciones de sal pueden causar que las enzimas se desnaturalicen.

Por lo general, las enzimas funcionan de manera óptima en el ambiente donde se encuentran y usan típicamente. Por ejemplo, la enzima amilasa se encuentra en la saliva, donde funciona para descomponer el almidón (una cadena polisacárido-carbohidrato) en azúcares más pequeños. Obsérvese que en este ejemplo, la amilasa es la enzima, el almidón es el sustrato y los azúcares más pequeños son el producto. El pH de la saliva se encuentra típicamente entre 6.2 y 7.6, siendo aproximadamente 6.7 el promedio. El pH óptimo de la amilasa está entre 6.7 y 7.0, el cual es cercano al neutro (Figura\(\PageIndex{3}\)). La temperatura óptima para la amilasa es cercana a los 37ºC (que es la temperatura del cuerpo humano).
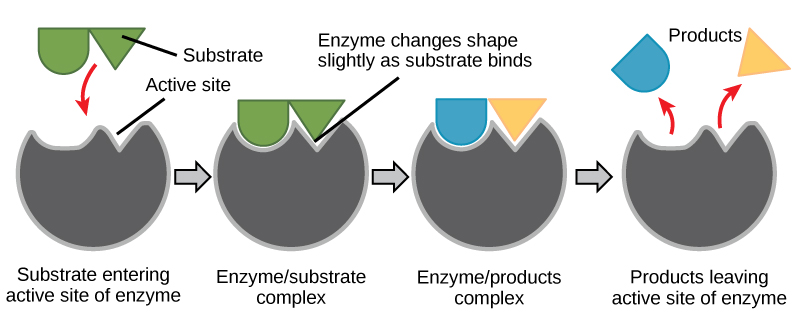
Durante muchos años, los científicos pensaron que la unión enzima-sustrato se realizaba de una manera simple de “cerradura y llave”. Este modelo aseveró que la enzima y el sustrato encajan perfectamente en un solo paso instantáneo. Sin embargo, la investigación actual apoya un modelo llamado ajuste inducido (Figura\(\PageIndex{4}\)). El modelo de ajuste inducido amplía el modelo de bloqueo y llave al describir una unión más dinámica entre la enzima y el sustrato. A medida que la enzima y el sustrato se unen, su interacción provoca un leve cambio en la estructura de la enzima que forma un arreglo de unión ideal entre la enzima y el sustrato.
Cuando una enzima se une a su sustrato, se forma un complejo enzima-sustrato. Este complejo disminuye la energía de activación de la reacción y promueve su rápida progresión en una de las múltiples formas posibles.
- A nivel básico, las enzimas promueven reacciones químicas que involucran a más de un sustrato al unir los sustratos en una orientación óptima para la reacción.
- Las enzimas promueven la reacción de sus sustratos al crear un ambiente óptimo dentro del sitio activo para que ocurra la reacción. Las propiedades químicas que emergen de la disposición particular de los grupos de aminoácidos R (cadenas laterales) dentro de un sitio activo crean el ambiente perfecto para que los sustratos específicos de una enzima reaccionen.
- El complejo enzima-sustrato también puede reducir la energía de activación comprometiendo la estructura de enlace para que sea más fácil de romper.
- Finalmente, las enzimas también pueden reducir las energías de activación al participar en la reacción química misma. En estos casos, es importante recordar que la enzima siempre volverá a su estado original al finalizar la reacción.
Una de las propiedades distintivas de las enzimas es que finalmente permanecen inalteradas por las reacciones que catalizan. Después de que una enzima ha catalizado una reacción, libera su (s) producto (s) y puede catalizar una nueva reacción.
Parecería ideal tener un escenario en el que todas las enzimas de un organismo existieran en abundante suministro y funcionaran de manera óptima en todas las condiciones celulares, en todas las células, en todo momento. Sin embargo, una variedad de mecanismos asegura que esto no suceda. Las necesidades y condiciones celulares varían constantemente de una célula a otra, y cambian dentro de las células individuales con el tiempo. Las enzimas requeridas de las células estomacales difieren de las células de almacenamiento de grasa, células de la piel, células sanguíneas y células nerviosas. Además, una célula de un órgano digestivo trabaja mucho más duro para procesar y descomponer los nutrientes durante el tiempo que sigue de cerca a una comida en comparación con muchas horas después de una comida. Como estas demandas y condiciones celulares varían, también deben ser las cantidades y funcionalidad de las diferentes enzimas.
Dado que las tasas de reacciones bioquímicas están controladas por la energía de activación, y las enzimas disminuyen y determinan las energías de activación para las reacciones químicas, las cantidades relativas y el funcionamiento de la variedad de enzimas dentro de una célula determinan en última instancia qué reacciones procederán y a qué velocidades. Esta determinación está estrechamente controlada en las células. En ciertos ambientes celulares, la actividad enzimática está parcialmente controlada por factores ambientales como el pH, la temperatura, la concentración de sal y, en algunos casos, cofactores o coenzimas.
Las enzimas también pueden regularse de manera que promuevan o reduzcan la actividad enzimática. Existen muchos tipos de moléculas que inhiben o promueven la función enzimática, y diversos mecanismos por los cuales lo hacen. En algunos casos de inhibición enzimática, una molécula inhibidora es lo suficientemente similar a un sustrato como para que pueda unirse al sitio activo y simplemente bloquear la unión del sustrato. Cuando esto sucede, la enzima se inhibe a través de la inhibición competitiva, debido a que una molécula inhibidora compite con el sustrato por unirse al sitio activo.
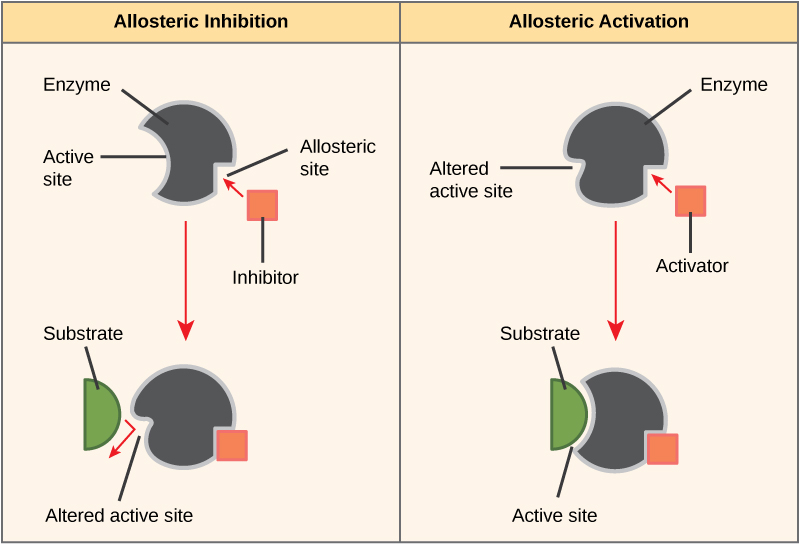
Por otro lado, en la inhibición no competitiva, una molécula inhibidora se une a la enzima en una ubicación distinta al sitio activo, denominado sitio alostérico, pero aún así logra bloquear la unión del sustrato al sitio activo. Algunas moléculas inhibidora se unen a enzimas en una ubicación donde su unión induce un cambio conformacional que reduce la afinidad de la enzima por su sustrato. Este tipo de inhibición se denomina inhibición alostérica (Figura\(\PageIndex{5}\)). La mayoría de las enzimas reguladas alostéricamente están compuestas por más de un polipéptido, lo que significa que tienen más de una subunidad proteica. Cuando un inhibidor alostérico se une a una región en una enzima, todos los sitios activos en las subunidades de proteína se cambian ligeramente de tal manera que se unen a sus sustratos con menos eficiencia. Existen activadores alostéricos así como inhibidores. Los activadores alostéricos se unen a ubicaciones en una enzima lejos del sitio activo, induciendo un cambio conformacional que aumenta la afinidad del sitio o sitios activos de la enzima por su sustrato (s) (Figura\(\PageIndex{5}\)).
Muchas enzimas no funcionan de manera óptima, o incluso en absoluto, a menos que se unan a otras moléculas colaboradoras no proteicas específicas. Pueden unirse temporalmente a través de enlaces iónicos o de hidrógeno, o permanentemente a través de enlaces covalentes más fuertes. La unión a estas moléculas promueve la forma y función óptimas de sus respectivas enzimas. Dos ejemplos de este tipo de moléculas auxiliares son cofactores y coenzimas. Los cofactores son iones inorgánicos como iones de hierro y magnesio. Las coenzimas son moléculas colaboradoras orgánicas, aquellas con una estructura atómica básica compuesta por carbono e hidrógeno. Al igual que las enzimas, estas moléculas participan en reacciones sin ser cambiadas ellas mismas y en última instancia son recicladas y reutilizadas. Las vitaminas son la fuente de las coenzimas. Algunas vitaminas son las precursoras de las coenzimas y otras actúan directamente como coenzimas. La vitamina C es una coenzima directa para múltiples enzimas que participan en la construcción del importante tejido conectivo, el colágeno. Por lo tanto, la función enzimática está, en parte, regulada por la abundancia de diversos cofactores y coenzimas, que pueden ser suministrados por la dieta de un organismo o, en algunos casos, producidos por el organismo.
Consulta\(\PageIndex{1}\)
Consulta\(\PageIndex{2}\)
Consulta\(\PageIndex{3}\)
Consulta\(\PageIndex{4}\)
Consulta\(\PageIndex{5}\)
Referencias
A menos que se indique lo contrario, las imágenes de esta página están bajo licencia CC-BY 4.0 de OpenStax.
Texto adaptado de: OpenStax, Conceptos de Biología. OpenStax CNX. mayo 18, 2016 http://cnx.org/contents/b3c1e1d2-839...9a8aafbdd@9.10

