7.2: Materia
- Page ID
- 54236
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La materia es la “materia” que se encuentra en los ecosistemas. Técnicamente, la materia se define como cualquier cosa que ocupe espacio o tenga masa. La masa es resistencia a la aceleración. En pocas palabras, la masa es similar al peso, pero el peso representa la aceleración debido a la gravedad. La materia se mueve entre los componentes bióticos y abióticos del ecosistema a través de ciclos biogeoquímicos. Comprender plenamente estos ciclos, requiere de un fondo en las partículas que comprenden la materia, los átomos.
Átomos y moléculas
Los elementos son sustancias que no pueden descomponerse ni transformarse químicamente en otras sustancias (figura\(\PageIndex{a}\)). Se han definido un total de 118 elementos; sin embargo, solo 92 ocurren de forma natural y menos de 30 se encuentran en organismos. Los 26 elementos restantes son inestables y por lo tanto no existen por mucho tiempo o son teóricos y aún no se han detectado. Cada elemento es designado por su símbolo químico (como H, N, O, C y Na), y posee propiedades únicas. Estas propiedades únicas permiten que los elementos se combinen y se unan entre sí de maneras específicas.
Un átomo es el componente más pequeño de un elemento que conserva todas las propiedades químicas de ese elemento. Por ejemplo, un átomo de hidrógeno tiene todas las propiedades del elemento hidrógeno, tal como existe como un gas a temperatura ambiente y se une con el oxígeno para crear una molécula de agua. Los átomos de hidrógeno no se pueden descomponer en nada más pequeño sin dejar de conservar las propiedades del hidrógeno. Si un átomo de hidrógeno se descomponía en partículas más pequeñas, ya no tendría las propiedades del hidrógeno. En el nivel más básico, todos los organismos están hechos de una combinación de elementos. Contienen átomos que se combinan entre sí para formar moléculas. Las moléculas pueden interactuar para formar células, las unidades estructurales y funcionales de la vida. En organismos multicelulares, como los animales, estas células se combinan para formar tejidos, que conforman órganos. Estas combinaciones continúan hasta que se forman organismos multicelulares enteros.
Los átomos se combinan para formar moléculas. Las moléculas son sustancias químicas hechas de dos o más átomos unidos entre sí. Algunas moléculas son muy simples, como O 2, que se compone de solo dos átomos de oxígeno. Algunas moléculas utilizadas por los organismos, como el ADN, están hechas de muchos millones de átomos. Todos los átomos contienen protones, electrones y neutrones (figura\(\PageIndex{b}\)). La única excepción es el hidrógeno (H), que por lo general solo está hecho de un protón y un electrón. Un protón es una partícula cargada positivamente que reside en el núcleo (el núcleo del átomo) de un átomo y tiene una masa de 1 y una carga de +1. Un electrón es una partícula cargada negativamente que viaja en el espacio alrededor del núcleo. En otras palabras, reside fuera del núcleo. Tiene una masa insignificante y tiene una carga de —1. Los neutrones, al igual que los protones, residen en el núcleo de un átomo. Tienen una masa de 1 y sin cargo. Las cargas positivas (protones) y negativas (electrones) se equilibran entre sí en un átomo neutro, que tiene una carga neta cero.
Cada elemento contiene un número diferente de protones y neutrones, dándole su propio número atómico y número másico. El número atómico de un elemento es igual al número de protones que contiene ese elemento. El número de masa es el número de protones más el número de neutrones de ese elemento. Por lo tanto, es posible determinar el número de neutrones restando el número atómico del número másico.
Bonos Químicos
La forma en que los elementos interactúan entre sí depende del número de electrones y de cómo están dispuestos. Cuando un átomo no contiene igual número de protones y electrones se le llama ion. Debido a que el número de electrones no es igual al número de protones, cada ion tiene una carga neta. Por ejemplo, si el sodio pierde un electrón, ahora tiene 11 protones y sólo 10 electrones, dejándolo con una carga general de +1. Los iones positivos se forman al perder electrones y se llaman cationes. Los iones negativos se forman ganando electrones y se llaman aniones. Los nombres aniónicos elementales se cambian para terminar en -ide. Como ejemplo, cuando el cloro se convierte en un ion se le conoce como cloruro.
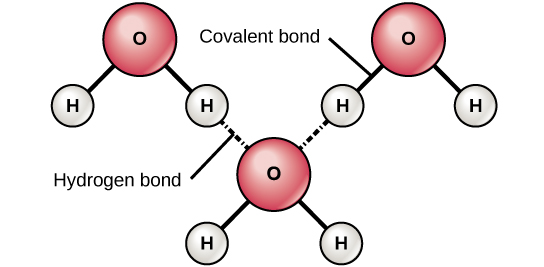
Los enlaces iónicos y covalentes son fuertes enlaces formados entre dos átomos. Estos enlaces mantienen unidos a los átomos en un estado relativamente estable. Los enlaces iónicos se forman entre dos iones cargados opositivamente (un anión y un catión). Debido a que las cargas positivas y negativas se atraen, estos iones se mantienen unidos al igual que dos imanes con carga contraria se pegarían juntos. Los enlaces covalentes se forman cuando los electrones se comparten entre dos átomos. Cada átomo comparte uno de sus electrones, que luego orbita los núcleos de ambos átomos, manteniendo los dos átomos juntos. Los enlaces covalentes son la forma más fuerte y común de enlace químico en los organismos. A diferencia de la mayoría de los enlaces iónicos, los enlaces covalentes no se disocian en agua. Los enlaces de hidrógeno se forman cuando las moléculas tienen una distribución desigual de electrones y, por lo tanto, tienen extremos parcialmente positivos y parcialmente negativos. Por lo tanto, se sienten atraídos el uno al otro (figura\(\PageIndex{c}\)). Técnicamente, los enlaces de hidrógeno solo ocurren entre hidrógeno y oxígeno (O), nitrógeno (N) o flúor (F). En ocasiones, los enlaces de hidrógeno conectan diferentes partes o moléculas grandes, como es el caso en el ADN y las proteínas. Los enlaces de hidrógeno son más débiles que los enlaces iónicos y covalentes y pueden romperse fácilmente. (Tenga en cuenta que los enlaces de hidrógeno se encuentran entre las fuerzas intermoleculares más fuertes, las que ocurren entre las moléculas, sin embargo).
Macromoléculas Biológicas
Los organismos contienen grandes moléculas orgánicas llamadas macromoléculas biológicas. Las moléculas orgánicas son aquellas que contienen carbono unido covalentemente a hidrógeno. (Por el contrario, las moléculas inorgánicas carecen de carbono unido al hidrógeno y a menudo son más simples que las moléculas orgánicas). Además, pueden contener oxígeno, nitrógeno, fósforo, azufre y elementos adicionales.Existen cuatro clases principales de macromoléculas biológicas: carbohidratos, lípidos, proteínas y ácidos nucleicos. Cada uno es un componente importante de la celda y realiza una amplia gama de funciones.
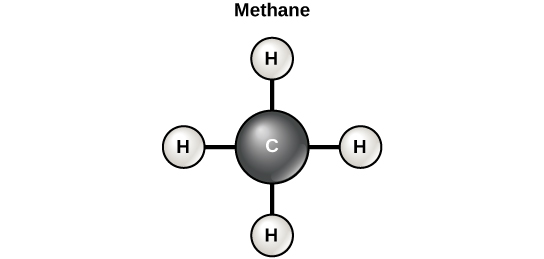
A menudo se dice que la vida es “a base de carbono”. Esto significa que los átomos de carbono, unidos a otros átomos de carbono u otros elementos, forman los componentes fundamentales de muchas de las moléculas que se encuentran de manera única en los seres vivos. Otros elementos juegan un papel importante en las moléculas biológicas, pero el carbono ciertamente califica como el elemento “fundamento” de las moléculas en los seres vivos. Son las propiedades de unión de los átomos de carbono las que son responsables de su importante papel. El carbono puede formar cuatro enlaces covalentes con otros átomos o moléculas. La molécula de carbono orgánico más simple es el metano (CH 4), en el que cuatro átomos de hidrógeno se unen a un átomo de carbono (figura\(\PageIndex{d}\)).
Los carbohidratos incluyen lo que comúnmente se conoce como azúcares simples, como la glucosa, y carbohidratos complejos como el almidón. Si bien muchos tipos de carbohidratos se utilizan como energía, algunos son utilizados para la estructura por la mayoría de los organismos, incluyendo plantas y animales. Por ejemplo, la celulosa es un carbohidrato complejo que agrega rigidez y resistencia a la capa externa de las células vegetales (las paredes celulares).
Los lípidos incluyen un grupo diverso de compuestos que están unidos por una característica común: los lípidos son insolubles en agua. Los lípidos realizan muchas funciones diferentes en una célula. Las células almacenan energía para su uso a largo plazo en forma de lípidos llamados grasas. Los lípidos también proporcionan aislamiento del ambiente para plantas y animales. Por ejemplo, ayudan a mantener secos a las aves y mamíferos acuáticos debido a su naturaleza repelente al agua. Los lípidos también son los bloques de construcción de muchas hormonas y son un constituyente importante de las membranas que rodean a las células y forman muchas de sus estructuras internas.
Las proteínas son una de las moléculas orgánicas más abundantes en los sistemas vivos y tienen el rango de funciones más diverso de todas las macromoléculas. Todos son polímeros de aminoácidos. Las funciones de las proteínas son muy diversas porque hay 20 aminoácidos diferentes químicamente distintos que forman cadenas largas, y los aminoácidos pueden estar en cualquier orden. Las proteínas pueden funcionar en reacciones químicas facilitadas en organismos, como la fotosíntesis, transmitir mensajes como hormonas, hacer que los músculos se contraigan, y mucho más.
Los ácidos nucleicos son moléculas muy grandes que son importantes para la continuidad de la vida. Llevan el plano genético de una célula y así las instrucciones para su funcionalidad. Los dos tipos principales de ácidos nucleicos son el ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN). El ADN es el material genético que se encuentra en todos los organismos, desde bacterias unicelulares hasta mamíferos multicelulares. El otro tipo de ácido nucleico, el ARN, está principalmente involucrado en la síntesis de proteínas. El ADN y el ARN están formados por pequeños bloques de construcción conocidos como nucleótidos. El ADN tiene una hermosa estructura de doble hélice (Figura\(\PageIndex{e}\)).


