7.3: Ciclos biogeoquímicos
- Page ID
- 54203
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los ciclos biogeoquímicos, también conocidos como ciclos de nutrientes, describen el movimiento de elementos químicos a través de diferentes medios, como la atmósfera, el suelo, las rocas, los cuerpos de agua y los organismos. Los ciclos biogeoquímicos mantienen los elementos esenciales disponibles para las plantas y otros organismos.
La energía fluye direccionalmente a través de los ecosistemas, entrando como luz solar (o moléculas inorgánicas para quimioautótrofos) y saliendo como calor durante la transformación energética entre niveles tróficos. En lugar de fluir a través de un ecosistema, la materia que compone los organismos es conservada y reciclada. La ley de conservación de masas establece que la materia no se crea ni se destruye. Por ejemplo, después de una reacción química, la masa de los productos (moléculas finales) será la misma que la masa de los reactivos (moléculas de partida). Lo mismo ocurre en un ecosistema. La materia se mueve a través de diferentes medios, y los átomos pueden reaccionar para formar nuevas moléculas, pero la cantidad de materia permanece constante.
A continuación se analizan los ciclos biogeoquímicos de cuatro elementos: carbono, nitrógeno, fósforo y azufre. El ciclo de estos elementos está interconectado con el ciclo del agua. Por ejemplo, el movimiento del agua es crítico para la lixiviación de azufre y fósforo en ríos, lagos y océanos. Hoy en día, las actividades antropogénicas (humanas) están alterando todos los ecosistemas principales y los ciclos biogeoquímicos que impulsan.
El ciclo del carbono
El carbono es el componente básico de todos los materiales orgánicos y, por lo tanto, de los organismos vivos. El ciclo del carbono en realidad está compuesto por varios ciclos interconectados: uno que se ocupa del intercambio rápido de carbono entre organismos vivos y el otro con el ciclo a largo plazo del carbono a través de procesos geológicos (figura\(\PageIndex{a}\)). El efecto general es que el carbono se recicla constantemente en los procesos dinámicos que tienen lugar en la atmósfera, en la superficie y en la corteza terrestre. La gran mayoría del carbono reside como minerales inorgánicos en las rocas de la corteza. Otros reservorios de carbono, lugares donde se acumula el carbono, incluyen los océanos y la atmósfera. Algunos de los átomos de carbono en su cuerpo hoy en día pueden haber residido hace mucho tiempo en el cuerpo de un dinosaurio, o quizás alguna vez fueron enterrados en lo profundo de la corteza terrestre como minerales de roca carbonatada.
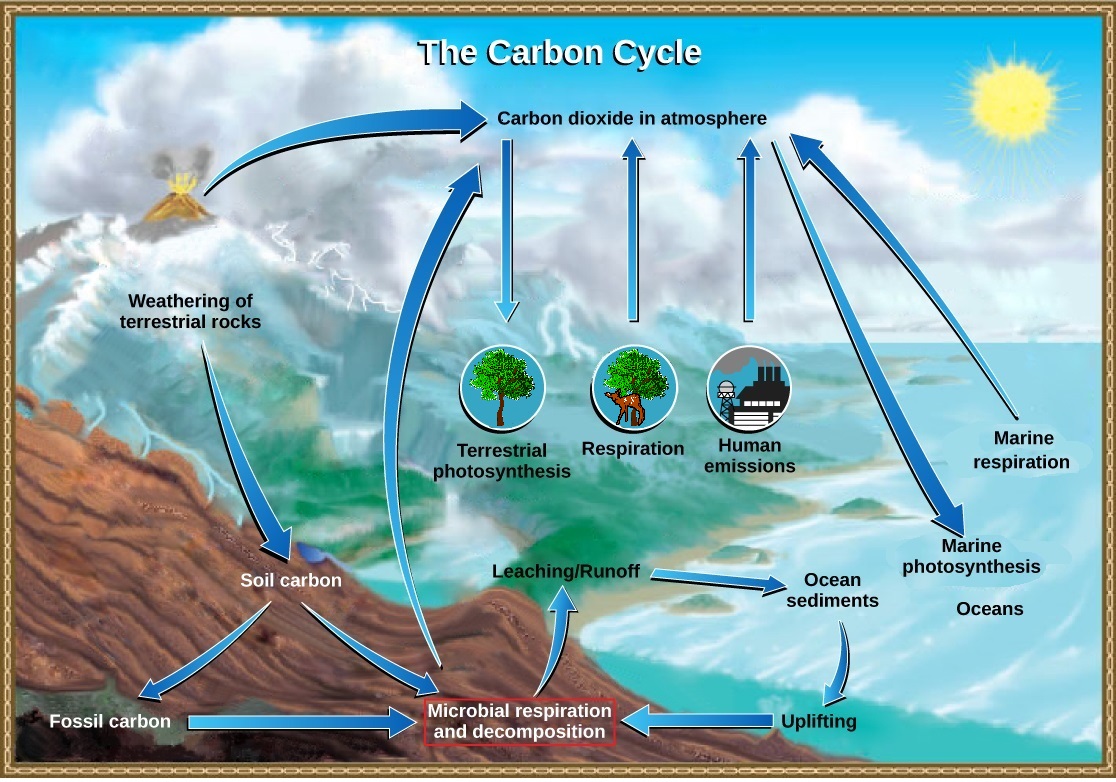
Ciclos de carbono lentamente entre la tierra y el océano
En tierra, el carbono se almacena en el suelo como carbono orgánico en forma de organismos en descomposición o rocas terrestres. Las plantas y algas descompuestas a veces son enterradas y comprimidas entre capas de sedimentos. Después de millones de años se forman combustibles fósiles como el carbón, el petróleo y el gas natural. La meteorización de rocas terrestres y minerales liberan carbono en el suelo.
Los compuestos que contienen carbono en el suelo se pueden lavar en cuerpos de agua a través de la lixiviación. Esta agua finalmente ingresa al océano. El dióxido de carbono atmosférico también se disuelve en el océano, reaccionando con moléculas de agua para formar iones carbonato (CO 3 2-). Algunos de estos iones se combinan con iones de calcio en el agua de mar para formar carbonato de calcio (CaCo 3), un componente importante de las conchas de los organismos marinos. Estos organismos finalmente mueren y sus conchas forman sedimentos en el fondo oceánico. A lo largo del tiempo geológico, el carbonato de calcio forma piedra caliza, que comprende el mayor reservorio de carbono de la Tierra
El carbonato también precipita en sedimentos, formando rocas carbonatadas, como la piedra caliza. Los sedimentos de carbono del fondo oceánico son capturados profundamente dentro de la Tierra por el proceso de subducción: el movimiento de una placa tectónica debajo de otra. Los sedimentos oceánicos son subducidos por las acciones de la tectónica de placas, fundidos y luego regresados a la superficie durante la actividad volcánica. La tectónica de placas también puede causar edificante y devolver los sedimentos oceánicos a la tierra.
Ciclos de carbono rápidamente entre los organismos y la atmósfera
El dióxido de carbono se convierte en glucosa, una molécula orgánica rica en energía a través de la fotosíntesis por plantas, algas y algunas bacterias (figura\(\PageIndex{b}\)). Luego pueden producir otras moléculas orgánicas como carbohidratos complejos (como el almidón), proteínas y lípidos, que los animales pueden comer. La mayoría de los autótrofos terrestres obtienen su dióxido de carbono directamente de la atmósfera, mientras que los autótrofos marinos lo adquieren en forma disuelta (bicarbonato, HCO 3 —).
Plantas, animales y otros organismos descomponen estas moléculas orgánicas durante el proceso de respiración celular aeróbica, que consume oxígeno y libera energía, agua y dióxido de carbono. El dióxido de carbono se devuelve a la atmósfera durante el intercambio gaseoso. Otro proceso por el que se recicla el material orgánico es la descomposición de organismos muertos. Durante este proceso, bacterias y hongos descomponen los compuestos orgánicos complejos. Los descomponedores pueden hacer respiración, liberar dióxido de carbono u otros procesos que liberen metano (CH 4).
La fotosíntesis y la respiración son en realidad recíprocas entre sí con respecto al ciclo del carbono: la fotosíntesis elimina el dióxido de carbono de la atmósfera y la respiración lo devuelve (figura\(\PageIndex{c}\)). Por lo tanto, una interrupción significativa de un proceso puede afectar la cantidad de dióxido de carbono en la atmósfera.
La respiración celular es solo un proceso que libera dióxido de carbono. Los procesos físicos, como la erupción de volcanes y la liberación de respiraderos hidrotermales (aberturas en el fondo oceánico) agregan dióxido de carbono a la atmósfera. Adicionalmente, la combustión de madera y combustibles fósiles libera dióxido de carbono. El nivel de dióxido de carbono en la atmósfera está muy influenciado por el reservorio de carbono en los océanos. El intercambio de carbono entre la atmósfera y los reservorios de agua influye en la cantidad de carbono que se encuentra en cada uno.
Importancia del Ciclo del Carbono
El ciclo del carbono es de vital importancia para la biosfera. Si no fuera por los procesos de reciclaje, el carbono podría haberse secuestrado por completo hace mucho tiempo en las rocas y sedimentos de la corteza, y la vida ya no existiría (figura\(\PageIndex{e}\)). La fotosíntesis no sólo hace que la energía y el carbono estén disponibles a niveles tróficos más altos, sino que también libera oxígeno gaseoso (O 2). El oxígeno gaseoso es necesario para que ocurra la respiración celular. Las bacterias fotosintéticas fueron probablemente los primeros organismos en realizar la fotosíntesis, que datan de hace 2-3 mil millones de años. Gracias a su actividad, y a la diversidad de organismos fotosintetizadores actuales, la atmósfera de la Tierra es actualmente de alrededor del 21% O 2. Además, este O 2 es vital para la creación de la capa de ozono, que protege la vida de la dañina radiación ultravioleta emitida por el sol. El ozono (O 3) se crea a partir de la descomposición y reensamblaje de O 2.

El ciclo global del carbono contribuye sustancialmente al aprovisionamiento de servicios ecosistémicos de los que dependen los humanos. Cosechamos aproximadamente 25% de la biomasa vegetal total que se produce cada año en la superficie terrestre para abastecer de alimentos, leña y fibra de cultivos, pastos y bosques. Además, el ciclo global del carbono juega un papel clave en la regulación de los servicios ecosistémicos porque influye significativamente en el clima a través de sus efectos sobre las concentraciones atmosféricas de CO 2
Alteración Humana del Ciclo del Carbono
La concentración atmosférica de CO 2 aumentó de 280 partes por millón (ppm) a 413 ppm entre el inicio de la revolución industrial a finales del siglo XVIII y 2020. Esto reflejó un nuevo flujo en el ciclo global del carbono, las emisiones antropogénicas de CO 2, donde los humanos liberan CO 2 a la atmósfera quemando combustibles fósiles y cambiando el uso de la tierra. La quema de combustibles fósiles toma carbono de las reservas de carbón, gas y petróleo, donde de otro modo se almacenaría en escalas de tiempo muy largas, y lo introduce en el ciclo del carbono activo. El cambio en el uso de la tierra libera carbono de los charcos de biomasa del suelo y las plantas a la atmósfera, particularmente a través del proceso de deforestación para la extracción de madera o la conversión de la tierra En 2018, el flujo adicional de carbono a la atmósfera a partir de fuentes antropogénicas se estimó en 36.6 gigatoneladas de carbono (GtC = mil millones de toneladas de carbono), una perturbación significativa en el ciclo natural del carbono que había estado en equilibrio durante varios miles de años antes. Los altos niveles de dióxido de carbono en la atmósfera provocan un calentamiento que resulta en el cambio climático. (Ver Amenazas a la Biodiversidad y Cambio Climático para más detalles.)
El Ciclo del Nitrógeno
Todos los organismos requieren nitrógeno porque es un componente importante de ácidos nucleicos, proteínas y otras moléculas orgánicas. Es difícil introducir nitrógeno en los organismos vivos. Las plantas y las algas no están equipadas para incorporar nitrógeno de la atmósfera (donde existe como N 2 covalente fuertemente unido, triple covalente) aunque esta molécula comprende aproximadamente el 78 por ciento de la atmósfera. Debido a que la mayor parte del nitrógeno se almacena en la atmósfera, la atmósfera se considera un reservorio de nitrógeno.
La molécula de nitrógeno (N 2) es bastante inerte. Para descomponerlo para que sus átomos puedan combinarse con otros átomos requiere la entrada de cantidades sustanciales de energía. La fijación de nitrógeno es el proceso de convertir gas nitrógeno en amoníaco (NH 3), que espontáneamente se convierte en amonio (NH 4 +). El amonio se encuentra en cuerpos de agua y en el suelo (figura\(\PageIndex{f}\)).

Tres procesos son responsables de la mayor parte de la fijación de nitrógeno en la biosfera. El primero es la fijación atmosférica por un rayo. La enorme energía de los rayos rompe las moléculas de nitrógeno y permite que sus átomos se combinen con el oxígeno del aire formando óxidos de nitrógeno. Estos se disuelven en la lluvia, formando nitratos, que son llevados a la tierra. La fijación de nitrógeno atmosférico probablemente aporta alrededor del 5-8% del nitrógeno total fijado. El segundo proceso es la fijación industrial. Bajo gran presión, a una temperatura de 600°C (1112°F), y con el uso de un catalizador (que facilita las reacciones químicas), el nitrógeno atmosférico y el hidrógeno se pueden combinar para formar amoníaco (NH 3). El amoníaco se puede utilizar directamente como fertilizante, pero la mayor parte se procesa posteriormente a urea y nitrato de amonio (NH 4 NO 3).
El tercer proceso es la fijación biológica por ciertas bacterias de vida libre o simbióticas. Algunos forman una relación simbiótica con las plantas de la familia de las leguminosas, que incluye frijoles, guisantes, soja, alfalfa y tréboles (figura\(\PageIndex{g}\)). Algunas bacterias fijadoras de nitrógeno incluso establecen relaciones simbióticas con animales, por ejemplo, termitas y “gusanos de barco” (bivalvos carnívoros). Las cianobacterias fijadoras de nitrógeno son esenciales para mantener la fertilidad de ambientes semiacuáticos como los arrozales. Aunque el primer producto estable del proceso es el amoníaco, éste se incorpora rápidamente en proteínas y otros compuestos orgánicos nitrogenados.

El amonio es convertido por bacterias y arqueas en nitritos (NO 2 −) y luego nitratos (NO 3 −) a través del proceso de nitrificación. Al igual que el amonio, los nitritos y nitratos se encuentran en el agua y el suelo. Algunos nitratos se convierten de nuevo en gas nitrógeno, que se libera a la atmósfera. El proceso, llamado desnitrificación, es conducido por bacterias.
Las plantas y otros productores utilizan directamente amonio y nitratos para elaborar moléculas orgánicas a través del proceso de asimilación. Este nitrógeno ya está disponible para los consumidores. El nitrógeno orgánico es especialmente importante para el estudio de la dinámica de los ecosistemas porque muchos procesos, como la producción primaria, están limitados por el suministro disponible de nitrógeno.
Los consumidores excretan compuestos orgánicos nitrogenados que regresan al ambiente. Adicionalmente, los organismos muertos en cada nivel trófico contienen nitrógeno orgánico. Los microorganismos, como bacterias y hongos, descomponen estos desechos y tejidos muertos, produciendo finalmente amonio a través del proceso de amonificación.
En los ecosistemas marinos, los compuestos nitrogenados creados por bacterias, o por descomposición, se acumulan en los sedimentos del fondo oceánico. Luego puede trasladarse a tierra en tiempo geológico mediante la elevación de la corteza terrestre y así incorporarse a la roca terrestre. Aunque el movimiento del nitrógeno de la roca directamente a los sistemas vivos se ha visto tradicionalmente como insignificante en comparación con el nitrógeno fijado desde la atmósfera, un estudio reciente demostró que este proceso puede ser significativo y debe incluirse en cualquier estudio del ciclo global del nitrógeno.
La actividad humana puede alterar el ciclo del nitrógeno por dos medios primarios: la combustión de combustibles fósiles, que liberan diferentes óxidos de nitrógeno a la atmósfera, y por el uso de fertilizantes artificiales en la agricultura. El nitrógeno atmosférico (distinto del N 2) está asociado con varios efectos en los ecosistemas de la Tierra. Los óxidos de nitrógeno (HNO 3) pueden reaccionar en la atmósfera para formar ácido nítrico, una forma de deposición ácida, también conocida como lluvia ácida. La deposición ácida daña los árboles sanos, destruye los sistemas acuáticos y erosiona materiales de construcción como el mármol y la piedra caliza. Al igual que el dióxido de carbono, el óxido nitroso (N 2 O) provoca un calentamiento que resulta en el cambio climático.
Los humanos dependen principalmente del ciclo del nitrógeno como un servicio ecosistémico de apoyo para la productividad de los cultivos y los bosques. Se agregan fertilizantes nitrogenados para potenciar el crecimiento de muchos cultivos y plantaciones (figura\(\PageIndex{h}\)). El uso mejorado de fertilizantes en la agricultura fue una característica clave de la revolución verde que impulsó los rendimientos mundiales de los cultivos en la década de 1970. La producción industrial de fertilizantes ricos en nitrógeno ha aumentado sustancialmente con el tiempo y ahora iguala más de la mitad del aporte a la tierra a partir de la fijación biológica de nitrógeno (90 megatones = 1 millón de toneladas de nitrógeno cada año). Si se incluye la fijación de nitrógeno de los cultivos de leguminosas, entonces el flujo antropogénico de nitrógeno de la atmósfera a la tierra excede los flujos naturales hacia la tierra. Los fertilizantes son lavados en lagos, arroyos y ríos por escorrentía superficial, dando como resultado la eutrofización de agua salada y agua dulce, un proceso mediante el cual la escorrentía de nutrientes provoca el crecimiento excesivo de algas, el agotamiento de oxígeno y la muerte de la fauna acuática.

El ciclo del fósforo
Varias formas de nitrógeno (gas nitrógeno, ammnoio, nitratos, etc.) estuvieron involucradas en el ciclo del nitrógeno, pero el fósforo permanece principalmente en forma del ion fosfato (PO 4 3-). También en contraste con el ciclo del nitrógeno, no hay forma de fósforo en la atmósfera. El fósforo se utiliza para elaborar ácidos nucleicos y los fosfolípidos que comprenden membranas biológicas.
Las rocas son un reservorio de fósforo, y estas rocas tienen su origen en el océano. Los sedimentos oceánicos que contienen fosfato se forman principalmente a partir de los cuerpos de los organismos oceánicos y de sus excreciones. Sin embargo, la ceniza volcánica, los aerosoles y el polvo mineral también pueden ser fuentes significativas de fosfato. Este sedimento luego es trasladado a la tierra a lo largo del tiempo geológico por la elevación de la superficie de la Tierra (figura\(\PageIndex{i}\)). El movimiento del fosfato del océano a la tierra y a través del suelo es extremadamente lento, teniendo el ion fosfato promedio un tiempo de residencia oceánica entre 20,000 y 100,000 años.
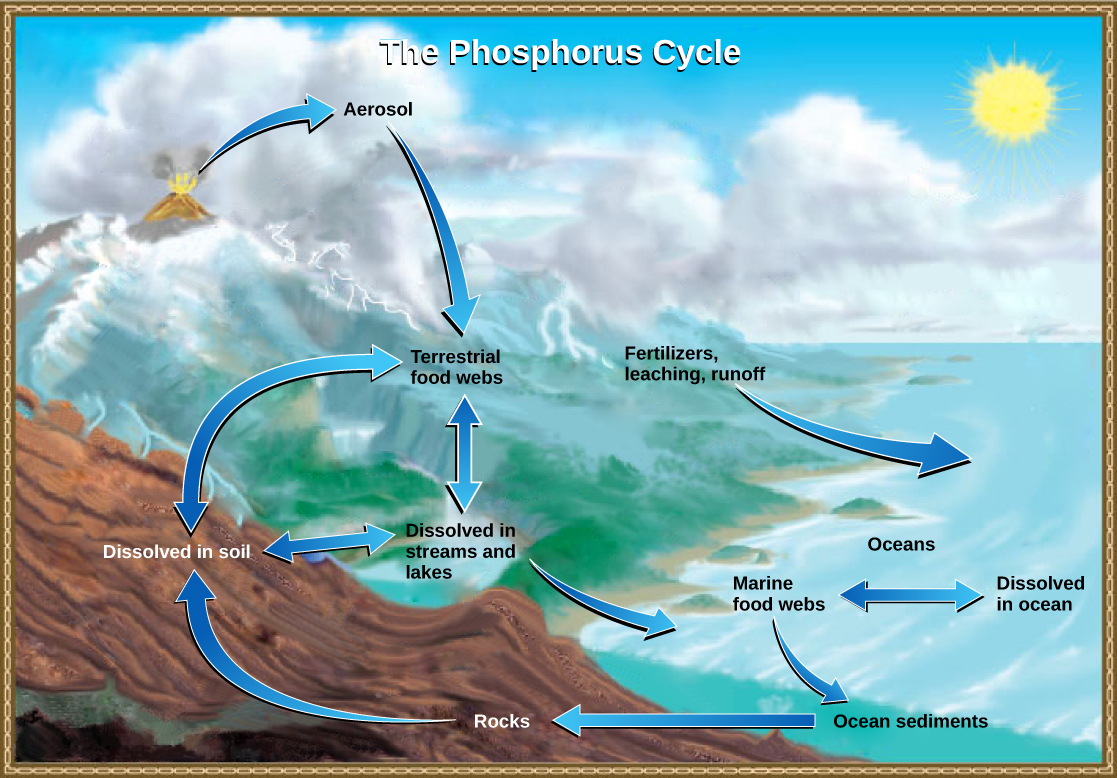
Las aves marinas juegan un papel único en el ciclo del fósforo. Estas aves absorben fósforo de los peces oceánicos. Sus excrementos en tierra (guano) contienen altos niveles de fósforo y a veces se extraen para uso comercial. Un estudio de 2020 estimó que los servicios ecosistémicos (procesos naturales y productos que benefician a los humanos) que brinda el guano valen $470 millones al año.
La meteorización de las rocas libera fosfatos en el suelo y cuerpos de agua. Las plantas pueden asimilar fosfatos en el suelo e incorporarlos en moléculas orgánicas, poniendo el fósforo a disposición de los consumidores en las redes alimentarias terrestres. Los desechos y los organismos muertos son descompuestos por hongos y bacterias, liberando fosfatos de nuevo al suelo. Algo de fosfato se lixivia del suelo, entrando en ríos, lagos y el océano. Los productores primarios en redes alimentarias acuáticas, como algas y bacterias fotosintéticas, asimilan fosfato, y el fosfato orgánico está así disponible para los consumidores en redes alimentarias acuáticas. Similar a las redes alimentarias terrestres, el fósforo se intercambia recíprocamente entre el fosfato disuelto en el océano y el fósforo orgánico en organismos marinos.
El movimiento del fósforo de la roca a los organismos vivos es normalmente un proceso muy lento, pero algunas actividades humanas aceleran el proceso. La roca portadora de fosfato a menudo se extrae para su uso en la fabricación de fertilizantes y detergentes. Esta producción comercial acelera en gran medida el ciclo del fósforo. Además, la escorrentía de tierras agrícolas y la liberación de aguas residuales en los sistemas de agua pueden provocar una sobrecarga local de fosfato. La mayor disponibilidad de fosfato puede causar crecimiento excesivo de algas. Esto reduce el nivel de oxígeno, provocando la eutrofización y la destrucción de otras especies acuáticas.
Eutrofización y Zonas Muertas
La eutrofización ocurre cuando el exceso de fósforo y nitrógeno de la escorrentía de fertilizantes o aguas residuales provoca un crecimiento excesivo de algas. Floraciones algales que bloquean la luz y, por lo tanto, matan a las plantas acuáticas en ríos, lagos y mares. La posterior muerte y descomposición de estos organismos agota el oxígeno disuelto, lo que lleva a la muerte de organismos acuáticos como mariscos y peces. Este proceso es responsable de zonas muertas, grandes áreas en lagos y océanos cerca de las desembocaduras de ríos que periódicamente se agotan de su flora y fauna normales, y de las matanzas masivas de peces, que a menudo ocurren durante los meses de verano (figura\(\PageIndex{j}\)). Hay más de 500 zonas muertas en todo el mundo. Una de las peores zonas muertas es frente a las costas de Estados Unidos en el Golfo de México. La escorrentía de fertilizantes de la cuenca del río Mississippi creó una zona muerta, que alcanzó su tamaño máximo de 8,776 millas cuadradas en 2017. La escorrentía de fosfato y nitrato de fertilizantes también afecta negativamente a varios ecosistemas de lagos y bahías, incluida la bahía de Chesapeake en el este de Estados Unidos.

Conexión diaria: Bahía de Chesapeake
La bahía de Chesapeake ha sido valorada durante mucho tiempo como una de las áreas más pintorescas de la Tierra; ahora está en peligro y es reconocida como un ecosistema en declive. En la década de 1970, la bahía de Chesapeake fue uno de los primeros ecosistemas en haber identificado zonas muertas, que continúan matando a muchos peces y especies que habitan en el fondo, como almejas, ostras y gusanos (figura\(\PageIndex{k}\)). Varias especies han disminuido en la bahía de Chesapeake debido a la escorrentía de agua superficial que contiene nutrientes excesivos de fertilizantes artificiales utilizados en la tierra. La fuente de los fertilizantes (con alto contenido de nitrógeno y fosfato) no se limita a las prácticas agrícolas. Hay muchas áreas urbanas cercanas y más de 150 ríos y arroyos vacíos en la bahía que están transportando escorrentía de fertilizantes de céspedes y jardines. Así, el declive de la bahía de Chesapeake es un tema complejo y requiere la cooperación de la industria, la agricultura y los propietarios de viviendas cotidianas.

De particular interés para los conservacionistas es la población de ostras; se estima que más de 200,000 acres de arrecifes de ostras existieron en la bahía en el siglo XVIII, pero ese número ahora ha disminuido a solo 36 mil acres. La cosecha de ostras fue una vez una industria importante para la bahía de Chesapeake, pero disminuyó 88 por ciento entre 1982 y 2007. Esta disminución se debió no sólo a la escorrentía de fertilizantes y a las zonas muertas sino también a la sobreexplotación. Las ostras requieren una cierta densidad mínima de población porque deben estar muy cerca para reproducirse. La actividad humana ha alterado la población y ubicación de las ostras, alterando enormemente el ecosistema.
La restauración de la población de ostras en la bahía de Chesapeake ha estado en curso desde hace varios años con éxito mixto. No sólo muchas personas encuentran buenas para comer las ostras, sino que también limpian la bahía. Las ostras son comederos filtrantes, y a medida que comen, limpian el agua que las rodea. En la década de 1700, se estimó que la población de ostras tardó sólo unos días en filtrar todo el volumen de la bahía. Hoy, con las condiciones del agua cambiadas, se estima que la población actual tardaría casi un año en hacer el mismo trabajo.
Los esfuerzos de restauración han estado en curso durante varios años por organizaciones sin fines de lucro, como la Fundación Chesapeake Bay. El objetivo de la restauración es encontrar una manera de incrementar la densidad poblacional para que las ostras puedan reproducirse de manera más eficiente. Muchas variedades resistentes a enfermedades (desarrolladas en el Instituto de Ciencias Marinas de Virginia para el Colegio de William y Mary) ya están disponibles y se han utilizado en la construcción de arrecifes experimentales de ostras. Los esfuerzos para limpiar y restaurar la bahía por parte de Virginia y Delaware se han visto obstaculizados porque gran parte de la contaminación que ingresa a la bahía proviene de otros estados, lo que enfatiza la necesidad de cooperación interestatal para lograr una restauración exitosa.
Las nuevas y abundantes cepas de ostras también han generado una industria nueva y económicamente viable, la acuicultura de ostras, que no solo suministra ostras para alimentos y ganancias, sino que también tiene el beneficio agregado de limpiar la bahía.
El Ciclo del Azufre
El azufre es un elemento esencial para las moléculas de los seres vivos. Como parte del aminoácido cisteína, es crítico para la forma tridimensional de las proteínas. Como se muestra en la Figura\(\PageIndex{l}\), los ciclos de azufre entre los océanos, la tierra y la atmósfera. El azufre atmosférico se encuentra en forma de dióxido de azufre (SO 2), que ingresa a la atmósfera de tres maneras: primero, a partir de la descomposición de moléculas orgánicas; segundo, por la actividad volcánica y respiraderos geotérmicos; y, tercero, por la quema de combustibles fósiles por parte de los humanos.
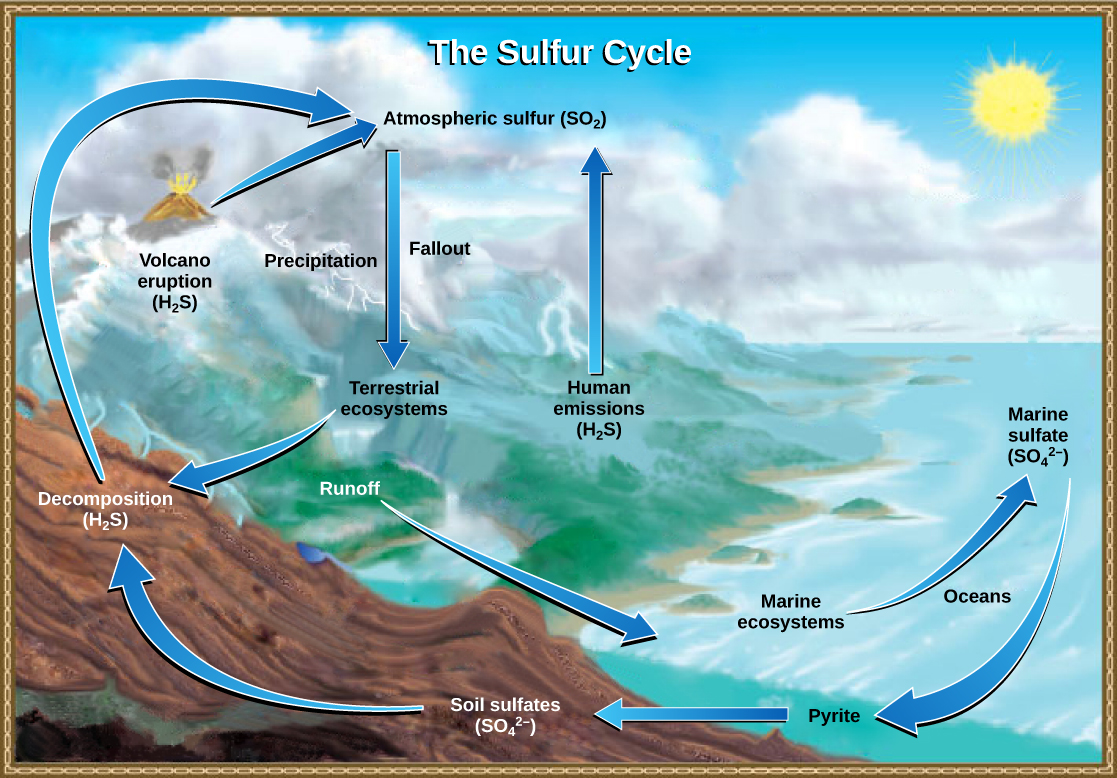
En tierra, el azufre se deposita de cuatro formas principales: precipitación, precipitación directa de la atmósfera, meteorización de rocas y respiraderos geotérmicos. El azufre atmosférico se encuentra en forma de dióxido de azufre (SO 2), y a medida que la lluvia cae a través de la atmósfera, el azufre se disuelve en forma de ácido sulfúrico débil (H 2 SO 4). El azufre también puede caer directamente de la atmósfera en un proceso llamado lluvia. Además, a medida que las rocas que contienen azufre, el azufre se libera en el suelo. Estas rocas se originan a partir de sedimentos oceánicos que son trasladados a la tierra por la elevación geológica de los sedimentos oceánicos. Los ecosistemas terrestres pueden entonces hacer uso de estos sulfatos del suelo (SO 4 2-), que ingresan a la red alimentaria al ser absorbidos por las raíces de las plantas. Cuando estas plantas se descomponen y mueren, el azufre se libera de nuevo a la atmósfera como gas sulfuro de hidrógeno (H 2 S).
El azufre ingresa al océano en escorrentía de tierra, de lluvia atmosférica y de respiraderos hidrotermales. Algunos ecosistemas dependen de microorganismos que utilizan azufre como fuente de energía biológica (en contraste con ecosistemas con productores fotosintéticos). Este azufre entonces soporta ecosistemas marinos en forma de sulfatos.
Las actividades humanas han jugado un papel importante en la alteración del equilibrio del ciclo global del azufre. La quema de grandes cantidades de combustibles fósiles, especialmente del carbón, libera dióxido de azufre, que reacciona con la atmósfera para formar ácido sulfúrico. Al igual que el ácido nítrico, el ácido sulfúrico contribuye a la deposición ácida.
Lectura suplementaria sugerida
Bruckner, M. 2018. La Zona Muerta del Golfo de México. [Sitio web]
Referencias
Cell Press. (2020, 6 de agosto). Los investigadores esperan salvar aves marinas calculando el valor de sus excrementos. Recuperado el 7 de agosto de 2020 de ScienceDaily.
Atribuciones
Modificado por Melissa Ha de las siguientes fuentes:
- Los ciclos biogeoquímicos, la energía y la energía ingresan a los ecosistemas a través de la fotosíntesis desde la biología ambiental por Matthew R. Fisher (licenciado bajo CC-BY)
- Ciclo del Carbono y Ciclo del Nitrógeno de Biología por John W. Kimball (licenciado bajo CC-BY)
- Flujo de Energía a través de Ecosistemas de Biología General por OpenStax (licenciado bajo CC-BY)
- Suelo y Sustentabilidad y Ciclos Biogeoquímicos y el Flujo de Energía en el Sistema Terrestre desde la Sustentabilidad: Una Fundación Integral por Tom Theis y Jonathan Tomkin, Editores (licenciados bajo CC-BY). Descárgala gratis en CNX.
- Cycling of Matter de AP Environmental Science por University of California College Prep, University of California (licenciado bajo CC-BY). Descárgala gratis en CNX.
- Ciclos Nutricionales de Ciencias de la Vida Grado 10 por Siyavula (CC-BY)


