9.11: Autismo: Percepciones desde el estudio del cerebro social
- Page ID
- 144041
Universidad de Yale
Las personas con trastorno del espectro autista (TEA) sufren de una profunda discapacidad social. La neurociencia social es el estudio de las partes del cerebro que apoyan las interacciones sociales o el “cerebro social”. Este módulo proporciona una visión general de TEA y se enfoca en comprender cómo la disfunción cerebral social conduce al TEA. Nuestra creciente comprensión del cerebro social y su disfunción en el TEA nos permitirá identificar mejor los genes que causan TEA y nos ayudará a crear y seleccionar tratamientos para emparejar mejor a los individuos. Debido a que los sistemas cerebrales sociales emergen en la infancia, la neurociencia social puede ayudarnos a descubrir cómo diagnosticar el TEA incluso antes de que los síntomas del TEA estén claramente presentes. Este es un momento esperanzador porque los sistemas cerebrales sociales permanecen maleables hasta bien entrada la edad adulta y, por lo tanto, están abiertos a nuevas intervenciones creativas que están informadas por la ciencia de vanguardia.
objetivos de aprendizaje
- Conocer los síntomas básicos del TEA.
- Distinguir componentes del cerebro social y entender su disfunción en TEA.
- Apreciar cómo la neurociencia social puede facilitar el diagnóstico y tratamiento del TEA.
Definición del trastorno del espectro autista
El Trastorno del Espectro Autista (TEA) es un trastorno del desarrollo que suele surgir en los primeros tres años y persiste a lo largo de la vida del individuo. Aunque los síntomas clave del TEA se clasifican en tres categorías generales (ver más abajo), cada persona con TEA exhibe síntomas en estos dominios de diferentes maneras y en diversos grados. Esta heterogeneidad fenotípica refleja el alto grado de variabilidad en los genes subyacentes al TEA (Geschwind & Levitt, 2007). Aunque hemos identificado diferencias genéticas asociadas con casos individuales de TEA, cada uno representa solo un pequeño número de los casos reales, lo que sugiere que no se aplicará una sola causa genética en la mayoría de las personas con TEA. Actualmente no existe una prueba biológica para TEA.
El autismo está en la categoría de trastornos generalizados del desarrollo, que incluye el trastorno de Asperger, el trastorno desintegrativo infantil, el trastorno autista y el trastorno generalizado del desarrollo, no especificado de otra manera. Estos trastornos, en conjunto, se etiquetan como trastorno del espectro autista (TEA). El TEA se define por la presencia de profundas dificultades en las interacciones y comunicación sociales combinadas con la presencia de intereses, cogniciones y comportamientos repetitivos o restringidos. El proceso diagnóstico implica una combinación de reporte parental y observación clínica. Los niños con deficiencias significativas en todo el dominio social/comunicación que también exhiben comportamientos repetitivos pueden calificar para el diagnóstico de TEA. Existe una amplia variabilidad en el perfil preciso de síntomas que puede presentar un individuo.
Desde que Kanner describió por primera vez el TEA en 1943, se han utilizado importantes puntos en común en la presentación de síntomas para compilar criterios para el diagnóstico de TEA. Estos criterios diagnósticos han evolucionado durante los últimos 70 años y continúan evolucionando (por ejemplo, ver los cambios recientes en los criterios diagnósticos en el sitio web de la Asociación Americana de Psiquiatría, http://www.dsm5.org/), sin embargo, el deterioro del funcionamiento social sigue siendo un síntoma requerido para un diagnóstico de TEA. Los déficits en el funcionamiento social están presentes en diversos grados para comportamientos simples como el contacto visual, y comportamientos complejos como navegar el dar y tomar de una conversación grupal para individuos de todos los niveles funcionales (es decir, coeficiente intelectual alto o bajo). Además, las dificultades con el procesamiento de la información social ocurren tanto en modalidades sensoriales visuales (p. ej., Pelphrey et al., 2002) como auditivas (por ejemplo, Dawson, Meltzoff, Osterling, Rinaldi y Brown, 1998).
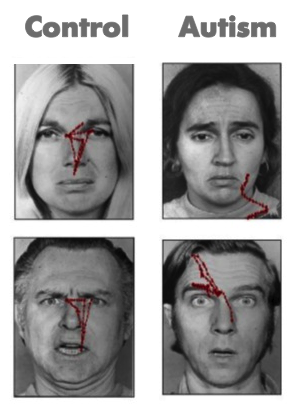
Considere los resultados de un estudio de seguimiento ocular en el que Pelphrey y sus colegas (2002) observaron que los individuos con autismo no hicieron uso de los ojos al juzgar las expresiones faciales de emoción (ver paneles de la derecha de la Figura 1). Si bien los comportamientos repetitivos o déficits del lenguaje se observan en otros trastornos (por ejemplo, el trastorno obsesivo-compulsivo y el deterioro específico del lenguaje, respectivamente), los déficits sociales básicos de esta naturaleza son exclusivos de los TEA. El inicio de los déficits sociales parece preceder a las dificultades en otros dominios (Osterling, Dawson, & Munson, 2002) y puede surgir a los 6 meses de edad (Maestro et al., 2002).
Definiendo el Cerebro Social
En las últimas décadas, la investigación ha elucidado circuitos cerebrales específicos que apoyan la percepción de los humanos y otras especies. Esta percepción social se refiere a “las etapas iniciales en el procesamiento de la información que culmina en el análisis preciso de las disposiciones e intenciones de otros individuos” (Allison, Puce, & McCarthy, 2000). La percepción social básica es un bloque de construcción crítico para comportamientos sociales más sofisticados, como pensar en los motivos y emociones de los demás. Brothers (1990) sugirió por primera vez la noción de cerebro social, un conjunto de estructuras neuroanatómicas interconectadas que procesan la información social, permitiendo el reconocimiento de otros individuos y la evaluación de sus estados mentales (por ejemplo, intenciones, disposiciones, deseos y creencias).
Se plantea la hipótesis de que el cerebro social consiste en la amígdala, la corteza frontal orbital (OFC), la circunvolución fusiforme (FG) y la región del surco temporal superior posterior (STS), entre otras estructuras. Aunque todas las áreas trabajan en coordinación para apoyar el procesamiento social, cada una parece desempeñar un papel distinto. La amígdala nos ayuda a reconocer los estados emocionales de los demás (e.g., Morris et al., 1996) y también a experimentar y regular nuestras propias emociones (e.g., LeDoux, 1992). La OFC apoya los sentimientos de “recompensa” que tenemos cuando estamos cerca de otras personas (por ejemplo, Rolls, 2000). El FG, ubicado en la parte inferior de la superficie de los lóbulos temporales detecta caras y apoya el reconocimiento facial (por ejemplo, Puce, Allison, Asgari, Gore, & McCarthy, 1996). La región STS posterior reconoce el movimiento biológico, incluyendo los movimientos de los ojos, las manos y otros movimientos corporales, y ayuda a interpretar y predecir las acciones e intenciones de otros (por ejemplo, Pelphrey, Morris, Michelich, Allison, & McCarthy, 2005).
Comprensión actual de la percepción social en TEA
El cerebro social es de gran interés de investigación porque se cree que las dificultades sociales características del TEA se relacionan estrechamente con el funcionamiento de esta red cerebral. La resonancia magnética funcional (fMRI) y los potenciales relacionados con eventos (ERP) son métodos complementarios de imágenes cerebrales que se utilizan para estudiar la actividad en el cerebro a lo largo de la vida útil. Cada método mide una faceta distinta de la actividad cerebral y aporta información única a nuestra comprensión de la función cerebral.
FMRI utiliza potentes imanes para medir los niveles de oxígeno dentro del cerebro, los cuales varían según los cambios en la actividad neuronal. A medida que las neuronas en regiones específicas del cerebro “trabajan más duro”, requieren más oxígeno. FMRI detecta las regiones cerebrales que muestran un aumento relativo en el flujo sanguíneo (y los niveles de oxígeno) mientras las personas escuchan o ven estímulos sociales en el escáner de resonancia magnética. Así se identifican las áreas del cerebro más cruciales para diferentes procesos sociales, siendo la información espacial exacta al milímetro.
En contraste, ERP proporciona mediciones directas del disparo de grupos de neuronas en la corteza. Los sensores no invasivos en el cuero cabelludo registran las pequeñas corrientes eléctricas creadas por esta actividad neuronal mientras el sujeto ve estímulos o escucha tipos específicos de información. Si bien la fMRI proporciona información sobre dónde ocurre la actividad cerebral, ERP especifica cuándo detallando el momento del procesamiento al ritmo de milisegundos al que se desarrolla.
ERP y fMRI son complementarios, con fMRI proporcionando una excelente resolución espacial y ERP que ofrece una resolución temporal excepcional. En conjunto, esta información es fundamental para comprender la naturaleza de la percepción social en los TEA. Hasta la fecha, las áreas más investigadas del cerebro social en TEA son el surco temporal superior (STS), que subyace a la percepción e interpretación del movimiento biológico, y la circunvolución fusiforme (FG), que sustenta la percepción facial. La mayor sensibilidad al movimiento biológico (para los humanos, el movimiento como caminar) desempeña un papel esencial en el desarrollo de los humanos y otras especies altamente sociales. Emergiendo en los primeros días de vida, la capacidad de detectar el movimiento biológico ayuda a orientar a los jóvenes vulnerables a fuentes críticas de sustento, apoyo y aprendizaje, y se desarrolla independientemente de la experiencia visual con el movimiento biológico (por ejemplo, Simion, Regolin, & Bulf, 2008). Este “detector de vida” innato sirve como base para el posterior desarrollo de comportamientos sociales más complejos (Johnson, 2006).

Desde muy temprano en la vida, los niños con TEA muestran sensibilidad reducida al movimiento biológico (Klin, Lin, Gorrindo, Ramsay, & Jones, 2009). Los individuos con TEA tienen actividad reducida en el STS durante la percepción biológica del movimiento. De manera similar, las personas con mayor riesgo genético de TEA pero que no desarrollan síntomas del trastorno (es decir, hermanos no afectados de individuos con TEA) muestran mayor actividad en esta región, lo que se plantea como hipótesis que es un mecanismo compensatorio para compensar la vulnerabilidad genética (Kaiser et al., 2010).
En el desarrollo típico, la atención preferencial a los rostros y la capacidad de reconocer rostros individuales emergen en los primeros días de vida (e.g., Goren, Sarty, & Wu, 1975). La forma especial en que el cerebro responde a las caras suele surgir a los tres meses de edad (por ejemplo, de Haan, Johnson, & Halit, 2003) y continúa a lo largo de la vida (por ejemplo, Bentin et al., 1996). Los niños con TEA, sin embargo, tienden a mostrar disminución de la atención a los rostros humanos entre seis y 12 meses (Osterling & Dawson, 1994). Los niños con TEA también muestran actividad reducida en el FG al ver rostros (por ejemplo, Schultz et al., 2000). El procesamiento lento de rostros (McPartland, Dawson, Webb, Panagiotides, & Carver, 2004) es una característica de las personas con TEA que comparten padres de niños con TEA (Dawson, Webb y McPartland, 2005) y bebés con mayor riesgo de desarrollar TEA debido a tener un hermano con TEA (McCleery, Akshoomoff, Dobkins, & Carver, 2009). Las diferencias conductuales y atencionales en la percepción y reconocimiento facial también son evidentes en niños y adultos con TEA (por ejemplo, Hobson, 1986).
Explorando la diversidad en TEA
Debido a la limitada calidad de los métodos conductuales utilizados para diagnosticar TEA y la práctica diagnóstica clínica actual, que permite diagnósticos similares a pesar de distintos perfiles de síntomas (McPartland, Webb, Keehn, & Dawson, 2011), es posible que el grupo de niños que actualmente se conoce como TEA pueda en realidad representan diferentes síndromes con causas distintas. El examen del cerebro social puede revelar subgrupos diagnosticalmente significativos de niños con TEA. Las mediciones del “dónde” y “cuándo” de la actividad cerebral durante las tareas de procesamiento social proporcionan fuentes confiables de la información detallada necesaria para perfilar a los niños con TEA con mayor precisión. Estos perfiles, a su vez, pueden ayudar a informar el tratamiento del TEA al ayudarnos a emparejar tratamientos específicos con perfiles específicos.
La integración de los métodos de imagen es fundamental para este esfuerzo. Usando la percepción facial como ejemplo, la combinación de fMRI y ERP podría identificar quién, de aquellos individuos con TEA, muestra anomalías en el FG y luego determinar la etapa de procesamiento de la información en la que ocurren estas deficiencias. Debido a que las diferentes etapas de procesamiento a menudo reflejan procesos cognitivos discretos, este nivel de comprensión podría fomentar tratamientos que aborden déficits de procesamiento específicos a nivel neural.
Por ejemplo, las diferencias observadas en las primeras etapas de procesamiento podrían reflejar problemas con la percepción visual de bajo nivel, mientras que las diferencias posteriores indicarían problemas con procesos de orden superior, como el reconocimiento de emociones. Estos mismos principios se pueden aplicar a la red más amplia de regiones cerebrales sociales y, combinados con medidas de funcionamiento conductual, podrían ofrecer un perfil integral del desempeño cerebro-comportamiento para un individuo determinado. Un objetivo fundamental para este tipo de abordaje de subgrupos es mejorar la capacidad de adaptar los tratamientos al individuo.
![Imagen de diferencia derivada de FMRI entre cerebros de grupos autistas y control. La leyenda dice “Activación durante la coordinación visuomotora: Grupo de Autismo [amarillo], Grupo Control [Azul], Superposición (ambos grupos) [verde]”. Imagen de diferencia derivada de FMRI entre cerebros de grupos autistas y control. La leyenda dice “Activación durante la coordinación visuomotora: Grupo de Autismo [amarillo], Grupo Control [Azul], Superposición (ambos grupos) [verde]”.](https://nobaproject.com/images/shared/images/000/002/556/original.png)
Otro objetivo es mejorar el poder de otras herramientas científicas. La mayoría de los estudios de individuos con TEA comparan grupos de individuos, por ejemplo, individuos con TEA en comparación con pares de desarrollo típico. Sin embargo, los estudios también han intentado comparar niños a través del espectro autista por grupo de acuerdo con el diagnóstico diferencial (por ejemplo, trastorno de Asperger versus trastorno autista), o por otras características conductuales o cognitivas (por ejemplo, cognitivamente capaz versus intelectualmente discapacitado o ansioso versus no- ansioso). Sin embargo, el poder de un estudio científico para detectar este tipo de diferencias significativas, significativas e individuales es tan fuerte como la precisión del factor utilizado para definir los grupos comparados.
La identificación de distintos subgrupos dentro del espectro autista de acuerdo con la información sobre el cerebro permitiría una exposición más precisa y detallada de las diferencias individuales observadas en aquellos con TEA. Esto es especialmente crítico para el éxito de las investigaciones sobre las bases genéticas de los TEA. Como se mencionó anteriormente, los genes descubiertos hasta ahora representan solo una pequeña porción de los casos de TEA. Si se identifican distinciones significativas y cuantitativas en individuos con TEA; entonces podría buscarse un examen más enfocado en las causas genéticas específicas de cada subgrupo. Además, distintos hallazgos de la neuroimagen, o biomarcadores, pueden ayudar a guiar la investigación genética. Los endofenotipos, o características que no están disponibles inmediatamente para la observación pero que reflejan una responsabilidad genética subyacente por la enfermedad, exponen los componentes más básicos de un trastorno psiquiátrico complejo y son más estables a lo largo de la vida que el comportamiento observable (Gottesman & Escudos, 1973). Al describir las características clave del TEA en estas formas objetivas, la investigación de neuroimagen facilitará la identificación de contribuciones genéticas al TEA.
Desarrollo cerebral atípico antes de la emergencia de la conducta atípica
Debido a que el autismo es un trastorno del desarrollo, es particularmente importante diagnosticar y tratar el TEA temprano en la vida. Los déficits tempranos en la atención al movimiento biológico, por ejemplo, descarrilan experiencias posteriores en la atención a información social de nivel superior, impulsando así el desarrollo hacia una disfunción más severa y estimulando déficits en dominios adicionales de funcionamiento, como el desarrollo del lenguaje. La falta de predictores confiables del padecimiento durante el primer año de vida ha sido un impedimento importante para el tratamiento efectivo del TEA. Sin predictores tempranos, y en ausencia de un diagnóstico firme hasta que surgen los síntomas conductuales, el tratamiento a menudo se retrasa por dos o más años, eclipsando un período crucial en el que la intervención puede ser particularmente exitosa para mejorar algunas de las deficiencias sociales y comunicativas observadas en el TEA.
En respuesta a la gran necesidad de indicadores tempranos sensibles (capaces de identificar casos sutiles) y específicos (capaces de distinguir el autismo de otros trastornos) indicadores tempranos de TEA, como biomarcadores, muchos grupos de investigación de todo el mundo han estado estudiando patrones de desarrollo infantil utilizando prospectivos longitudinales estudios de hermanos lactantes de niños con TEA y un grupo de comparación de hermanos infantiles sin riesgos familiares. Dichos diseños recopilan información longitudinal sobre trayectorias de desarrollo a lo largo de los tres primeros años de vida para ambos grupos, seguido del diagnóstico clínico aproximadamente a los 36 meses.

Estos estudios son problemáticos ya que muchas de las características sociales del autismo no emergen en el desarrollo típico hasta después de los 12 meses de edad, y no es seguro que estos síntomas se manifiesten durante los limitados períodos de observación involucrados en las evaluaciones clínicas o en los consultorios de los pediatras. Además, a través del desarrollo, pero especialmente durante la infancia, el comportamiento es ampliamente variable y a menudo poco confiable, y en la actualidad, la observación conductual es el único medio para detectar síntomas de TEA y confirmar un diagnóstico. Esto es bastante problemático porque, incluso los métodos de comportamiento altamente sofisticados, como el seguimiento ocular (ver Figura 1), no necesariamente revelan diferencias confiables en bebés con TEA (Ozonoff et al., 2010). Sin embargo, medir la actividad cerebral asociada a la percepción social puede detectar diferencias que no aparecen en el comportamiento hasta mucho más tarde. La identificación de biomarcadores utilizando los métodos de imagen que hemos descrito ofrece una promesa para una detección temprana del desarrollo social atípico.
Las medidas ERP de la respuesta cerebral predicen el desarrollo posterior del autismo en lactantes de tan solo seis meses de edad que mostraron patrones normales de fijación visual (medidos por seguimiento ocular) (Elsabbagh et al., 2012). Esto sugiere la gran promesa de las imágenes cerebrales para un reconocimiento más temprano del TEA. Con una detección más temprana, los tratamientos podrían pasar de abordar los síntomas existentes a prevenir su aparición alterando el curso del desarrollo anormal del cerebro y dirigiéndolo hacia la normalidad.
Esperanza de mejores resultados
La investigación de imágenes cerebrales descrita anteriormente ofrece esperanza para el futuro del tratamiento del TEA. Muchas de las funciones del cerebro social demuestran una plasticidad significativa, lo que significa que su funcionamiento puede verse afectado por la experiencia a lo largo del tiempo. En contraste con las teorías que sugieren dificultad para procesar información compleja o comunicarse a través de grandes extensiones de corteza (Minshew & Williams, 2007), esta maleabilidad del cerebro social es un pronóstico positivo para el desarrollo del tratamiento. Los cerebros de las personas con TEA no están conectados para procesar de manera óptima la información social. Pero esto no quiere decir que estos sistemas estén irremediablemente rotos. Dada la plasticidad observada del cerebro social, la remediación de estas dificultades puede ser posible con una intervención adecuada y oportuna.
Recursos Externos
- Web: Sitio web de la Asociación Americana de Psiquiatría para la 5ta edición del Manual Diagnóstico y Estadístico de Trastornos Mentales
- http://www.dsm5.org
- Web: Fundación para la Ciencia del Autismo - organización que apoya la investigación del autismo proporcionando financiamiento y otra asistencia a científicos y organizaciones que realizan, facilitan, divulgan y difunden investigaciones sobre el autismo. La organización también brinda información sobre el autismo al público en general y sirve para aumentar la conciencia sobre los trastornos del espectro autista y las necesidades de las personas y familias afectadas por el autismo.
- http://www.autismsciencefoundation.org/
- Web: Autism Speaks - Autism science and advocacy organization
- http://www.autismspeaks.org/
Preguntas de Discusión
- ¿Cómo puede la neuroimagen informar nuestra comprensión de las causas del autismo?
- ¿Cuáles son las formas en que la neuroimagen, incluyendo fMRI y ERP, pueden beneficiar los esfuerzos para diagnosticar y tratar el autismo?
- ¿Cómo puede una comprensión del cerebro social ayudarnos a entender el TEA?
- ¿Cuáles son los síntomas centrales del TEA y por qué el cerebro social es de particular interés?
- ¿Cuáles son algunos de los componentes del cerebro social y a qué funciones sirven?
El vocabulario
- Endofenotipos
- Una característica que refleja una responsabilidad genética por enfermedad y un componente más básico de una presentación clínica compleja. Los endofenotipos son menos maleables para el desarrollo que el comportamiento manifiesto.
- Potenciales relacionados con eventos (ERP)
- Mide el disparo de grupos de neuronas en la corteza. A medida que una persona ve o escucha tipos específicos de información, la actividad neuronal crea pequeñas corrientes eléctricas que se pueden registrar a partir de sensores no invasivos colocados en el cuero cabelludo. ERP proporciona excelente información sobre el momento del procesamiento, aclarando la actividad cerebral al ritmo de milisegundos al que se desarrolla.
- Resonancia magnética funcional (fMRI)
- Implica el uso de potentes imanes para medir los niveles de oxígeno dentro del cerebro que varían con los cambios en la actividad neuronal. Es decir, como las neuronas en regiones específicas del cerebro “trabajan más duro” a la hora de realizar una tarea específica, requieren más oxígeno. Al hacer que las personas escuchen o vean percepciones sociales en un escáner de resonancia magnética, la fMRI especifica las regiones cerebrales que evidencian un aumento relativo en el flujo sanguíneo. De esta manera, la fMRI proporciona una excelente información espacial, señalando con precisión milimétrica, las regiones cerebrales más críticas para diferentes procesos sociales.
- Cerebro social
- El conjunto de estructuras neuroanatómicas que nos permite entender las acciones e intenciones de otras personas.
Referencias
- Allison, T., Puce, A., & McCarthy, G. (2000). Percepción social a partir de señales visuales: Papel de la región STS. Tendencias en Ciencia Cognitiva, 4 (7), 267—278.
- Bentin, S., Allison, T., Puce, A., Pérez, E., et al. (1996). Estudios electrofisiológicos de la percepción facial en humanos. Revista de Neurociencia Cognitiva, 8 (6), 551—565.
- Hermanos, L. (1990). El cerebro social: Un proyecto para integrar el comportamiento de los primates y la neurofisiología en un nuevo dominio. Conceptos en Neurociencia, 1, 27—51.
- Dawson, G., Meltzoff, A. N., Osterling, J., Rinaldi, J., & Brown, E. (1998). Los niños con autismo no logran orientarse a estímulos sociales naturales. Revista de autismo y trastornos del desarrollo, 28 (6), 479—485.
- Dawson, G., Webb, S. J., & McPartland, J. (2005). Comprender la naturaleza del deterioro del procesamiento facial en el autismo: Perspectivas de estudios conductuales y electrofisiológicos. Neuropsicología del desarrollo, 27 (3), 403—424.
- Elsabbagh, M., Mercure, E., Hudry, K., Chandler, S., Pasco, G., Charman, T., et al. (2012). La sensibilidad neuronal infantil a la mirada dinámica del ojo se asocia con autismo emergente posterior. Biología Actual, 22 (4), 338—342.
- Geschwind, D. H., & Levitt, P. (2007). Trastornos del espectro autista: Síndromes de desconexión del desarrollo. Dictamen Actual en Neurobiología, 17 (1), 103—111.
- Goren, C. C., Sarty, M., & Wu, P. Y. (1975). Acompañamiento visual y discriminación de patrones de estímulos faciales por recién nacidos. Pediatría, 56 (4), 544—549.
- Gottesman I. I., & Shields, J. (1973) Teorización genética y esquizofrenia. Revista Británica de Psiquiatría, 122, 15—30.
- Hobson, R. (1986). La valoración del niño autista de las expresiones de emoción. Revista de Psicología y Psiquiatría Infantil, 27 (3), 321—342.
- Johnson, M. H. (2006). Movimiento biológico: ¿Un detector de vida perceptual? Biología Actual, 16 (10), R376—377.
- Kaiser, M. D., Hudac, C. M., Shultz, S., Lee, S. M., Cheung, C., Berken, A. M., et al. (2010). Signos neuronales del autismo. Actas de la Academia Nacional de Ciencias de los Estados Unidos de América, 107 (49), 21223—21228.
- Kanner, L. (1943). Alteraciones autistas del contacto afectivo. Niño Nervioso, 2, 217—250.
- Klin, A., Lin, D. J., Gorrindo, P., Ramsay, G., & Jones, W. (2009). Los niños de dos años con autismo se orientan a contingencias no sociales más que al movimiento biológico. Naturaleza, 459 (7244), 257—261.
- Maestro, S., Muratori, F., Cavallaro, M. C., Pei, F., Stern, D., Golse, B., et al. (2002). Habilidades atencionales durante los primeros 6 meses de edad en el trastorno del espectro autista. Revista de la Academia Americana de Psiquiatría Infantil y Adolescente, 41 (10), 1239—1245.
- McCleery, J. P., Akshoomoff, N., Dobkins, K. R., & Carver, L. J. (2009). Procesamiento atípico de cara versus objeto y asimetrías hemisféricas en lactantes de 10 meses con riesgo de autismo. Psiquiatría Biológica, 66 (10), 950—957.
- McPartland, J. C., Dawson, G., Webb, S. J., Panagiotides, H., & Carver, L. J. (2004). Los potenciales cerebrales relacionados con eventos revelan anomalías en el procesamiento temporal de rostros en el trastorno del espectro autista. Revista de Psicología y Psiquiatría Infantil, 45 (7), 1235—1245.
- McPartland, J. C., Webb, S. J., Keehn, B., & Dawson, G. (2011). Patrones de atención visual a rostros y objetos en el trastorno del espectro autista. Revista de autismo y trastornos del desarrollo, 41 (2), 148—157.
- Minshew, N. J., & Williams, D. L. (2007). La nueva neurobiología del autismo: Cortex, conectividad y organización neuronal. Archivos de Neurología, 64 (7), 945—950.
- Osterling, J., & Dawson, G. (1994). Reconocimiento temprano de niños con autismo: Un estudio de cintas de video caseras de primer cumpleaños. Revista de Autismo y Trastornos del Desarrollo, 24, 247-257.
- Osterling, J. A., Dawson, G., & Munson, J. A. (2002). Reconocimiento precoz de lactantes de 1 año con trastorno del espectro autista versus retraso mental. Desarrollo y Psicopatología, 14 (2), 239—251.
- Ozonoff, S., Iosif, A. M., Baguio, F., Cook, I. C., Hill, M. M., Hutman, T., et al. (2010). Estudio prospectivo de la aparición de signos conductuales tempranos del autismo. Revista de la Academia Americana de Psiquiatría Infantil y Adolescente, 49 (3), 256—266.
- Pelphrey, K. A., Sasson, N. J., Reznick, J. S., Paul, G., Goldman, B. D., & Piven, J. (2002). Escaneo visual de rostros en autismo. Revista de autismo y trastornos del desarrollo, 32 (4), 249—261.
- Schultz, R. T., Gauthier, I., Klin, A., Fulbright, R. K., Anderson, A. W., Volkmar, F., et al. (2000). Actividad cortical temporal ventral anormal durante la discriminación facial en individuos con autismo y síndrome de Asperger. Archivos de Psiquiatría General, 57 (4), 331—340.
- Simion, F., Regolin, L., & Bulf, H. (2008). Una predisposición al movimiento biológico en el recién nacido. Actas de la Academia Nacional de Ciencias, 105 (2), 809—813.
- de Haan, M., Johnson, M. H., & Halit, H. (2003). Desarrollo de potenciales relacionados con eventos sensibles a la cara durante la infancia: Una revisión. Revista Internacional de Psicofisiología, 51 (1), 45—58.