28.2: Aplicaciones de la Mecánica Cuántica
- Page ID
- 128196
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
objetivos de aprendizaje
- Comparar mecanismos de emisión lumínica de fluorescencia y fosforescencia
Fluorescencia y Fosforescencia
La fluorescencia es la emisión de luz por una sustancia que ha absorbido luz u otra radiación electromagnética. Es una forma de fotoluminiscencia. En la mayoría de los casos, la luz emitida tiene una longitud de onda más larga, y por lo tanto menor energía, que la radiación absorbida. Sin embargo, cuando la radiación electromagnética absorbida es intensa, es posible que un electrón absorba dos fotones; esta absorción de dos fotones puede conducir a la emisión de radiación que tiene una longitud de onda más corta que la radiación absorbida. “La radiación emitida también puede ser de la misma longitud de onda que la radiación absorbida, denominada “" fluorescencia de resonancia "”.”
La fluorescencia ocurre cuando un electrón orbital de una molécula o átomo se relaja a su estado fundamental al emitir un fotón de luz después de ser excitado a un estado cuántico superior por algún tipo de energía. Los ejemplos más llamativos de fluorescencia ocurren cuando la radiación absorbida se encuentra en la región ultravioleta del espectro, y por lo tanto invisible para el ojo humano, y la luz emitida está en la región visible.

Fluorescencia: Los minerales fluorescentes emiten luz visible cuando se exponen a la luz ultravioleta
La fosforescencia es un tipo específico de fotoluminiscencia relacionada con la fluorescencia. A diferencia de la fluorescencia, un material fosforescente no vuelve a emitir inmediatamente la radiación que absorbe. La excitación de los electrones a un estado superior se acompaña del cambio de un estado de espín. Una vez en un estado de espín diferente, los electrones no pueden relajarse en el estado fundamental rápidamente porque la reemisión implica transiciones de estado de energía cuántica mecánicamente prohibidas. Como estas transiciones ocurren muy lentamente en ciertos materiales, la radiación absorbida puede ser reemitida a una intensidad menor hasta varias horas después de la excitación original.

Fluorescencia y Fosforescencia: Esquema energético utilizado para explicar la diferencia entre fluorescencia y fosforescencia
Ejemplos comúnmente vistos de materiales fosforescentes son los juguetes que brillan en la oscuridad, la pintura y las esferas del reloj que brillan durante algún tiempo después de ser cargadas con una luz brillante como en cualquier lectura normal o luz de la habitación. Por lo general, el resplandeciente luego se desvanece lentamente en cuestión de minutos (o hasta unas pocas horas) en una habitación oscura.

Fosforescencia: Material fosforescente que brilla en la oscuridad.
Láseres
Un láser es un dispositivo que emite luz monocromática a través de un proceso de amplificación óptica basado en la emisión estimulada de fotones.
objetivos de aprendizaje
- Identificar proceso que genera emisión láser y las características definitorias de la luz láser
Un láser es un dispositivo que emite luz monocromática (radiación electromagnética). Lo hace a través de un proceso de amplificación óptica basado en la emisión estimulada de fotones. El término “láser” se originó como acrónimo de Amplificación de Luz por Emisión Estimulada de Radiación. El láser es distinto de otras fuentes de luz por su alto grado de coherencia espacial y temporal, lo que significa que el láser emite un haz estrecho que mantiene su relación temporal-fase.
Los principios del funcionamiento del láser se basan en gran medida en la mecánica cuántica. (Una excepción serían los láseres de electrones libres, cuyo funcionamiento puede explicarse únicamente por la electrodinámica clásica.) Cuando un electrón se excita de un nivel de menor energía a un nivel de energía más alto, no se quedará así para siempre. Un electrón en estado excitado puede descomponerse a un estado desocupado de menor energía de acuerdo con una constante de tiempo particular que caracteriza esa transición. Cuando dicho electrón decae sin influencia externa, emite un fotón; este proceso se llama “emisión espontánea” La fase asociada con el fotón emitido es aleatoria. Un material con muchos átomos en estado excitado puede resultar así en una radiación que es muy monocromática, pero los fotones individuales no tendrían una relación de fase común y emanarían en direcciones aleatorias. Este es el mecanismo de fluorescencia y emisión térmica.
Sin embargo, un fotón externo a una frecuencia asociada con la transición atómica puede afectar el estado mecánico cuántico del átomo. A medida que pasa el fotón incidente, la tasa de transiciones del átomo excitado se puede mejorar significativamente más allá de eso debido a la emisión espontánea. Este proceso de decaimiento “inducido” se llama emisión estimulada. En la emisión estimulada, el átomo en descomposición produce una “copia” idéntica del fotón entrante. Por lo tanto, después de que el átomo decae, tenemos dos fotones salientes idénticos. Como solo había un fotón entrante, ¡amplificamos la intensidad de la luz en un factor de 2!

Emisión de fotones estimulados: En el proceso de emisión estimulada, un fotón (con una frecuencia igual a la transición atómica) se encuentra con un átomo excitado, y se produce un nuevo fotón idéntico al fotón entrante. El resultado es un átomo en estado fundamental con dos fotones salientes.
Holografía
La holografía es una técnica óptica que permite realizar imágenes tridimensionales.
objetivos de aprendizaje
- Explicar cómo se graban las imágenes holográficas y sus propiedades
La holografía es una técnica que permite realizar imágenes tridimensionales. Implica el uso de un láser, interferencia, difracción, grabación de intensidad de luz e iluminación adecuada de la grabación. La imagen cambia a medida que cambia la posición y orientación del sistema de visualización exactamente de la misma manera que si el objeto estuviera todavía presente, haciendo que la imagen parezca tridimensional.
Láser: Los hologramas se graban utilizando un destello de luz que ilumina una escena y luego imprime en un medio de grabación, mucho en la forma en que se graba una fotografía. Además, sin embargo, parte del haz de luz debe brillarse directamente sobre el medio de grabación; este segundo haz de luz se conoce como haz de referencia (]). Un holograma requiere un láser como única fuente de luz. Se requiere láser como fuente de luz para producir un patrón de interferencia en la placa de grabación. Para evitar que la luz externa interfiera, los hologramas generalmente se toman en la oscuridad, o en luz de bajo nivel de un color diferente de la luz láser utilizada en la fabricación del holograma. La holografía requiere un tiempo de exposición específico, que se puede controlar usando un obturador, o sincronizando electrónicamente el láser

Grabación de un holograma: Los hologramas se graban utilizando un destello de luz que ilumina una escena y luego imprime en un medio de grabación, mucho en la forma en que se graba una fotografía. Además, sin embargo, parte del haz de luz debe brillarse directamente sobre el medio de grabación; este segundo haz de luz se conoce como haz de referencia.
Aparato: Se puede hacer un holograma haciendo brillar parte del haz de luz directamente sobre el soporte de grabación, y la otra parte sobre el objeto de tal manera que parte de la luz dispersada caiga sobre el soporte de grabación. Una disposición más flexible para grabar un holograma requiere que el rayo láser sea dirigido a través de una serie de elementos que lo cambian de diferentes maneras. El primer elemento es un divisor de haz que divide el haz en dos haces idénticos, cada uno dirigido en diferentes direcciones:
- Un haz (conocido como haz de iluminación o de objeto) se propaga usando lentes y se dirige a la escena usando espejos. Parte de la luz dispersada (reflejada) de la escena luego cae sobre el medio de grabación.
- El segundo haz (conocido como haz de referencia) también se propaga mediante el uso de lentes, pero se dirige para que no entre en contacto con la escena, y en su lugar viaja directamente al soporte de grabación.

Reconstruir un holograma: Un patrón de interferencia puede considerarse una versión codificada de una escena, requiriendo una clave particular, la fuente de luz original, para poder visualizar su contenido. Esta llave faltante se proporciona posteriormente al hacer brillar un láser, idéntico al utilizado para grabar el holograma, sobre la película desarrollada. Cuando este haz ilumina el holograma, es difractado por el patrón de superficie del holograma. Esto produce un campo de luz idéntico al producido originalmente por la escena y dispersado en el holograma
Se pueden utilizar varios materiales diferentes como medio de grabación. Una de las más comunes es una película muy similar a la película fotográfica (emulsión fotográfica de haluro de plata), pero con una concentración mucho mayor de granos reactivos a la luz, haciéndola capaz de la resolución mucho mayor que requieren los hologramas. Una capa de este medio de grabación (por ejemplo, haluro de plata) se une a un sustrato transparente, que comúnmente es vidrio, pero también puede ser plástico.
Proceso: Cuando los dos rayos láser alcanzan el medio de grabación, sus ondas de luz se cruzan e interfieren entre sí. Es este patrón de interferencia el que se imprime en el medio de grabación. El patrón en sí es aparentemente aleatorio, ya que representa la forma en que la luz de la escena interfirió con la fuente de luz original, pero no con la fuente de luz original en sí misma. El patrón de interferencia puede considerarse una versión codificada de la escena, requiriendo una clave particular —la fuente de luz original— para poder visualizar su contenido.
Esta llave faltante se proporciona posteriormente al hacer brillar un láser, idéntico al utilizado para grabar el holograma, sobre la película desarrollada. Cuando este haz ilumina el holograma, es difractado por el patrón de superficie del holograma. Esto produce un campo de luz idéntico al producido originalmente por la escena y dispersado sobre el holograma. La imagen que este efecto produce en la retina de una persona se conoce como imagen virtual.
La Tabla Periódica de los Elementos
Una tabla periódica es una presentación tabular de elementos organizados por sus números atómicos, configuraciones electrónicas y propiedades químicas.
objetivos de aprendizaje
- Explicar cómo las propiedades de los elementos varían dentro de los grupos y entre períodos en la tabla periódica
La tabla periódica es una presentación tabular de los elementos químicos. Los elementos se organizan en función de sus números atómicos, configuraciones de electrones y propiedades químicas recurrentes.
En la tabla periódica, los elementos se presentan en orden de aumento del número atómico (el número de protones). Las filas de la tabla se denominan periodos; las columnas de los s- (columnas 1-2 y He), d- (columnas 3-12) y p-bloques (columnas 13-18, excepto He) se denominan grupos. (La terminología de los bloques s-, p- y d- se origina a partir de los orbitales atómicos de valencia que ocupan los electrones del elemento) Algunos grupos tienen nombres específicos, como los halógenos o los gases nobles. Dado que, por definición, una tabla periódica incorpora tendencias recurrentes, cualquier tabla de este tipo puede usarse para derivar relaciones entre las propiedades de los elementos y predecir las propiedades de elementos nuevos, aún por descubrir o sintetizados. Como resultado, la tabla periódica proporciona un marco útil para analizar el comportamiento químico, y tales tablas son ampliamente utilizadas en química y otras ciencias.

Bloques en la Tabla Periódica: Un diagrama de la tabla periódica, destacando los diferentes bloques
Historia de la Tabla Periódica
Si bien existen precursores, a Dmitri Mendeleev generalmente se le atribuye la publicación, en 1869, de la primera tabla periódica ampliamente reconocida. Mendeleev diseñó la tabla de tal manera que se pudieran mostrar tendencias recurrentes (“periódicas”) en las propiedades de los elementos. Usando las tendencias que observó, incluso dejó huecos para aquellos elementos que pensó que estaban “faltados” Incluso predijo las propiedades que pensaba que tendrían los elementos faltantes cuando fueran descubiertos. Muchos de estos elementos fueron efectivamente descubiertos más tarde, y se demostró que las predicciones de Mendeleev eran correctas.
Grupos
Grupo, o familia, es una columna vertical en la tabla periódica. Los grupos suelen tener tendencias periódicas más significativas que los periodos y bloques, las cuales se explican a continuación. Las teorías mecánicas cuánticas modernas de la estructura atómica explican las tendencias grupales al proponer que los elementos del mismo grupo generalmente tienen las mismas configuraciones de electrones en su caparazón de valencia (o más externo, parcialmente relleno). En consecuencia, los elementos del mismo grupo tienden a tener química compartida y exhiben una clara tendencia en las propiedades con un número atómico creciente. Sin embargo, en algunas partes de la tabla periódica, como el bloque d y el bloque f, las similitudes horizontales pueden ser tan importantes como, o más pronunciadas que, las similitudes verticales.
Períodos
Un punto es una fila horizontal en la tabla periódica. Si bien los grupos generalmente tienen tendencias periódicas más significativas, hay regiones donde las tendencias horizontales son más significativas que las tendencias grupales verticales, como en el bloque f, donde los lantánidos y actínidos forman dos series horizontales sustanciales de elementos. Los elementos del mismo periodo muestran tendencias en radio atómico, energía de ionización y afinidad electrónica. El radio atómico generalmente disminuye de izquierda a derecha a lo largo de un período. Esto ocurre porque cada elemento sucesivo tiene un protón y un electrón añadidos, lo que hace que el electrón se acerque más al núcleo, disminuyendo el radio.
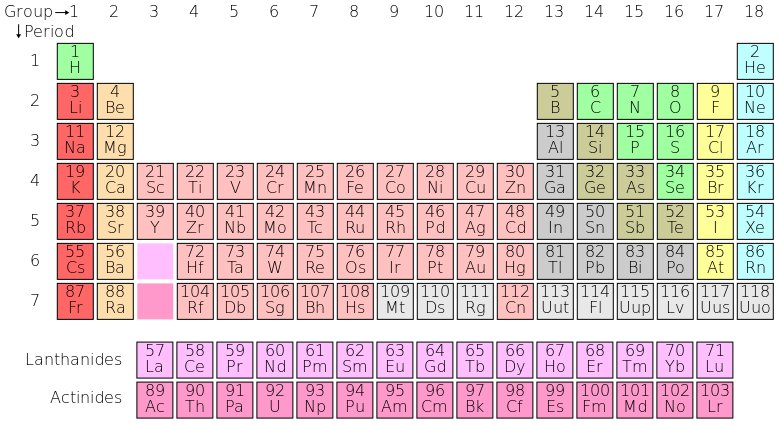
La tabla periódica: Aquí está la tabla periódica completa con números atómicos, grupos y periodos. Cada entrada de la tabla periódica representa un elemento, y los compuestos están formados por varios de estos elementos.
Rayos X
Los rayos X son una forma de radiación electromagnética y tienen longitudes de onda en el rango de 0.01 a 10 nanómetros.
objetivos de aprendizaje
- Describir las propiedades de los rayos X y cómo se pueden generar
La radiación X (compuesta por rayos X) es una forma de radiación electromagnética. Los rayos X tienen longitudes de onda en el rango de 0.01 a 10 nanómetros, lo que corresponde a frecuencias en el rango de 30 petahercios a 30 exahercios (3·10 16 Hz a 3·10 19 Hz) y energías en el rango de 100 eV a 100 keV.
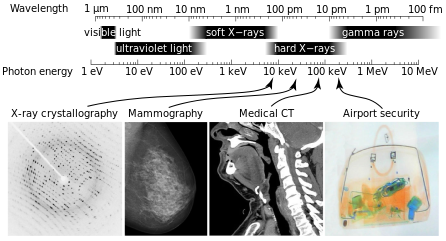
Espectro de rayos X y aplicaciones: Los rayos X forman parte del espectro electromagnético, con longitudes de onda más cortas que las de la luz visible. Diferentes aplicaciones utilizan diferentes partes del espectro de rayos X.
Los rayos X pueden ser generados por un tubo de rayos X, un tubo de vacío que utiliza alto voltaje para acelerar los electrones liberados por un cátodo caliente a una alta velocidad. Los electrones de alta velocidad chocan con un objetivo metálico, el ánodo, creando los rayos X. La energía máxima del fotón de rayos X producido está limitada por la energía del electrón incidente, que es igual al voltaje en el tubo por la carga de electrones, por lo que un tubo de 80 kV no puede crear rayos X con una energía mayor a 80 keV. Cuando los electrones golpean el objetivo, los rayos X se crean a través de dos procesos atómicos diferentes:
- Fluorescencia de rayos X, si el electrón tiene suficiente energía para que pueda sacar a un electrón orbital de la capa interna de electrones de un átomo de metal. Como resultado, los electrones de mayores niveles de energía llenan la vacante, y se emiten fotones de rayos X. Este proceso produce un espectro de emisión de rayos X a unas frecuencias discretas, algunas veces denominadas líneas espectrales. Las líneas espectrales generadas dependen del elemento objetivo (ánodo) utilizado y por lo tanto se denominan líneas características. Por lo general, estas son transiciones desde los caparazones superiores hacia el shell K (llamadas líneas K), o el shell L (llamadas líneas L), y así sucesivamente.
- Bremsstrahlung, que significa literalmente radiación de frenado. Bremsstrahlung es radiación emitida por los electrones ya que son dispersados por el fuerte campo eléctrico cerca de los núcleos de Z alto (número de protones). Estas radiografías tienen un espectro continuo. La intensidad de los rayos X aumenta linealmente con la frecuencia decreciente, desde cero a la energía de los electrones incidentes, el voltaje en el tubo de rayos X.
Ambos procesos de producción de rayos X son ineficientes, con una eficiencia de producción de sólo alrededor del uno por ciento. Por lo tanto, para producir un flujo utilizable de rayos X, la mayor parte de la energía eléctrica consumida por el tubo se libera como desperdicio de calor. El tubo de rayos X debe estar diseñado para disipar este exceso de calor.
Una fuente especializada de rayos X que se está volviendo ampliamente utilizada en la investigación es la radiación sincrotrón, la cual es generada por aceleradores de partículas. Sus características únicas son salidas de rayos X muchos órdenes de magnitud mayores que las de los tubos de rayos X, amplios espectros de rayos X, excelente colimación y polarización lineal.
Vista cuántico-mecánica de átomos
El átomo es una unidad básica de materia que consiste en un núcleo rodeado por una nube de electrones cargada negativamente, comúnmente llamados orbitales atómicos.
objetivos de aprendizaje
- Identificar las principales contribuciones a la comprensión de la estructura atómica realizadas por Niels Bohr, Erwin Schrödinger y Werner Heisenberg
El átomo es una unidad básica de materia que consiste en un núcleo rodeado de electrones cargados negativamente. El núcleo atómico contiene una mezcla de protones cargados positivamente y neutrones eléctricamente neutros. Los electrones de un átomo están unidos al núcleo por la fuerza electromagnética (Coulomb). Los átomos son objetos minúsculos con diámetros de algunas décimas de nanómetro y pequeñas masas proporcionales al volumen implícito en estas dimensiones. Los átomos en estados sólidos (o, para ser precisos, sus nubes de electrones) se pueden observar individualmente usando instrumentos especiales como el microscopio de túnel de barrido.
El hidrógeno-1 (un protón + un electrón) es la forma más simple de átomos, y no es sorprendente que nuestra comprensión mecánica cuántica de los átomos evolucionó con la comprensión de esta especie. En 1913, el físico Niels Bohr sugirió que los electrones estaban confinados en órbitas claramente definidas y cuantificadas, y podían saltar entre éstas, pero no podían circular libremente hacia adentro o hacia afuera en estados intermedios. Un electrón debe absorber o emitir cantidades específicas de energía para la transición entre estas órbitas fijas. El modelo de Bohr explicó muy bien los datos espectroscópicos de hidrógeno, pero adoptó un enfoque semiclásico donde el electrón todavía se consideraba una partícula (clásica).
Adoptando la propuesta de Louis de Broglie sobre la dualidad onda-partícula, Erwin Schrödinger, en 1926, desarrolló un modelo matemático del átomo que describía a los electrones como formas de onda tridimensionales en lugar de partículas puntuales. Una consecuencia del uso de formas de onda para describir partículas es que es matemáticamente imposible obtener valores precisos tanto para la posición como para el momento de una partícula al mismo tiempo; esto se conoció como el principio de incertidumbre, formulado por Werner Heisenberg en 1926. Posteriormente, se descartó el modelo planetario del átomo en favor de uno que describía las zonas orbitales atómicas alrededor del núcleo donde es más probable que se observe un electrón dado.
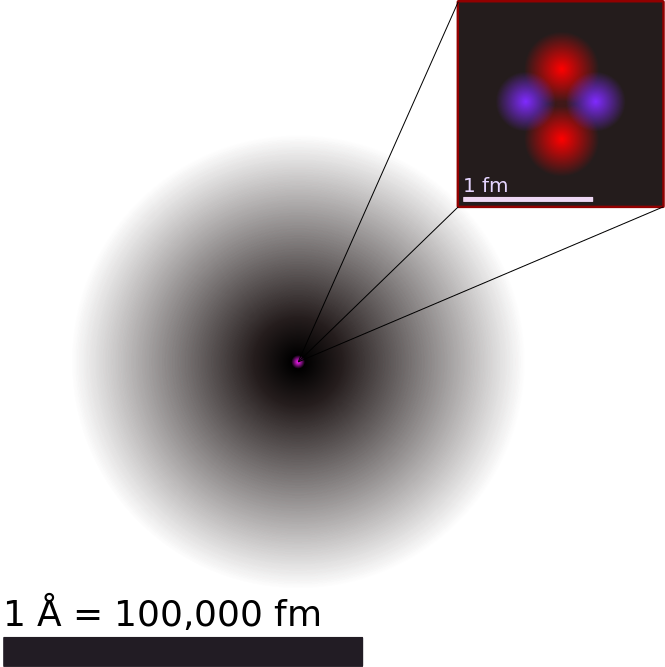
Ilustración del átomo de helio: Esta es una ilustración del átomo de helio, que representa el núcleo (rosa) y la distribución de nubes de electrones (negro). El núcleo (superior derecha) en helio-4 es en realidad esféricamente simétrico y se asemeja mucho a la nube de electrones, aunque para núcleos más complicados no siempre es así. La barra negra es de un angstrom (10-10 m, o 100pm).
La visión mecánica cuántica moderna del hidrógeno ha evolucionado más después de Schrödinger, al tener en cuenta los términos de corrección relativista. La electrodinámica cuántica (QED), una teoría relativista de campos cuánticos que describe la interacción de partículas cargadas eléctricamente, ha pronosticado con éxito correcciones minúsculas en los niveles de energía. Una de las transiciones atómicas del hidrógeno (n=2 a n=1, n: número cuántico principal) se ha medido con una extraordinaria precisión de 1 parte en cien billones. Este tipo de precisión espectroscópica permite a los físicos refinar las teorías cuánticas de los átomos, al dar cuenta de minúsculas discrepancias entre los resultados experimentales y las teorías.
Puntos Clave
- La luz emitida suele tener una longitud de onda más larga, y por lo tanto menor energía, que la radiación absorbida.
- La fluorescencia ocurre cuando un electrón orbital de una molécula o átomo se relaja a su estado fundamental al emitir un fotón de luz después de ser excitado a un estado cuántico superior por algún tipo de energía.
- En una fosforescencia, la excitación de electrones a un estado superior se acompaña con el cambio de un estado de espín. La relajación es un proceso lento ya que implica transiciones de estado energético “prohibidas” en la mecánica cuántica.
- Los principios del funcionamiento del láser se basan en gran medida en la mecánica cuántica, lo que es más importante en el proceso de emisión estimulada de fotones.
- La emisión espontánea es un proceso de descomposición aleatoria. La fase asociada con el fotón emitido también es aleatoria.
- La transición atómica puede ser estimulada por la presencia de un fotón entrante a una frecuencia asociada con la transición atómica. Este proceso conduce a la amplificación óptica ya que se emite un fotón idéntico junto con el fotón entrante.
- Cuando los dos rayos láser alcanzan el medio de grabación, sus ondas de luz se cruzan e interfieren entre sí. Es este patrón de interferencia el que se imprime en el medio de grabación.
- Cuando un haz de reconstrucción ilumina el holograma, es difractado por el patrón de superficie del holograma. Esto produce un campo de luz idéntico al producido originalmente por la escena y dispersado sobre el holograma.
- La imagen holográfica cambia a medida que cambia la posición y orientación del sistema de visualización exactamente de la misma manera que si el objeto estuviera todavía presente, haciendo que la imagen parezca tridimensional.
- Una tabla periódica es un marco útil para analizar el comportamiento químico. Dichas tablas son ampliamente utilizadas en química y otras ciencias.
- Un grupo, o familia, es una columna vertical en la tabla periódica. Los grupos suelen tener tendencias periódicas más significativas que los periodos y bloques.
- Un punto es una fila horizontal en la tabla periódica. Los elementos del mismo periodo muestran tendencias en radio atómico, energía de ionización, afinidad electrónica y electronegatividad.
- Los rayos X pueden ser generados por un tubo de rayos X, un tubo de vacío o un acelerador de partículas.
- La fluorescencia de rayos X y la Bremsstrahlung son procesos a través de los cuales se producen los rayos X.
- La radiación de sincrotrón es generada por aceleradores de partículas. Sus características únicas son salidas de rayos X muchos órdenes de magnitud mayores que las de los tubos de rayos X, amplios espectros de rayos X, excelente colimación y polarización lineal.
- Niels Bohr sugirió que los electrones estaban confinados en órbitas claramente definidas y cuantificadas, y podían saltar entre éstas, pero no podían circular libremente hacia adentro o hacia afuera en estados intermedios.
- Erwin Schrödinger, en 1926, desarrolló un modelo matemático del átomo que describía a los electrones como formas de onda tridimensionales en lugar de partículas puntuales.
- La visión mecánica cuántica moderna del hidrógeno ha evolucionado más después de Schrödinger, al tener en cuenta los términos de corrección relativista. Esto se refiere a una electrodinámica cuántica (QED).
Términos Clave
- spin: Momento angular cuántico asociado con partículas subatómicas; también crea un momento magnético.
- fotón: La cuántica de la luz y otra energía electromagnética, considerada como una partícula discreta que tiene masa de reposo cero, sin carga eléctrica, y una vida útil indefinidamente larga.
- estado fundamental: el estado estacionario de la energía más baja de una partícula o sistema de partículas
- láser de electrones libres: un láser que utiliza un haz de electrones relativista como medio láser, que se mueve libremente a través de una estructura magnética
- monocromático: Describe un haz de luz con una sola longitud de onda (es decir, de un color o frecuencia específicos).
- coherencia: una propiedad ideal de las ondas que permite interferencias estacionarias (es decir, temporales y espacialmente constantes)
- interferencia: Un efecto causado por la superposición de dos sistemas de ondas, como una distorsión en una señal de difusión debido a efectos atmosféricos u otros efectos.
- láser: Un dispositivo que produce un haz de luz monocromático y coherente.
- haluro de plata: Los químicos sensibles a la luz utilizados en películas fotográficas y pape
- orbital atómico: El comportamiento mecánico cuántico de un electrón en un átomo que describe la probabilidad de la posición y energía particulares del electrón.
- afinidad electrónica: la cantidad de energía liberada cuando se agrega un electrón a un átomo o molécula neutra para formar un ion negativo
- energía de ionización: la cantidad de energía requerida para eliminar un electrón de un átomo o molécula en la fase gaseosa
- fotón: La cuántica de la luz y otra energía electromagnética, considerada como una partícula discreta que tiene masa de reposo cero, sin carga eléctrica, y una vida útil indefinidamente larga.
- acelerador de partículas: Un dispositivo que acelera las partículas cargadas eléctricamente a velocidades extremadamente altas, con el propósito de inducir reacciones de alta energía o producir radiación de alta energía.
- dualidad onda-partícula: Una postulación en la que todas las partículas presentan propiedades tanto de onda como de partícula. Es un concepto central de la mecánica cuántica.
- microscopio de túnel de barrido: Un instrumento para obtener imágenes de superficies a nivel atómico.
- Enfoque semiclásico: Una teoría en la que una parte de un sistema se describe cuánto-mecánicamente mientras que la otra se trata clásicamente.
LICENCIAS Y ATRIBUCIONES
CONTENIDO CON LICENCIA CC, COMPARTIDO PREVIAMENTE
- Curación y Revisión. Proporcionado por: Boundless.com. Licencia: CC BY-SA: Atribución-CompartirIgual
CC CONTENIDO LICENCIADO, ATRIBUCIÓN ESPECÍFICA
- estado de tierra. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/ground_state. Licencia: CC BY-SA: Atribución-CompartirIgual
- Fluorescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fluorescence%23Physical_principles. Licencia: CC BY-SA: Atribución-CompartirIgual
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY-SA: Atribución-CompartirIgual
- fotón. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Photon. Licencia: CC BY-SA: Atribución-CompartirIgual
- giro. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/spin. Licencia: CC BY-SA: Atribución-CompartirIgual
- Fluorescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fluorescence%23Physical_principles. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Láser. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Laser%23Tipos_and_Operating_Principles. Licencia: CC BY-SA: Atribución-CompartirIgual
- Láser. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Laser%23Gain_Medium_and_Cavidad. Licencia: CC BY-SA: Atribución-CompartirIgual
- coherencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Coherence. Licencia: CC BY-SA: Atribución-CompartirIgual
- láser de electrones libres. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Free-Electron%20Laser. Licencia: CC BY-SA: Atribución-CompartirIgual
- Sin límites. Proporcionado por: Boundless Learning. Ubicado en: www.boundless.com//physics/73.monocromática. Licencia: CC BY-SA: Atribución-CompartirIgual
- Fluorescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fluorescence%23Physical_principles. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Emisión estimulada. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Emisión estimulada. Licencia: CC BY: Atribución
- Holografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Holografía. Licencia: CC BY-SA: Atribución-CompartirIgual
- láser. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/laser. Licencia: CC BY-SA: Atribución-CompartirIgual
- interferencia. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/interferencia. Licencia: CC BY-SA: Atribución-CompartirIgual
- haluro de plata. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Silver%20haluro. Licencia: CC BY-SA: Atribución-CompartirIgual
- Fluorescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fluorescence%23Physical_principles. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Emisión estimulada. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Emisión estimulada. Licencia: CC BY: Atribución
- Holografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Holografía. Licencia: CC BY: Atribución
- Holografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Holografía. Licencia: CC BY: Atribución
- Proyecto Libre de Textos de Ciencias de Preparatoria, La Tabla Periódica: Grupos y Períodos. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m38760/latest/. Licencia: CC BY: Atribución
- Tabla periódica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Tabla Periódica. Licencia: CC BY-SA: Atribución-CompartirIgual
- afinidad electrónica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Electron%20Affinity. Licencia: CC BY-SA: Atribución-CompartirIgual
- energía de ionización. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/ionization_energy. Licencia: CC BY-SA: Atribución-CompartirIgual
- orbital atómico. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/atomic_orbital. Licencia: CC BY-SA: Atribución-CompartirIgual
- Fluorescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fluorescence%23Physical_principles. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Emisión estimulada. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Emisión estimulada. Licencia: CC BY: Atribución
- Holografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Holografía. Licencia: CC BY: Atribución
- Holografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Holografía. Licencia: CC BY: Atribución
- Tabla periódica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Archivo:Tabla Periódica.svg. Licencia: CC BY: Atribución
- Tabla periódica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Tabla Periódica. Licencia: CC BY: Atribución
- Radiografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/X-Ray. Licencia: CC BY-SA: Atribución-CompartirIgual
- fotón. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Photon. Licencia: CC BY-SA: Atribución-CompartirIgual
- acelerador de partículas. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/particle_accelerator. Licencia: CC BY-SA: Atribución-CompartirIgual
- Fluorescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fluorescence%23Physical_principles. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Emisión estimulada. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Emisión estimulada. Licencia: CC BY: Atribución
- Holografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Holografía. Licencia: CC BY: Atribución
- Holografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Holografía. Licencia: CC BY: Atribución
- Tabla periódica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Archivo:Tabla Periódica.svg. Licencia: CC BY: Atribución
- Tabla periódica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Tabla Periódica. Licencia: CC BY: Atribución
- Radiografías. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/X-rays. Licencia: Dominio Público: No Conocido Derechos de Autor
- Átomo. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Atom. Licencia: CC BY-SA: Atribución-CompartirIgual
- Electrodinámica cuántica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Quantum_Electrodynamics. Licencia: CC BY-SA: Atribución-CompartirIgual
- Theodor W. Hu00e4nsch. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Theodor_W._H%C 3% A4nsch. Licencia: CC BY-SA: Atribución-CompartirIgual
- microscopio de túnel de barrido. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Scanning%20Tunneling%20Microscopio. Licencia: CC BY-SA: Atribución-CompartirIgual
- dualidad onda-partícula. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Wave-Particle%20Dualidad. Licencia: CC BY-SA: Atribución-CompartirIgual
- enfoque semiclásico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Semiclásica%20Acercamiento. Licencia: CC BY-SA: Atribución-CompartirIgual
- Fluorescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fluorescence%23Physical_principles. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Fosforescencia. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Fosforescencia. Licencia: CC BY: Atribución
- Emisión estimulada. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Emisión estimulada. Licencia: CC BY: Atribución
- Holografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Holografía. Licencia: CC BY: Atribución
- Holografía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Holografía. Licencia: CC BY: Atribución
- Tabla periódica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Archivo:Tabla Periódica.svg. Licencia: CC BY: Atribución
- Tabla periódica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Tabla Periódica. Licencia: CC BY: Atribución
- Radiografías. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/X-rays. Licencia: Dominio Público: No Conocido Derechos de Autor
- Átomo. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Atom. Licencia: CC BY: Atribución

