2.1: Energía de la quema de hidrocarburos
- Page ID
- 82988
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Nuestra comprensión del mundo se basa en capas de abstracciones. Considera la idea de un fluido. En la parte inferior de la jerarquía de abstracción se encuentran los actores de la física de partículas: quarks y electrones. Los quarks se combinan para construir protones y neutrones. Los protones, neutrones y electrones se combinan para construir átomos. Los átomos se combinan para construir moléculas. Y grandes colecciones de moléculas actúan, bajo muchas condiciones, como un fluido.

La idea de un fluido es una nueva unidad de pensamiento. Nos ayuda a entender diversos fenómenos, sin que tengamos que calcular o incluso saber cómo interactúan los quarks y los electrones para producir un comportamiento fluido. Como consecuencia, podemos describir el comportamiento del aire y el agua usando las mismas ecuaciones (las ecuaciones Navier-Stokes de la mecánica de fluidos); solo necesitamos usar diferentes valores para la densidad y viscosidad. Entonces los ciclones atmosféricos y los vórtices de agua, aunque resultan de conjuntos muy diferentes de quarks y electrones y sus interacciones, pueden entenderse como el mismo fenómeno.
Una abstracción igualmente poderosa es un enlace químico. Utilizaremos esta abstracción para estimar una cantidad esencial para nuestro cuerpo y para la sociedad moderna: la energía liberada por la quema de cadenas hechas de hidrógeno y átomos de carbono (hidrocarburos). Un hidrocarburo se puede extraer como una cadena de CH 2 unidades:
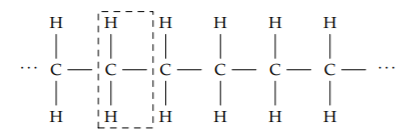
La quema de una unidad CH 2 requiere oxígeno (O 2) y libera dióxido de carbono (CO 2), agua y energía:
\[CH_{2} + \frac{3}{2}O_{2} \rightarrow CO_{2} + H_{2}O + energy\]
Para un hidrocarburo con ocho carbonos, como el octano, un componente principal del combustible del motor, simplemente multiplique esta reacción por 8:
\[(CH_{2})_{8} + 12 O_{2} \rightarrow 8 CO_{2} + 8 H_{2}O + lots \: of \: energy.\]
(No vale la pena preocuparse por los dos hidrógenos adicionales en los extremos izquierdo y derecho del octano).
¿Cuánta energía se libera al quemar una unidad CH 2?
Para hacer esta estimación, utilice la tabla de energías de enlace. Da la energía necesaria para romper (no hacer) un enlace químico, por ejemplo, entre carbono e hidrógeno. Sin embargo, no existe un enlace carbono-hidrógeno (C-H) único. Los enlaces carbono-hidrógeno en etano. Para hacer una idea reutilizable, descuidamos esa diferencia, colocándolas por debajo de nuestra barrera de abstracción, y hacemos una abstracción llamada enlace carbono-hidrógeno. Entonces la mesa, ya en su primera columna, está construida sobre una abstracción.
energía de bonos
| \(\frac{kcal}{mol}\) | \(\frac{kJ}{mol}\) | \(\frac{eV}{bond}\) | |
| C-H | 99 | 414 | 4.3 |
| O-H | 111 | 464 | 4.8 |
| C-C | 83 | 347 | 3.6 |
| C-O | 86 | 360 | 3.7 |
| H-H | 104 | 435 | 4.5 |
| C-N | 73 | 305 | 3.32 |
| N-H | 93 | 389 | 4.0 |
| O=O | 119 | 498 | 5.2 |
| C=O | 192 | 803 | 8.3 |
| C=C | 146 | 611 | 6.3 |
| N=N | 226 | 946 | 9.8 |
El segundo da la energía de enlace en kilocalorías por mol de enlaces. Una kilocaloría es aproximadamente 4000 julios, y un mol es el número de Avogadro (6×1023) de enlaces. La tercera columna da la energía en las unidades SI utilizadas por la mayor parte del mundo, kilojulios por mol. La columna final da la energía en electrón voltios (eV) por enlace. Un electrón voltio es 1.6× 10−19 julios. Un electrón voltio es adecuado para medir energías atómicas, porque la mayoría de las energías de enlace tienen un valor fácil de entender de unos pocos electrón voltios. ¡Ojalá la mayor parte del mundo usara esta unidad!
Tabulemos las energías en la combustión de una unidad hidrocarbonada.

El lado izquierdo de la reacción tiene dos enlaces carbono-hidrógeno, 1.5 dobles enlaces oxígeno-oxígeno y un enlace carbono-carbono (conectando el átomo de carbono en la unidad CH 2 con el átomo de carbono en una unidad vecina). El total, 460 kilocalorías o 1925 kilojulios por mol, es la energía requerida para romper los enlaces. Es un aporte de energía, por lo que reduce la energía neta de combustión.

El lado derecho tiene dos dobles enlaces carbono-oxígeno y dos enlaces oxígeno-hidrógeno. El total para el lado derecho, 606 kilocalorías o 2535 kilojulios por mol, es la energía liberada en la formación de estos enlaces. Es la energía producida, por lo que aumenta la energía neta de combustión.
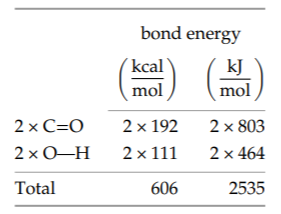
El resultado neto es, por mol de CH 2, una liberación de energía de 606 menos 460 kilocalorías, o aproximadamente 145 kilocalorías (610 kilojulios). Equivalentemente, también es de aproximadamente 6 electrón voltios por unidad de CH 2, aproximadamente 1.5 enlaces químicos de energía. La energía de combustión también es útil como energía por masa en lugar de por mol. Un mol de unidades CH2 pesa 14 gramos. Por lo tanto, 145 kilocalorías por mol es aproximadamente 10 kilocalorías o 40 kilojulios por gramo. Vale la pena memorizar esta densidad energética porque da la energía liberada al quemar petróleo y gasolina o al metabolizar la grasa (aunque la grasa no sea un hidrocarburo puro)

La tabla anterior, adaptada del sitio “Virtual Chemistry” de la Universidad de Oxford, da energías de combustión reales para fuentes de combustible vegetal y animal (con hidrógeno puro incluido para divertirse). La penúltima entrada, el ácido esteárico, es un gran componente de la grasa animal; los animales almacenan energía en una sustancia con una densidad energética comparable a la densidad energética de la gasolina, aproximadamente 10 kilocalorías o 40 kilojulios por gramo. Las plantas, por otro lado, almacenan energía en almidón, que es una cadena de unidades de glucosa; la glucosa tiene una densidad energética de sólo aproximadamente 4 kilocalorías por gramo. También vale la pena memorizar este valor, la densidad energética de los carbohidratos de los alimentos (azúcares y almidones). Es significativamente menor que la densidad energética de las grasas: Comer grasa nos llena mucho más rápido que comer almidón.
¿Cómo podemos explicar las diferentes densidades de almacenamiento de energía vegetal y animal?
Las plantas no necesitan moverse, por lo que el peso extra requerido por el uso de almacenamiento de energía de menor densidad no es tan importante. El beneficio de la vía metabólica más simple de la glucosa supera el inconveniente del peso extra. Para los animales, sin embargo, el gran beneficio de un menor peso supera la complejidad metabólica de quemar grasas.
Ejercicio\(\PageIndex{1}\): Estimating the energy density of common foods
En las escuelas americanas, el almuerzo tradicional es el sándwich de maní, mantequilla y gelatina. Estimar la densidad energética en mantequilla de maní y en gelatina (o mermelada).
Ejercicio\(\PageIndex{2}\): Peanut butter as fuel
Si pudieras convertir toda la energía de combustión en una cucharada (15 gramos) de mantequilla de maní en trabajo mecánico, ¿cuántos tramos de escaleras podrías subir?
Ejercicio\(\PageIndex{3}\): Growth of grass
¿Qué tan rápido crece el pasto? ¿La tasa está limitada por la lluvia o por la luz solar?


