11.5: Los coloides
- Page ID
- 1890
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para desarrollar
- Describir la composición y las propiedades de las dispersiones coloidales.
- Enumerar y explicar varias aplicaciones tecnológicas de los coloides.
De niño, es posible que haya hecho suspensiones como mezclas de lodo y agua, harina y agua, o una suspensión de pigmentos sólidos en el agua, conocida como la pintura al temple. Estas suspensiones son mezclas heterogéneas compuestas de partículas relativamente grandes que son visibles (o que se pueden ver con una lupa). Están turbias y las partículas suspendidas se depositan después de mezclarlas. De otra manera, cuando hacemos una solución, preparamos una mezcla homogénea en la que no se produce sedimentación y en la que las especies disueltas son moléculas o iones. Las soluciones exhiben un comportamiento completamente diferente de las suspensiones. Una solución puede ser de color, pero es transparente, las moléculas o los iones son invisibles y no se asientan. Un grupo de mezclas llamadas los coloides (o las dispersiones coloidales) exhiben propiedades intermedias entre las de las suspensiones y las soluciones (Figura \(\PageIndex{1}\)). Las partículas en un coloide son más grandes que la mayoría de las moléculas simples; sin embargo, las partículas coloidales son lo suficientemente pequeñas como para que no se asienten al parar.

(b) Las partículas en un coloide son lo suficientemente grandes como para dispersar la luz, un fenómeno llamado el efecto Tyndall. Esto puede hacer que las mezclas coloidales parezcan turbias u opacas, como los hacen los reflectores que se muestran en la Figura \(\PageIndex{2}\). Las nubes son mezclas coloidales. Están compuestos de gotas de agua que son mucho más grandes que las moléculas, pero que son lo suficientemente pequeñas como para que no se asienten.

El término "coloide,” de las palabras griegas kolla, que significa "pegamento" y eidos, que significa "como," fue usado por primera vez en 1861 por Thomas Graham para clasificar mezclas como el almidón en el agua y la gelatina. Muchas partículas coloidales son agregados de cientos o miles de moléculas, pero otras (como las proteínas y las moléculas de polímero) consisten en una sola molécula extremadamente grande. Las proteínas y las moléculas de polímero sintético que forman coloides pueden tener masas moleculares que varían de unos pocos miles a muchos millones de unidades de masa atómica.
De manera análoga a la identificación de los componentes de la solución como "soluto" y "solvente", los componentes de un coloide se clasifican igualmente de acuerdo con sus cantidades relativas. El componente particulado típicamente presente en una cantidad relativamente más baja se llama la fase dispersa y la sustancia o la solución a través de la cual se dispersa el particulado se llama el medio de dispersión. Los coloides pueden involucrar prácticamente cualquier combinación de estados físicos (gas en líquido, líquido en sólido, sólido en gas, etc.), como se ilustra en los ejemplos de sistemas coloidales dados en la Tabla \(\PageIndex{1}\).
|
Fase dispersa |
Medio de dispersión | Ejemplos comunes | Nombre |
|---|---|---|---|
|
sólido |
gas | humo, polvo | — |
| sólido | líquido | almidón en el agua, algunas tintas, pinturas, leche de magnesia | sol |
| sólido | sólido | algunas gemas de colores, algunas aleaciones | — |
| líquido | gas | nubes, neblinas, aerosoles | aerosol |
| líquido | liquido | leche, mayonesa, mantequilla | emulsión |
| líquido | sólido |
jaleas, geles, perlas, ópalos (H2O en SiO2) |
gel |
| gas | líquido | espumas, crema batida, claras de huevo batidas | espuma |
| gas | sólido | piedra pómez, jabones flotantes | — |
La preparación de los sistemas coloides
Podemos preparar un sistema coloide produciendo partículas de dimensiones coloides y distribuyendo las a través de un medio de dispersión. Las partículas de un tamaño coloide se forman por dos métodos:
- Métodos de dispersión: es decir, rompiendo partículas mas grandes. Por ejemplo, pigmentos de pintura se producen cuando se dispersan partículas grandes por moliéndolas en molinos especiales.
- Métodos de condensación: es decir, crecimiento de moléculas más pequeñas como las moléculas o los iones. Por ejemplo, las nubes se forman cuando las moléculas del agua se condensan y forman gotas muy pequeñas.
Algunas sustancias sólidas, cuando se ponen en contacto con el agua, se dispersan espontáneamente y forman sistemas coloidales. La gelatina, el pegamento, el almidón y la leche deshidratada en polvo se comportan de esta manera. Las partículas ya son de tamaño coloidal; el agua simplemente los dispersa. Las partículas de leche en polvo de tamaño coloidal se producen por deshidratación de spray de leche. Algunos atomizadores producen dispersiones coloidales de un líquido en el aire.
Podemos preparar una emulsión por agitando juntos o mezclando dos líquidos inmiscibles. Esto rompe un líquido en gotas de tamaño coloidal, que luego se dispersan por el otro líquido. Los derrames de petróleo en el océano pueden ser difíciles de limpiar, en parte porque la acción de las olas puede hacer que el petróleo y el agua formen una emulsión. Sin embargo, en muchas emulsiones, la fase dispersa se tiende a unir, formar grandes gotas y se separara. Por lo tanto, las emulsiones generalmente se estabilizan mediante un agente emulsionante, una sustancia que inhibe la coalescencia del líquido disperso. Por ejemplo, un poco de jabón estabilizará una emulsión de queroseno en el agua. La leche es una emulsión de grasa de mantequilla en el agua, con la proteína caseína como el agente emulsionante. La mayonesa es una emulsión de aceite en vinagre, con componentes de yema de huevo como agentes emulsionantes.
Los métodos de condensación forman partículas coloides a partir de agregación de moléculas o iones. Si las partículas crecen más allá del rango de tamaño de los coloides, gotas o un precipitado se forman, y no hay resultados de sistema de coloide. Las nubes se forman cuando las moléculas de agua se agregan y forman partículas coloidales. Si estas partículas de agua se unen para formar gotas de agua líquida o cristales de agua sólida adecuadamente grandes, se asientan en el cielo como lluvia, aguanieve o nieve. Muchos métodos de condensación implican reacciones químicas. Podemos preparar una suspensión coloidal roja de hidróxido de hierro (III) mezclando una solución concentrada de cloruro de hierro(III) con agua caliente:
\[\mathrm{Fe^{3+}}_{(aq)}+\mathrm{3Cl^-}_{(aq)}+\mathrm{6H_2O}_{(l)}⟶\mathrm{Fe(OH)}_{3(s)}+\mathrm{H_3O^+}_{(aq)}+\mathrm{3Cl^-}_{(aq)} \label{11.6.1}\]
Un sol de oro coloidal resulta de la reducción de una solución muy diluida de cloruro de oro(III) por un agente reductor como el formaldehído, el cloruro de estaño(II) o el sulfato de hierro(II):
\[\ce{Au}^{3+}+ \ce{3e}^− \rightarrow \ce{Au} \label{11.6.2}\]
Algunos soles de oro preparados en 1857 todavía están intactos (las partículas no se han fusionado ni sedimentado), lo que ilustra la estabilidad al plazo largo de muchos coloides.
Los jabones y los detergentes
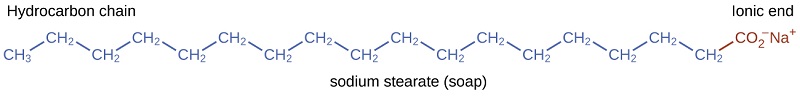
Los pioneros hicieron jabón por hirviendo las grasas con una solución muy básica hecha por lixiviando el carbonato de potasio, \(\ce{K_2CO_3}\), a partir de cenizas de madera con el agua caliente. Las grasas animales contienen poliésteres de ácidos grasos (ácidos carboxílicos de cadena larga). Cuando las grasas animales se tratan con una base como el carbonato de potasio o el hidróxido de sodio, se forman glicerol y sales de ácidos grasos como el ácido palmítico, oleico y esteárico. Las sales de los ácidos grasos se llaman los jabones. La sal de sodio del ácido esteárico, estearato de sodio, tiene la fórmula \(\ce{C_ {17}H_ {35}CO_2Na}\) y contiene una cadena de hidrocarburo no polar no cargada, la \(\mathrm{C_ {17} H_ { 35} -}\), y un grupo carboxilato iónico, la unidad \(-\mathrm{\sideset{}{_{2}^{-}}{CO}}\) (Figura \(\PageIndex{3 }\)).
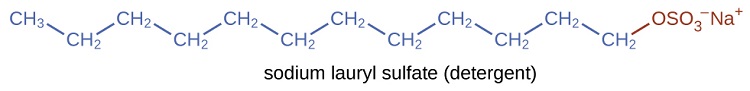
Los detergentes (sustitutos del jabón) también contienen cadenas de hidrocarburos no polares, como \(\mathrm{C_ {12}H_ {25}-} \), y un grupo iónico, como un sulfato \(-\mathrm{\sideset{}{_{3}^{-}}{OSO}}\), o un sulfonato \(-\mathrm{\sideset{}{_{3}^{-}}{SO}}\) (Figura \(\PageIndex{4}\)). Los jabones forman compuestos insolubles de calcio y magnesio en el agua dura; los detergentes forman productos solubles en agua, una ventaja definitiva para los detergentes.
La acción de limpieza de los jabones y los detergentes se puede explicar en términos de las estructuras de las moléculas involucradas. El extremo de hidrocarburo (no polar) de una molécula de jabón o detergente se disuelve o es atraído por sustancias no polares como el aceite, la grasa o las partículas de suciedad. El extremo iónico es atraído por el agua (polar), ilustrado en la Figura \(\PageIndex{5}\). Como resultado, las moléculas de jabón o detergente se orientan en la interfaz entre las partículas de suciedad y el agua, por lo que actúan como una especie de puente entre dos diferentes tipos de materia, no polar y polar. Moléculas como esta se llaman anfifílicas ya que tienen una parte hidrofóbica (“disgusto del agua”) y una parte hidrofílica (“gusto del agua”). Como consecuencia, las partículas de suciedad se suspenden como partículas coloidales y se eliminan fácilmente.

DERRAME DE ACEITE DEl deepwater horizon
La explosión de la plataforma de perforación petrolera de Deepwater Horizon el 20 de abril de 2010, en el Golfo de México, cerca de Mississippi, comenzó el mayor derrame de petróleo marino en la historia del petróleo. En los 87 días posteriores al derrame del petróleo, se estima que fluyeron 4.9 millones de barriles (210 millones de galones) de petróleo desde el pozo roto a 5000 pies debajo de la superficie del agua. El pozo finalmente fue declarado sellado el 19 de septiembre de 2010.
El petróleo crudo es inmiscible y menos denso que el agua, por lo que el petróleo derramado subió a la superficie del agua. Se usaron barreras flotantes, barcos skimmer y quemaduras controladas para eliminar el petróleo de la superficie del agua en un intento de proteger las playas y humedales a lo largo de la costa del Golfo. Además de la eliminación del petróleo, también se hicieron intentos para disminuir su impacto ambiental al hacerlo "soluble" (en el sentido más amplio del término) y permitir que se diluya a niveles menos perjudiciales por el vasto volumen del agua del océano. Este enfoque usó 1.84 millones de galones del dispersante de petróleo Corexit 9527, la mayoría de los cuales se inyectó bajo del agua en el sitio de la fuga, y se rociaron pequeñas cantidades sobre el derrame. Corexit 9527 contiene 2-butoxietanol (C6H14O2), una molécula anfifílica cuyos extremos polares y no polares son útiles para emulsionar el aceite en pequeñas gotas, aumentando el área del superficie del aceite y haciéndolo más accesible a las bacterias marinas para la digestión (Figura \(\PageIndex{6}\)). Mientras que este enfoque evita muchos de los peligros inmediatos que el petróleo a granel representa para los ecosistemas marinos y costeros, presenta la posibilidad de efectos en el futuro como resultado de la introducción de componentes tóxicos complejos y potenciales del petróleo en la cadena alimentaria del océano. Varias organizaciones están involucradas en el monitoreo del impacto extendido de este derrame de petróleo, incluida la Administración Nacional Oceánica y Atmosférica.

Propiedades eléctricas de las partículas coloidales
A veces, las partículas coloidales dispersas están cargadas eléctricamente. Por ejemplo, una partícula coloidal de hidróxido de hierro (III), no contiene suficientes iones de hidróxido para compensar exactamente las cargas positivas en los iones de hierro (III). Por lo tanto, cada partícula coloidal individual tiene una carga positiva, y la dispersión coloidal consiste en partículas coloidales cargadas y algunos iones de hidróxido libres, que mantienen la dispersión eléctricamente neutra. La mayoría de los coloides de hidróxido metálico tienen cargas positivas, mientras que la mayoría de los metales y sulfuros metálicos forman dispersiones negativamente cargadas. Todas las partículas coloidales en cualquier sistema tienen cargas del mismo signo. Esto ayuda a mantenerlos dispersos porque las partículas que contienen cargas similares se repelen entre sí.
Podemos aprovechar de la carga sobre las partículas coloidales para eliminarlas de una variedad de mezclas. Si colocamos una dispersión coloidal en un recipiente con electrodos cargados, las partículas cargadas positivamente, como las partículas de hidróxido de hierro (III), se moverían al electrodo negativo. Allí, las partículas coloidales pierden su carga y se coagulan como un precipitado.
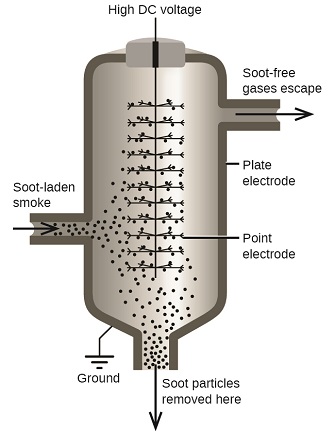
A veces, las partículas de carbón y polvo en el humo están coloidalmente dispersas y cargadas eléctricamente. Las partículas cargadas son atraídas por electrodos altamente cargados, donde se neutralizan y se depositan como uno polvo (Figura \(\PageIndex{7}\). Este es uno de los métodos importantes usados para limpiar el humo de una variedad de procesos industriales. El proceso también es importante en la recuperación de productos valiosos del humo y el polvo de las fundiciones, hornos y hornos. También hay filtros de aire iónicos diseñados para uso doméstico para mejorar la calidad del aire interior.
Gels
Cuando hacemos gelatina, como el Jell-O, estamos haciendo un tipo de coloide (Figura \(\PageIndex{8}\)). La gelatina se enfría porque la mezcla acuosa caliente de gelatina se coagula a medida que se enfría y toda la masa, incluyendo el líquido, se deposita en un cuerpo extremadamente viscoso conocido como un gel, un coloide en el que el medio dispersante es sólido y la fase dispersa es un liquido. Parece que las fibras del medio dispersante forman una red tridimensional compleja, llenando los intersticios con el medio líquido o una solución diluida del medio dispersante. Debido a que la formación de un gel se acompaña de la absorción del agua o algún otro solvente, se dice que el gel está hidratado o solvatado.
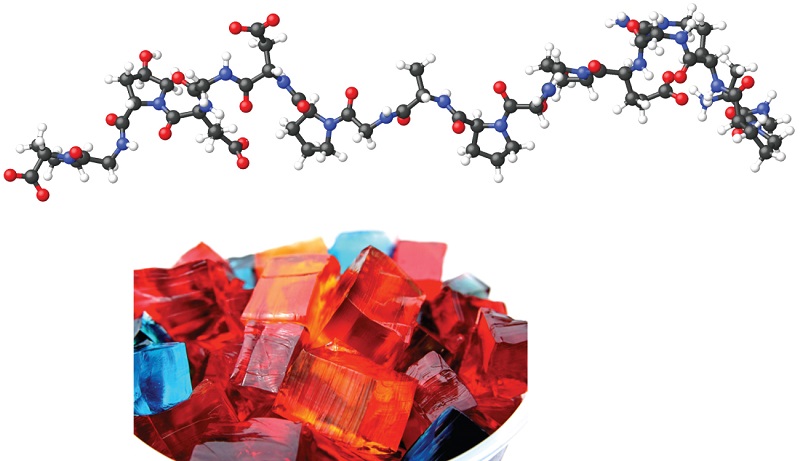
La pectina, un carbohidrato de los jugos de frutas, es una sustancia formadora de gel importante en la fabricación de la gelatina. El gel de sílice, una dispersión coloidal de dióxido de silicio hidratado, se forma cuando se agrega ácido clorhídrico diluido a una solución diluida de silicato de sodio. Canned Heat es un gel hecho cuando se mezcla el alcohol y una solución acuosa saturada de acetato de calcio.
Resumen
Los coloides son mezclas en las que una o más sustancias se dispersan como partículas sólidas relativamente grandes o gotas líquidas en un medio sólido, líquido o gaseoso. Las partículas de un coloide permanecen dispersas y no se depositan debido a la gravedad, y a veces están cargadas eléctricamente. Los coloides son de naturaleza generalizada y están involucrados en muchas aplicaciones tecnológicas.
Glosario
- anfifílico
- moléculas que poseen partes hidrofóbicas (no polares) e hidrofílicas (polares)
- coloide
- (también, dispersión coloidal) mezcla en la que partículas sólidas o líquidas relativamente grandes se dispersan uniformemente a través de un gas, líquido o sólido
- medio de dispersión
- sólido, líquido o gas en el que se dispersan las partículas coloidales
- fase dispersa
- sustancia presente como partículas sólidas o líquidas relativamente grandes en un coloide
- agente emulsionante
- Sustancia anfifílica utilizada para estabilizar las partículas de algunas emulsiones.
- emulsión
- coloide formado a partir de líquidos inmiscibles
- gel
- dispersión coloidal de un líquido en un sólido
- Efecto Tyndall
- dispersión de luz visible por una dispersión coloidal
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


