13.4: El Principio de Le Châtelier
- Page ID
- 1906
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para desarrollar
- Describir las formas en que se puede cambiar el equilibrio de un sistema.
- Predecir la respuesta de un equilibrio modificado usando el principio de Le Chatelier
Como vimos en la sección anterior, las reacciones proceden en ambas direcciones (los reactivos van a los productos y los productos van a los reactivos). Podemos decir que una reacción está en equilibrio si el cociente de la reacción (\(Q\)) es igual al constante de equilibrio (K). A continuación, discutimos lo que sucede cuando se altera un sistema en equilibrio para que \(Q\) ya no sea igual a \(K\). Si un sistema en equilibrio está sujeto a una modificación (como un cambio en la concentración), la posición del equilibrio cambia. Dado que este cambio afecta las concentraciones de los reactivos y los productos, el valor de \(Q\) ya no será igual al valor de \(K\). Para restablecer el equilibrio, el sistema se desplazará hacia los productos (si \(Q<K\)) o los reactivos (si \(Q>K\)) hasta que \(Q\) regrese al mismo valor que \(K\).
El principio de Le Chatelier describe este proceso: cuando se altera un sistema químico en equilibrio, vuelve al equilibrio al contrarrestar el cambio. Como se describe en el párrafo anterior, la modificación causa un cambio en \(Q\); la reacción cambiará para restablecer \(Q=K\).
Predicción de la dirección de una reacción reversible
El principio de Le Chatelier puede ser reversible para predecir cambios en las concentraciones de equilibrio cuando un sistema que está en equilibrio está sometido a un cambio. Sin embargo, si tenemos una mezcla de reactivos y productos que aún no han alcanzado el equilibrio, los cambios necesarios para alcanzar el equilibrio pueden a veces no ser tan obvios. En tal caso, podemos comparar los valores de Q y K para que el sistema prediga los cambios.
Un sistema químico en equilibrio se puede cambiar temporalmente fuera del equilibrio agregando o eliminando uno o más de los reactivos o los productos. Las concentraciones de ambos reactivos y productos luego experimentan cambios adicionales para devolver el sistema al equilibrio.
El cambio en el sistema en la Figura \(\PageIndex{1}\) es la reducción de la concentración de equilibrio de SCN− (disminuyendo la concentración de uno de los reactivos causa que Q sea más grande que K). Como consecuencia, el principio de Le Chatelier nos deja predecir que la concentración de Fe(SCN)2+ debe disminuir, aumentando la concentración de SCN– de regreso a su concentración original, y aumentando la concentración de Fe3+ por encima de su concentración de equilibrio inicial.
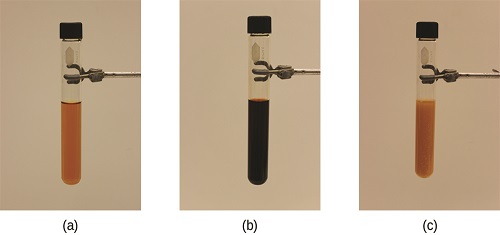
El efecto de un cambio en la concentración en un sistema en equilibrio se ilustra adicionalmente mediante el equilibrio de esta reacción química:
\[\ce{H}_{2(g)}+\ce{I}_{2(g)} \rightleftharpoons \ce{2HI}_{(g)} \label{13.4.1a}\]
\[K_c=\mathrm{50.0 \; at\; 400°C} \label{13.4.1b}\]
Los valores numéricos para este ejemplo se han determinado experimentalmente. Una mezcla de gases a 400 °C con \(\mathrm{[H_2]=[I_2]}=0.221\;M\) y \(\ce{[HI]}=1.563\;M3\) está en equilibrio; para esta mezcla, \(Q_c=K_c=50.0\). Si \(\ce{H_2}\) se introduce en el sistema tan rápido que su concentración se duplica antes de que comience a reaccionar (nuevo \(\ce{[H_2]}=0.442\; M\)), la reacción cambiará para que se alcance un nuevo equilibrio, en el cual
- \(\ce{[H_2]} = 0.374\; M\),
- \(\ce{[I_2]} = 0.153\; M\), y
- \(\ce{[HI]} = 1.692\; M\).
Esto nos da:
\[Q_c=\mathrm{\dfrac{[HI]^2}{[H_2][I_2]}}=\dfrac{(1.692)^2}{(0.374)(0.153)}=50.0=K_c \label{13.4.2}\]
Hemos cambiado el equilibrio de este sistema al introducir \(\ce{H_2}\) adicional. El equilibrio se restablece cuando la reacción se desplaza hacia la derecha, usando algo (pero no todo) del exceso \(\ ce{H_2}\) y reduciendo la cantidad de \(\ce{I_2}\) no combinado y formando adicional \(\ce{HI}\).
Efecto del cambio en presión sobre el equilibrio de una reacción química
A veces podemos cambiar la posición de equilibrio de una reacción si cambiamos la presión de un sistema. Sin embargo, los cambios en la presión tienen un efecto medible solo en los sistemas en los que involucran los gases, y solo cuando la reacción química produce un cambio en el número total de moléculas de gas en el sistema. Una manera fácil de reconocer dicho sistema es buscar diferentes números de moles de gas en los lados de reactivo y producto del equilibrio. Al evaluar la presión (así como factores relacionados como el volumen), es importante recordar que los constantes de equilibrio se definen con respecto a la concentración (para \(K_c\)) o la presión parcial (para \(K_P\)). Algunos cambios en la presión total, como la adición de un gas inerte que no es parte del equilibrio, cambiarán la presión total pero no las presiones parciales de los gases en la expresión constante del equilibrio. Por lo tanto, la adición de un gas no involucrado en el equilibrio no cambiará el equilibrio.
Cuando aumentamos la presión de un sistema gaseoso en equilibrio, ya sea por disminuyendo el volumen del sistema o agregando más de uno de los componentes de la mezcla de equilibrio, introducimos un cambio en la reacción al aumentar las presiones parciales de uno o más de los componentes. De acuerdo con el principio de Le Chatelier, se favorecerá un cambio en el equilibrio que reduzca el número total de moléculas por unidad de volumen porque esto alivia la tensión de la reacción. La reacción inversa sería más favorable por una disminución de la presión.
Considere lo que ocurre cuando se aumenta la presión en un sistema en el cual \(\ce{NO}\), \(\ce{O_2}\), y \(\ce{NO_2}\) están en equilibrio:
\[\ce{2NO (g) + O2(g) \rightleftharpoons 2NO2(g)} \label{13.4.3}\]
La formación de cantidades adicionales de \(\ce{NO2}\) disminuye el número total de moléculas en el sistema porque cada vez que dos moléculas de \(\ce{NO2}\) se forman, un total de tres moléculas de \(\ce{NO}\) y \(\ce{O_2}\) se usan. Esto reduce la presión total ejercida sobre el sistema y reduce, pero no disminuye por completo, la tensión causada por la presión aumentada. Por otro lado, una disminución en la presión del sistema favorece la descomposición de \(\ce{NO_2}\) en \(\ce{NO}\) y \(\ce{O_2}\), lo que tiende a restablecer la presión.
Ahora, considere esta reacción:
\[\ce{N2 (g) + O2 (g) \rightleftharpoons 2NO (g)} \label{13.4.4}\]
Debido a que no hay cambio en el número total de moléculas en el sistema durante la reacción, un cambio en la presión no favorece la formación o la descomposición del monóxido de nitrógeno gaseoso.
Efecto del cambio en temperatura sobre el equilibrio de una reacción química
Cambiar la concentración o la presión altera un equilibrio porque el cociente de la reacción se aleja del valor de equilibrio. Cambiar la temperatura de un sistema en equilibrio tiene un efecto diferente: un cambio en la temperatura en realidad cambia el valor del constante de equilibrio. Sin embargo, podemos predecir cualitativamente el efecto del cambio de temperatura al tratarlo como un estrés en el sistema y al aplicar el principio de Le Chatelier.
Cuando el hidrógeno reacciona con el yodo gaseoso, el calor se genera.
\[\ce{H2(g) + I2(g) \rightleftharpoons 2HI(g) } \;\;\ ΔH=\mathrm{−9.4\;kJ\;(exothermic)} \label{13.4.5}\]
Debido a que esta reacción es exotérmica, podemos escribir el calor como un producto.
\[\ce{H2(g) + I2(g) \rightleftharpoons 2HI(g)} + \text{heat} \label{13.4.6}\]
Aumentar la temperatura de la reacción aumenta la energía interna del sistema. En consecuencia, aumentar la temperatura causa el aumento de la cantidad de uno de los productos de esta reacción. La reacción se desplaza hacia la izquierda para disminuir el estrés, y hay un aumento en la concentración de \(\ce{H2}\) y \(\ce{I2}\) y una reducción en la concentración de \(\ce{HOLA}\). Bajando la temperatura de este sistema reduce la cantidad de energía presente, lo que favorece la producción del calor y favorece la formación del yoduro de hidrógeno.
Cuando cambiamos la temperatura de un sistema en equilibrio, el constante de equilibrio para la reacción cambia. Bajar la temperatura en el sistema \(\ce{HI}\) aumenta el constante de equilibrio: en el nuevo equilibrio, la concentración de \(\ce{HI}\) ha aumentado y las concentraciones de \(\ce{H2}\) y \(\ce{I2}\) disminuyeron. Elevando la temperatura disminuye el valor del constante de equilibrio, de 67.5 a 357 °C y a 50.0 a 400 °C.
La temperatura afecta el equilibrio entre \(\ce{NO_2}\) y \(\ce{N_2O_4}\) en esta reacción
\[\ce{N2O4(g) \rightleftharpoons 2NO2(g)}\;\;\; ΔH=\mathrm{57.20\; kJ} \label{13.4.7}\]
La ΔH positiva nos indica que la reacción es endotérmica y se puede escribir como
\[\text{heat}+\ce{N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.4.8}\]
A temperaturas más altas, la mezcla de gases tiene un color marrón oscuro, indicando la presencia de una cantidad significativa de moléculas de \(\ce{NO_2}\). Sin embargo, si causamos tensión en el sistema por enfriando la mezcla (disminuyendo la energía), el equilibrio se desplaza hacia la izquierda para suministrar parte de la energía perdida por el enfriamiento. La concentración del incoloro \(\ce{N_2O_4}\) aumenta, y la concentración de \ (\ ce {NO_2} \) de color marrón disminuye, haciendo que el color marrón se desvanezca.
Los catalizadores no afectan el equilibrio
Como aprendimos durante nuestro estudio de la cinética, un catalizador puede acelerar la velocidad de una reacción. Aunque este aumento en la velocidad de reacción puede hacer que un sistema alcance el equilibrio más rápidamente (acelerando las reacciones directas e inversas), un catalizador no tiene efecto sobre el valor de un constante de equilibrio ni sobre las concentraciones de equilibrio.
La interacción de los cambios en la concentración, presión, o la temperatura y la falta de influencia de un catalizador en el equilibrio químico se ilustra en la síntesis industrial del amoníaco a partir del nitrógeno e hidrógeno de acuerdo con la ecuación:
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \label{13.4.9}\]
Una gran cantidad de amoníaco se fabrica por esta reacción. Cada año, el amoníaco se encuentra entre los 10 principales productos químicos, en masa, fabricados en el mundo. Alrededor de 2 mil millones de libras se fabrican en los Estados Unidos cada año. El amoníaco juega un papel vital en nuestra economía global. Se usa en la producción de fertilizantes y es un fertilizante importante para el crecimiento del maíz, el algodón y otros cultivos. Grandes cantidades de amoníaco se convierten en el ácido nítrico, que desempeña un papel importante en la producción de los fertilizantes, explosivos, plásticos, colorantes y fibras, y también se utiliza en la industria del acero.
Fritz Haber
Haber nació en Breslau, Prusia (actualmente Wroclaw, Polonia) en diciembre del año 1868. Estudió química y, mientras estaba en la Universidad de Karlsruhe, desarrolló lo que luego se conocería como el proceso Haber: la formación catalítica del amoníaco a partir del hidrógeno y del nitrógeno atmosférico a altas temperaturas y presiones.

El trabajo del Fritz Haber, el ganador del Premio Nobel, revolucionó las prácticas agrícolas a principios del siglo XX. Su trabajo también afectó las estrategias de guerra, agregando armas químicas a la artillería.
Por este trabajo, Haber recibió el Premio Nobel de Química de 1918 por la síntesis del amoníaco a partir de sus elementos. El proceso de Haber fue una bendición para la agricultura, ya que permitió que la producción de los fertilizantes ya no dependiera de los piensos extraídos como el nitrato de sodio.
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)}\]
Actualmente, la producción anual de los fertilizantes de nitrógeno sintético supera los 100 millones de toneladas y la producción de los fertilizantes sintéticos ha aumentado la cantidad de humanos que la tierra cultivable puede soportar de 1.9 personas por hectárea en 1908 a 4.3 en 2008. La disponibilidad del nitrógeno es un factor limitante para el crecimiento de las plantas. A pesar de representar el 78% del aire, el nitrógeno diatómico (\(\ce{N_2}\)) no está disponible nutricionalmente debido a la tremenda estabilidad del triple enlace de nitrógeno-nitrógeno. Para que las plantas usen el nitrógeno atmosférico, el nitrógeno se debe convertir a una forma más biodisponible (esta conversión se llama la fijación del nitrógeno).
Además de su trabajo en la producción del amoníaco, Haber también es recordado por la historia como uno de los padres de la guerra química. Durante la Primera Guerra Mundial, él jugó un papel importante en el desarrollo de los gases venenosos usados para la guerra de trincheras. Con respecto a su papel en estos desarrollos, Haber dijo: "Durante el tiempo de paz, un científico pertenece al mundo, pero durante el tiempo de guerra pertenece a su país".1 Haber defendió el uso de la guerra del gas contra las acusaciones de que era inhumano, diciendo que la muerte fue la muerte, por cualquier medio que se infligió. Se presenta como un ejemplo de los dilemas éticos que enfrentan los científicos en tiempos de guerra y la naturaleza de doble filo de la espada de la ciencia.
Al igual que Haber, los productos hechos de amoníaco pueden ser multifacéticos. Además de su valor para la agricultura, los compuestos de nitrógeno también pueden ser destructivos. El nitrato de amonio también se ha utilizado en explosivos, incluidos los dispositivos explosivos improvisados. El nitrato de amonio fue uno de los componentes de la bomba utilizada en el ataque contra el Edificio Federal Alfred P. Murrah en el centro de la ciudad de Oklahoma el 19 de abril de 1995.
Desde hace tiempo se sabe que el nitrógeno y el hidrógeno reaccionan para formar el amoníaco. Sin embargo, se hizo posible fabricar el amoníaco en cantidades útiles por la reacción de nitrógeno e hidrógeno solo a principios del siglo XX después de que se entendieran los factores que influyen en su equilibrio.
Para ser práctico, un proceso industrial debe producir una gran cantidad de producto rápidamente. Una de manera de aumentar la cantidad de amoniaco producido es aumenta la presión del sistema en el cual N2, H2, y NH3 están en equilibrio o cerca al equilibrio.
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \label{13.4.10}\]
La formación de cantidades adicionales del amoniaco disminuye la presión total ejercida por el sistema y reduce un poco la tensión causada por el aumento de la presión.
Aunque aumentando la presión de una mezcla de N2, H2 y NH3 aumentará el rendimiento del amoníaco, a bajas temperaturas, la tasa de formación del amoníaco es lenta. Por ejemplo, a temperatura ambiente la reacción es tan lenta que si preparamos una mezcla de N2 y H2, no se formaría una cantidad detectable de amoníaco durante nuestra vida. La formación de amoníaco a partir del hidrógeno y del nitrógeno es un proceso exotérmico:
\[\ce{N2(g) + 3H2(g) \rightarrow 2NH3(g)} \;\;\; ΔH=\mathrm{−92.2\; kJ} \label{13.4.11}\]
En consecuencia, aumentando la temperatura para aumentar la velocidad disminuye el rendimiento del producto. Si bajamos la temperatura para cambiar el equilibrio para favorecer la formación de más amoníaco, el equilibrio se alcanza más lentamente debido a la gran disminución de la velocidad de la reacción al disminuir la temperatura.
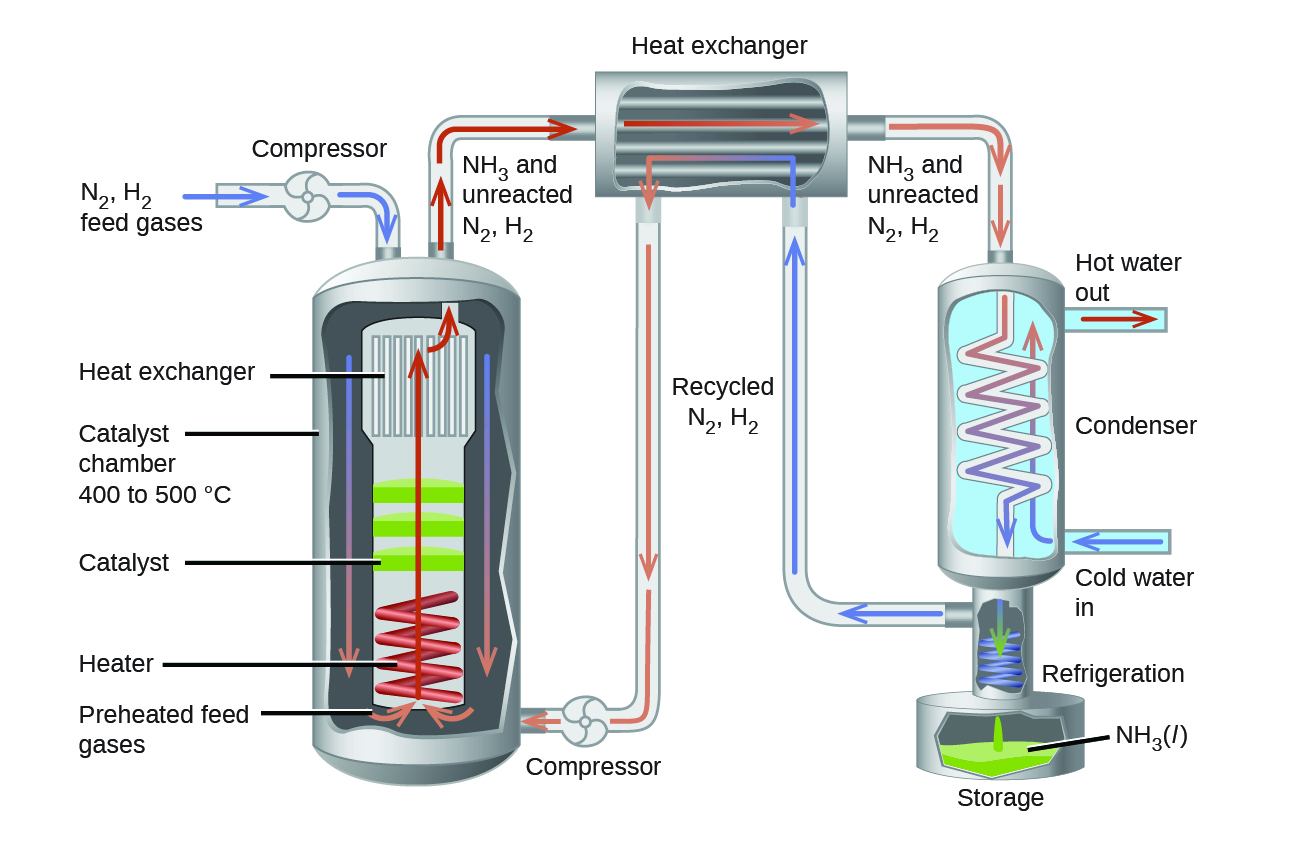
Parte de la tasa de formación perdida por operando a temperaturas mas bajas se puede recuperar por usando un catalizador. El efecto neto del catalizador sobre la reacción es casuar que el equilibro se alcance más rápidamente. En la producción comercial del amoníaco, se utilizan condiciones de aproximadamente 500 ° C, 150–900 atm, y la presencia de un catalizador para obtener el mejor compromiso entre la velocidad, el rendimiento y el costo del equipo necesario para producir y contener gases a presión a altas temperaturas (Figura \(\PageIndex{2}\)).
Resumen
Los sistemas en equilibrio se pueden alterar por cambios en la temperatura, la concentración y, en algunos casos, el volumen y la presión; los cambios de volumen y presión alterarán el equilibrio si el número de moles de gas es diferente en los lados del reactivo y del producto de la reacción. La respuesta del sistema a estos cambios se describe mediante el principio de Le Chatelier: el sistema responderá de una manera que contrarreste el cambio. No todos los cambios en el sistema resultan en una alteración del equilibrio. Agregar un catalizador afecta las velocidades de las reacciones, pero no altera el equilibrio, y un cambio en la presión o el volumen no perturbará significativamente los sistemas sin gases o con cantidades iguales de moles de gas en el lado del reactivo y del producto.
| El cambio | Cambio observado a medida que se restablece el equilibrio | Dirección del desplazamiento | Efecto en K |
|---|---|---|---|
| reactivo añadido | el reactivo agregado se consume parcialmente |
hacia productos |
nada |
| producto añadido | el producto agregado se consume parcialmente |
hacia reactivos |
nada |
| disminución de volumen/aumento de presión de gas | la presión disminuye | hacia el lado con menos moles de gas | nada |
| aumento de volumen/disminución de presión de gas | la presión aumenta | hacia el lado con más moles de gas | nada |
| aumento en temperatura | el calor se absorbe |
hacia productos para endotermia, hacia reactivos para exotérmica |
cambia |
| disminución en temperatura | se emite el calor |
hacia reactivos para endotermia, hacia productos para exotérmica |
cambia |
Notas al pie de la página
- Herrlich, P. "La responsabilidad del científico: ¿Qué puede enseñarnos la historia sobre cómo los científicos deben manejar la investigación que tiene el potencial de crear daños?" EMBO Reports 14 (2013): 759–764.
Glosario
- Principio de Le Chatelier
- cuando se altera un sistema químico en equilibrio, vuelve al equilibrio al contrarrestar el cambio
- posición del equilibrio
- concentraciones o presiones parciales de componentes de una reacción en equilibrio (comúnmente usado para describir condiciones antes de una perturbación)
- estrés
- un cambio a las condiciones de una reacción que pueden causar un cambio en el equilibrio
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


