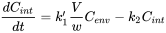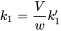4.1: Toxicocinética
( \newcommand{\kernel}{\mathrm{null}\,}\)
4.1. Toxicocinética
Autor: Nico van Straalen
Crítico: Kees van Gestel
Objetivos de aprendizaje:
Deberías ser capaz de
- Describir la diferencia entre toxicocinética y toxicodinámica
- Explicar el uso de diferentes descriptores para la absorción de sustancias químicas por organismos en estado estacionario y condiciones dinámicas
Palabras clave: toxicodinámica, toxicocinética, bioacumulación, constantes de velocidad toxicocinética, residuo corporal crítico, desintoxicación
La toxicología suele distinguir entre toxicocinética y toxicodinámica. La toxicocinética involucra todos los procesos relacionados con la captación, el transporte interno y la acumulación dentro de un organismo, mientras que la toxicodinámica se ocupa de la interacción de un compuesto con un receptor, inducción de mecanismos de defensa, reparación de daños y efectos tóxicos. Por supuesto, los dos conjuntos de procesos pueden interactuar, por ejemplo, la defensa puede retroalimentar a la absorción y el daño puede cambiar el transporte interno. Sin embargo, a menudo el análisis toxicocinético solo se centra en el seguimiento de la propia sustancia química e ignora los posibles efectos tóxicos. Esto sostiene hasta un umbral crítico, la concentración corporal crítica, por encima del cual los efectos se hacen evidentes y el análisis toxicocinético normal ya no es válido. La suposición de que los parámetros de tasa toxicocinética son independientes de la concentración interna se debe a la cantidad limitada de información que se puede obtener de los animales en el ambiente. Sin embargo, en los llamados modelos farmacocinéticos y farmacodinámicos basados en la fisiología (modelos PBPK), la cinética y la dinámica se analizan como un todo integrado. Sin embargo, el uso de tales modelos se limita principalmente a mamíferos y humanos.
Se debe enfatizar que la toxicocinética considera flujos y tasas, es decir, mg de una sustancia que se mueve por unidad de tiempo de un compartimento a otro. Los flujos pueden conducir a un equilibrio dinámico, es decir, un equilibrio que se debe a que el flujo de entrada es igual al flujo de salida; cuando solo se consideran las condiciones de equilibrio, esto se denomina partición.
En este Capítulo 4.1 exploraremos los diversos enfoques en toxicocinética, incluyendo los flujos de tóxicos a través de organismos individuales y a través de niveles tróficos, así como los procesos biológicos que determinan dichos flujos. Comenzamos comparando las concentraciones de tóxicos entre organismos y su ambiente (sección 4.1.1), y entre organismos de diferentes niveles tróficos (sección 4.1.6). Esto lleva al famoso concepto de bioacumulación, una de las propiedades de una sustancia que a menudo conduce a problemas ambientales. Si bien en el pasado la dilución a veces se veía como una solución a la contaminación, esto no es correcto para las sustancias bioacumuladas, ya que pueden aparecer en otra parte del siguiente nivel de la cadena alimentaria y alcanzar una concentración aún mayor. El factor de bioacumulación es una de las propiedades mejor investigadas que caracterizan el comportamiento ambiental de una sustancia. Se puede predecir a partir de propiedades de la sustancia como el coeficiente de partición octanol-agua.
En la sección 4.1.2 discutimos la teoría clásica de la cinética de absorción-eliminación utilizando el modelo lineal de un compartimento. Esta teoría es una parte crucial del análisis toxicológico. Una de las primeras cosas que quieres saber sobre una sustancia es qué tan rápido ingresa a un organismo y qué tan rápido se elimina. Dado que la toxicidad es básicamente un proceso dependiente del tiempo, la tasa de renovación de la concentración interna y la acumulación de un residuo dependen del tiempo de exposición. Por lo tanto, la comprensión de la toxicocinética es fundamental para cualquier interpretación de un experimento de toxicidad. Los parámetros de velocidad pueden predecirse en parte a partir de las propiedades de la sustancia, pero las propiedades del organismo juegan un papel mucho mayor aquí. Una de ellas es simplemente la masa corporal; la predicción de las constantes de velocidad de eliminación a partir de la masa corporal se realiza mediante relaciones de escalado alométricas, exploradas en la sección 4.1.5.
En dos secciones, 4.1.3 y 4.1.4, se presentan los procesos biológicos que subyacen a la renovación de sustancias tóxicas en un organismo. Estos son muy diferentes para los metales que para las sustancias orgánicas, de ahí que se dediquen a este tema dos secciones separadas, una sobre la acumulación tisular de metales y otra sobre los mecanismos de defensa para xenobióticos orgánicos.
Por último, si entendemos todos los procesos toxicocinéticos también podremos entender si la concentración dentro de un órgano diana se mantendrá por debajo o simplemente superará el umbral que se pueda tolerar. La concentración corporal crítica, explorada en la sección 4.1.7, es un concepto importante que vincula la toxicocinética con la toxicidad.
Definir e indicar las diferencias entre
- Toxicocinética
- Toxicodinámica
- Particionado
- Acumulación
- Bioacumulación
4.1.1. Bioacumulación
Autor: Joop Hermens
Revisores: Kees van Gestel y Philipp Mayer
Objetivos de aprendizaje:
Deberías ser capaz de
- definir y explicar diferentes parámetros de bioacumulación.
- Mencionar diferentes factores biológicos que pueden afectar la bioacumulación.
Palabras clave: Bioacumulación, contenido lipídico
Introducción: terminología para bioacumulación
El término bioacumulación describe la transferencia y acumulación de un químico desde el ambiente hacia un organismo”. Para un químico como el hexaclorobenceno, la concentración en peces es más de 10,000 veces mayor que en el agua, lo que es una clara ilustración de la “bioacumulación”. Un químico como el hexaclorobenceno es hidrofóbico, por lo que tiene una solubilidad acuosa muy baja. Por lo tanto, prefiere escapar de la fase acuosa para entrar (o dividirse en) una fase más lipófila como la fase lipídica en la biota.
La absorción puede tener lugar de diferentes fuentes. Los peces absorben principalmente productos químicos de la fase acuosa, los organismos que viven en la interfase sedimento-agua están expuestos a través del agua suprayacente y partículas de sedimentos, organismos que viven en el suelo o sedimento a través del agua de poro e ingeriendo suelo o sedimento, mientras que los depredadores estarán expuestos a través de sus alimentos. En muchos casos, la captación está relacionada con más de una fuente. Las diferentes vías de captación también se reflejan en los parámetros y terminología utilizados en los estudios de bioacumulación. Los diferentes parámetros incluyen el factor de bioconcentración (BCF), el factor de bioacumulación (BAF), el factor de biomagnificación (BMF) y el factor de biotaa-sedimento o de acumulación de biota a suelo (BSAF). En la Figura 1 se resume la definición de estos parámetros. La bioconcentración se refiere a la captación desde la fase acuosa, la bioacumulación a la captación tanto a través de la fase acuosa como la ingestión de sedimentos o partículas de suelo, mientras que la biomagnificación expresa la acumulación de contaminantes de los alimentos.
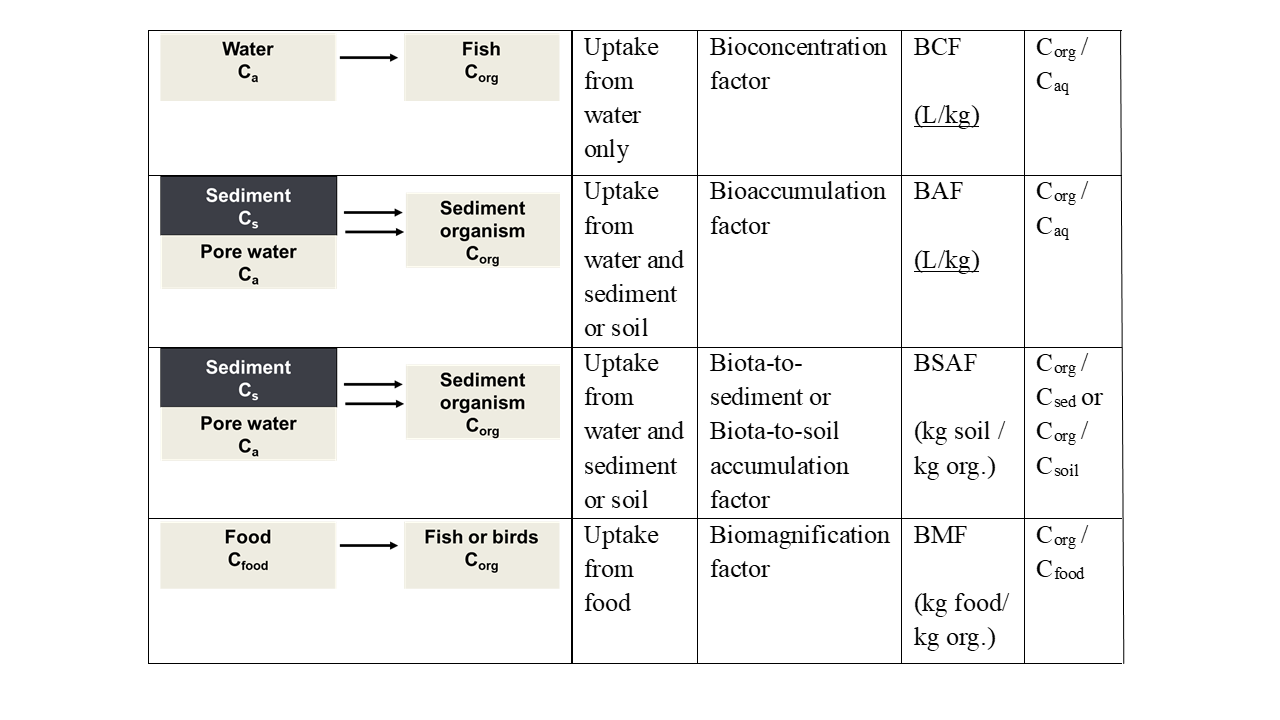
Concentración de C ac en agua (fase acuosa)
Concentración de C org en organismo
Concentración de C f en los alimentos
Concentración de C s en sedimentos o suelo
Tenga en cuenta que el factor de bioacumulación (BAF) se define de manera similar al Factor de Bioconcentración (BCF), pero que la captación puede ser tanto de la fase acuosa como del sedimento o suelo y que la concentración de exposición generalmente se expresa por kg de sedimento seco o suelo. Otras definiciones del BAF son posibles, pero hemos seguido la de Mackay et al. (2013). “El factor de bioacumulación (BAF) se define aquí de manera similar al BCF; es decir, el BAF es CF/CW en estado estacionario, excepto que en este caso el pez está expuesto tanto al agua como a los alimentos; así, se produce un aporte adicional de sustancia química de la asimilación dietética”.
Todos los factores de bioacumulación son constantes de estado estacionario: la concentración en el organismo es constante y los organismos están en equilibrio con su fase circundante. Pasará tiempo antes de que se alcance tal estado estacionario. El estado estacionario se alcanza cuando la tasa de absorción (por ejemplo de una fase acuosa) es igual a la tasa de eliminación. Los modelos que incluyen el factor tiempo en la descripción de la captación se denominan modelos cinéticos; ver sección Cinética de bioacumulación.
Efecto de las propiedades biológicas sobre la acumulación
La absorción de los productos químicos está determinada por las propiedades tanto del organismo como del químico. Para los químicos lipofílicos xenobióticos en el agua, los factores específicos del organismo suelen desempeñar un papel menor y las concentraciones en los organismos pueden predecirse bastante bien a partir de las propiedades químicas (ver sección sobre relaciones estructura-propiedad). Para los metales, por el contrario, la absorción está determinada en gran medida por las propiedades del organismo, y una consecuencia directa de sus requerimientos minerales. Un químico con baja biodisponibilidad (baja absorción en comparación con la concentración en el medio de exposición) puede, sin embargo, acumularse a niveles altos cuando el organismo no es capaz de excretar o metabolizar el químico.
Los factores relacionados con el organismo son:
- Contenido de grasa. Debido a que los químicos lipófilos se acumulan principalmente en la grasa de los organismos, es razonable suponer que los organismos ricos en lípidos tendrán mayores concentraciones de químicos lipófilos. Ver Figura 2 para un ejemplo de factores de bioconcentración de 1,2,4-triclorobenceno en varios organismos con contenido lipídico variable. Esta fue una de las explicaciones de los altos niveles de PCB en anguila (alto contenido lipídico) en ríos holandeses y focas del mar de Wadden. Sin embargo, aún se encuentran grandes diferencias entre especies cuando las concentraciones se expresan sobre una base lipídica. Esto puede explicarse, por ejemplo, por el hecho de que los lípidos no son todos idénticos: los PCB parecen disolverse mejor en los lípidos de las anchoas que en los lípidos de las algas (ver datos en la Tabla 1). También investigaciones más recientes han demostrado que no todos los lípidos son iguales y que las diferencias en la bioacumulación entre especies pueden deberse a diferencias en la composición lipídica (Van der Heijden y Jonker, 2011). Relacionado con esto se encuentra el desarrollo de modelos BCF que se basan en múltiples compartimentos y que hacen una separación entre el almacenamiento y los lípidos de membrana y además incluyen una fracción proteica como sumidero adicional (Armitage et al., 2013). En este modelo, el coeficiente de distribución general D BW (o BCF) se estima mediante la ecuación 1. La ecuación está utilizando coeficientes de distribución porque el modelo también “da cuenta de la presencia de especies químicas neutras y cargadas” (Armitage et al., 2013).
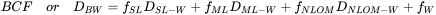
D BW |
coeficiente de distribución global del organismo-agua (o BCF sustituto) a un pH dado |
D SL-W |
relación de distribución de lípido-agua de almacenamiento |
D ML-W |
relación de distribución lípido-agua de membrana |
|
D NLOM-W |
coeficiente de sorción a NLOM (materia orgánica no lipídica, por ejemplo proteínas) |
f SL |
fracción de lípidos de almacenamiento |
f ML |
fracción de lípidos de membrana |
f NLOM |
fracción de materia orgánica no lipídica (por ejemplo, proteínas, carbohidratos) |
f W |
fracción de agua |
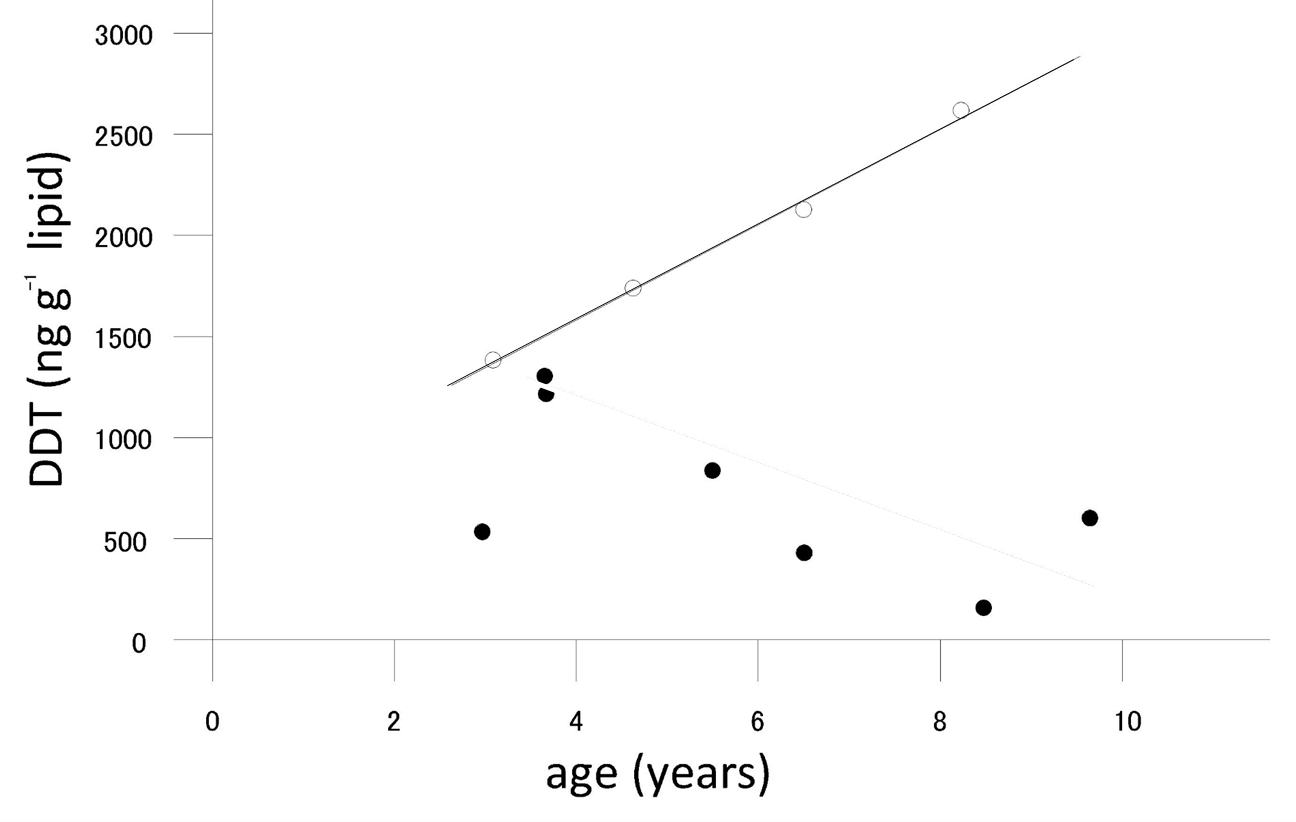
- Sexo: Los productos químicos (como DDT, PCB) acumulados en la grasa de la leche pueden transferirse a los juveniles al momento de la lactancia. Esto se encontró en mamíferos marinos. De esta manera, las hembras cuentan con un mecanismo de excreción adicional. Un ejemplo típico se muestra en la Figura 3, tomada de un estudio de Abarnou et al. (1986) sobre los niveles de compuestos organoclorados en el delfín antártico Cephalorhyncus commersonii. En los machos, las concentraciones aumentan al aumentar la edad, pero las concentraciones en las hembras maduras disminuyen con el aumento de la edad.
- Peso: (masa corporal) del organismo en relación con la superficie a través de la cual se produce el intercambio con la fase acuosa. Los organismos más pequeños tienen una mayor relación superficie-volumen y el intercambio con la fase acuosa circundante es más rápido. Por lo tanto, aunque las concentraciones normalizadas de lípidos serán las mismas en equilibrio, este equilibrio se alcanza antes en organismos más pequeños que en organismos más grandes.
- Diferencia en la vía de captación. La importancia relativa de la captación a través de la piel (en peces, por ejemplo, las branquias) y la captación (oral) a través del sistema digestivo. Generalmente se acepta que para la mayoría de los organismos de vida libre la absorción directa del agua domina sobre la absorción después de la digestión en el tracto digestivo.
- Actividad metabólica. Incluso al mismo peso o a la misma edad, el equilibrio entre la captación y la excreción puede cambiar debido a una mayor actividad metabólica, por ejemplo, en tiempos de rápido crecimiento o alta actividad reproductiva.

Cuadro 1. Concentraciones medias de PCB en algas (Dunaliella spec.), rotíferos (Brachionus plicatilis) y larvas de anchoas (Angraulis mordax), expresadas en peso seco y en base lipídica. De Moriarty (1983).
|
Organismo |
Contenido lipídico (%) |
Concentración de PCB basada en peso seco (µg g -1) |
Concentración de PCB basada en el peso de lípidos (µg g -1) |
BCF basado en la concentración en la fase lipídica |
|
algas |
6.4 |
0.25 |
3.91 |
0.48 x 10 6 |
|
rotífero |
15.0 |
0.42 |
2.80 |
0.34 x 10 6 |
|
larvas de peces (anchoas) |
7.5 |
2.06 |
27.46 |
13.70 x 10 6 |
Referencias citadas
Abarnou, A., Robineau, D., Michel, P. (1986). Contaminación organoclorada de delfines commersons de las islas Kerguelen. Oceanologica Acta 9, 19-29.
Armitage, J.M., Arnot, J.A., Wania, F., Mackay, D. (2013). Desarrollo y evaluación de un modelo mecanicista de bioconcentración para químicos orgánicos ionogénicos en peces. Toxicología y Química Ambiental 32, 115-128.
Geyer, H., Scheunert, I., Korte, F. (1985). Relación entre el contenido lipídico de los peces y su potencial de bioconcentración de 1,2,4-triclorobenceno. Quimosfera 14, 545-555.
Mackay, D., Arnot, J.A., Gobas, F., Powell, D.E. (2013). Relaciones matemáticas entre métricas de bioacumulación química en peces. Toxicología y Química Ambiental 32, 1459-1466.
Moriarty, F. (1983). Ecotoxicología: El estudio de contaminantes en ecosistemas. Editorial: Academic Press, Londres.
Van der Heijden, S.A., Jonker, M.T.O. (2011). Variación intra e interespecies en el potencial de bioconcentración de bifenilos policlorados: ¿todos los lípidos son iguales? Ciencia y Tecnología Ambiental 45, 10408-10414.
Lectura sugerida
Mackay, D., Fraser, A. (2000). Bioacumulación de químicos orgánicos persistentes: Mecanismos y modelos. Contaminación Ambiental 110, 375-391.
Van Leeuwen, C.J., Vermeire, T.G. (Eds.) (2007). Evaluación de Riesgos de Químicos: Una Introducción. Springer, Dordrecht, Países Bajos. Capítulo 3.
¿Cuál es la diferencia entre BCF y BSAF?
¿Cuáles son las principales vías de captación de un organismo sedimentario?
¿Qué factores biológicos pueden influir en la bioacumulación?
4.1.2. Toxicocinética
Autor (es): Joop Hermens, Nico van Straalen
Revisores: Kees van Gestel, Philipp Mayer
Objetivos de aprendizaje:
Deberías ser capaz de
- mencionar los supuestos subyacentes de los modelos cinéticos para la bioacumulación
- comprender las ecuaciones básicas de un modelo de bioacumulación cinética de un compartimento
- explicar las diferencias entre los modelos de uno y dos compartimentos
- mencionar qué factores afectan las constantes de velocidad en un modelo de compartimento
Palabras clave: Bioacumulación, toxicocinética, modelos de compartimento
En la sección "Bioacumulación “, el proceso de bioacumulación se presenta como un proceso en estado estacionario. Las diferencias en la bioacumulación entre los químicos se expresan a través, por ejemplo, del factor de bioconcentración BCF. El BCF representa la relación de la concentración química en, por ejemplo, un pez versus la concentración acuosa en una situación en la que las concentraciones en agua y peces no cambian en el tiempo.
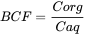 (1)
(1)
donde:
Concentración acuosa de C en agua (fase acuosa) (mg/L)
Concentración de C org en el organismo (mg/kg)
La unidad de BCF es L/kg.
Modelos cinéticos
El estado estacionario se puede establecer en una configuración de laboratorio simple donde los peces se exponen a una sustancia química a una concentración constante en la fase acuosa. Desde el inicio de la exposición (tiempo 0, o t=0), la concentración química en los peces tardará tiempo en alcanzar el estado estacionario y en algunos casos, esto no se establecerá dentro del periodo de exposición. En el ambiente, las concentraciones de exposición pueden fluctuar y, en tales escenarios, a menudo no se establecerán concentraciones constantes en el organismo. El estado estacionario se alcanza cuando la tasa de absorción (por ejemplo de una fase acuosa) es igual a la tasa de eliminación. Los modelos que incluyen el factor tiempo en la descripción de la absorción de sustancias químicas en los organismos se denominan modelos cinéticos.
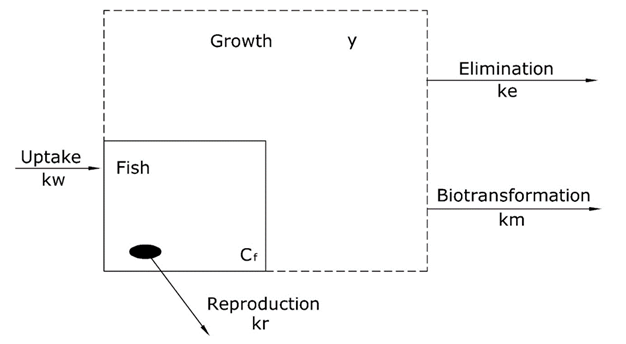
Los modelos toxicocinéticos para la absorción de sustancias químicas en los peces se basan en una serie de procesos de captación y eliminación. En la Figura 1 se presenta una visión general de estos procesos. En el caso de los peces, el principal proceso de captación es por difusión desde el compartimento de agua circundante a través de la branquial a la sangre. La eliminación puede ser a través de diferentes procesos: difusión a través de la branquial desde la sangre al compartimento de agua circundante, vía transferencia a crías o huevos por reproducción, por crecimiento (dilución) y por degradación interna de la sustancia química (biotransformación).
Los modelos cinéticos para describir la absorción de sustancias químicas en los organismos son relativamente simples con los siguientes supuestos:
Cinética de primer orden:
Los tipos de cambio son proporcionales a la concentración. El cambio en la concentración con el tiempo (dC/dt) está relacionado con la concentración y una constante de velocidad (k):
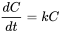 (2)
(2)
Un compartimento:
A menudo se asume que un organismo consiste en un solo compartimento y que el químico se distribuye homogéneamente dentro del organismo. Para los organismos pequeños “simples” esta suposición es intuitivamente válida, pero para los peces grandes esta suposición parece poco realista. Pero aún así, este sencillo modelo parece funcionar bien también para peces. Para describir la distribución interna de un químico dentro de los peces, se necesitan modelos cinéticos más sofisticados, similares a los aplicados en estudios con mamíferos. Estos modelos más complejos son los modelos “toxicocinéticos de base fisiológica” (PBTK) (Clewell, 1995; Nichols et al., 2004)
Ecuaciones para la cinética del proceso de acumulación
El proceso de acumulación puede describirse como la suma de las tasas de absorción y eliminación.
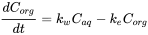 (3)
(3)
La integración de esta ecuación diferencial conduce a la ecuación 4.
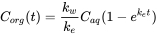 (4)
(4)
Concentración de C org en organismos (mg/kg)
Concentración de C ac en fase acuosa (mg/L)
k w constante de la tasa de absorción (L/kg·día)
k e constante de tasa de eliminación (1/día)
t tiempo (día)
(las dimensiones utilizadas son: cantidad de producto químico: mg; volumen de agua: L; peso del organismo: kg; hora: día); ver cuadro.
|
Cuadro: Las unidades de constantes de velocidad toxicocinética La ecuación diferencial subyacente al análisis toxicocinético es básicamente una ecuación de balance de masas, especificando la conservación de la masa. Un balance de masas implica que la cantidad de sustancia química se expresa en unidades absolutas como el mg. Si Q es la cantidad en el animal y F la cantidad en el compartimento ambiental el balance de masas dice:
donde
Tenga en cuenta que C env se mide en otras unidades (mg por kg de suelo, o mg por litro de agua) que C int (mg por kg de tejido animal). Para deshacerse del factor incómodo V/w es conveniente definir una nueva constante de velocidad, k 1:
Esta es la constante de la tasa de absorción generalmente reportada en artículos científicos. Obsérvese que cuenta con unidades distintas a ReferenciasMoriarty, F. (1984) Contaminantes persistentes, modelos compartimentales y concentración a lo largo de las cadenas alimentarias. Boletines Ecológicos 36: 35-45. Skip, B., A.J. Bednarska, & R. Laskowski (2014) Toxicocinética de metales en invertebrados terrestres: aclarar las cosas con el principio de un compartimento. PLoS ONE 9 (9): e108740. |
La Ecuación 4 describe todo el proceso con la representación gráfica correspondiente de la gráfica de captación (Figura 2).

La concentración en el organismo es el resultado del proceso neto de captación y eliminación. En la fase inicial del proceso de acumulación, la eliminación es insignificante y la relación de la concentración en el organismo viene dada por:
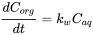 (5)
(5)
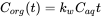 (6)
(6)
Estado estacionario
Después de un tiempo de exposición más largo, la eliminación se vuelve más sustancial y la curva de absorción comienza a nivelarse. En algún momento, la tasa de absorción es igual a la tasa de eliminación y la relación C org /C ac se vuelve constante. Esta es la situación de estado estacionario. La constante C org /C ac en estado estacionario se denomina factor de bioconcentración BCF. Matemáticamente, el BCF también se puede calcular a partir de
C org /C ac se vuelve constante. Esta es la situación de estado estacionario. La constante C org /C ac en estado estacionario se denomina factor de bioconcentración BCF. Matemáticamente, el BCF también se puede calcular a partir de k w /k e. Esto se desprende directamente de la ecuación 4: después de un largo tiempo de exposición (t),
k w /k e. Esto se desprende directamente de la ecuación 4: después de un largo tiempo de exposición (t), 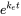 se convierte en 0 conduciendo a
se convierte en 0 conduciendo a
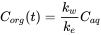
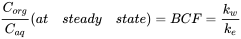 (7)
(7)
Eliminación
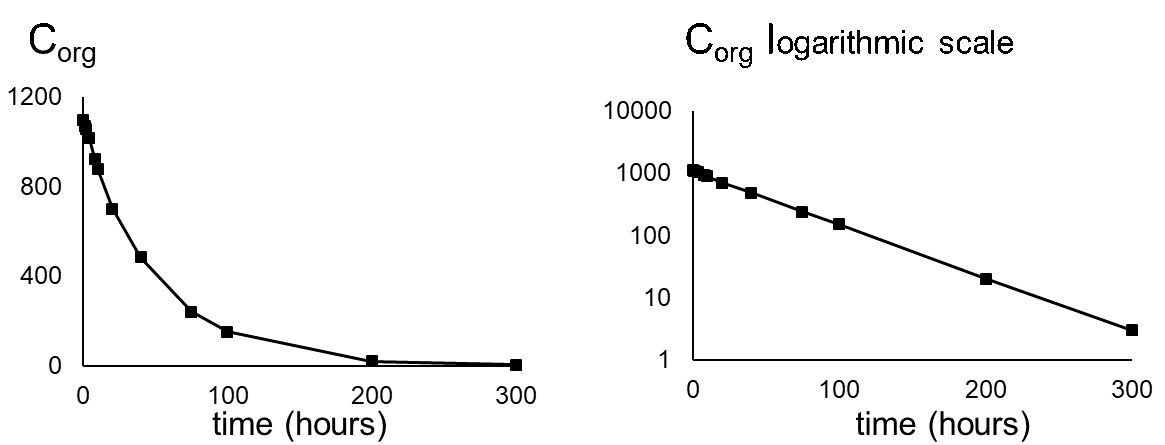
La eliminación a menudo se mide después de un experimento de absorción. Después de que el organismo haya alcanzado cierta concentración, los peces se transfieren a un ambiente limpio y la concentración en el organismo disminuirá con el tiempo. Debido a que este es también un proceso cinético de primer orden, la tasa de eliminación dependerá de la concentración en el organismo (C org) y de la constante de velocidad de eliminación (k e) (ver ecuación 8). La concentración disminuirá exponencialmente en el tiempo (ecuación 9) como se muestra en la Figura 3A. Las concentraciones a menudo se transforman a los valores logarítmicos naturales (ln C org) porque esto da como resultado una relación lineal con la pendiente -k e. (ecuación 10 y figura 3B).
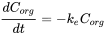 (8)
(8)
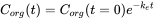 (9)
(9)
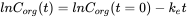 (10)
(10)
donde C org (t=0) es la concentración en el organismo cuando comienza la fase de eliminación.
La vida media (T 1/2 o DT 50) es el tiempo necesario para eliminar la mitad de la cantidad de sustancia química del compartimento. La relación entre k e y T 1/2 es: T 1/2 = (En 2)/k e. La vida media aumenta cuando k e disminuye.
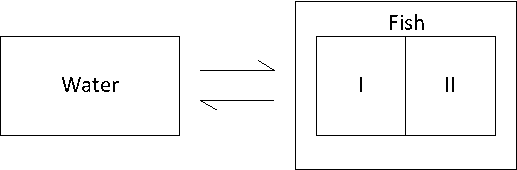
Modelos multicompartimientos
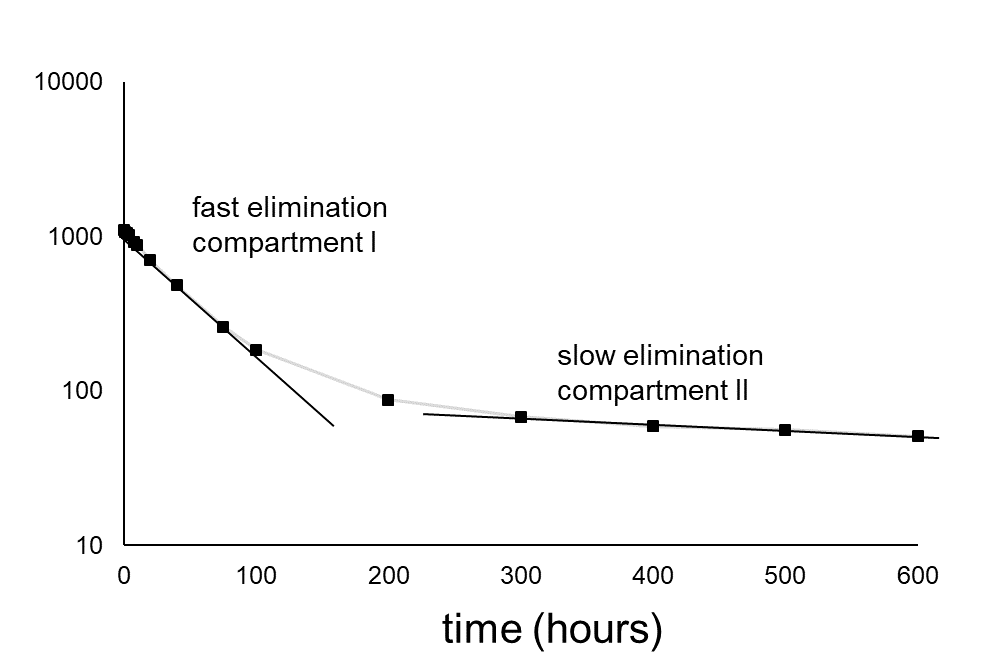
Muy a menudo, los organismos no pueden considerarse como un compartimento, sino como dos o incluso más compartimentos (Figura 4A). Las desviaciones del sistema de un compartimento generalmente se observan cuando la eliminación no sigue un patrón exponencial como se esperaba: no se obtiene ninguna relación lineal después de la transformación logarítmica. La Figura 4B muestra la tendencia típica de la eliminación en un sistema de dos compartimentos. La disminución de la concentración (en una escala logarítmica) muestra dos fases: la fase I con una disminución relativamente rápida y la fase II con una disminución relativamente lenta. De acuerdo con la teoría de compartimientos lineales, la eliminación puede describirse como la suma de dos (o más) términos exponenciales, como:
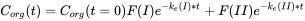 (11)
(11)
donde
k e (I) y k e (II) representan constantes de velocidad de eliminación para los compartimentos I y II,
F (I) y F (II) son el tamaño de los compartimentos (como fracciones)
Ejemplos típicos de sistemas de dos compartimientos son:
- Sangre (I) e hígado (II)
- Tejido hepático (I) y tejido graso (II)
La eliminación del tejido adiposo suele ser más lenta que la de, por ejemplo, el hígado. El hígado es un órgano bien perfundido mientras que el intercambio entre el tejido lipídico y la sangre es mucho menor. Eso explica la eliminación más rápida del hígado.
Ejemplos de curvas de absorción para diferentes químicos y organismos
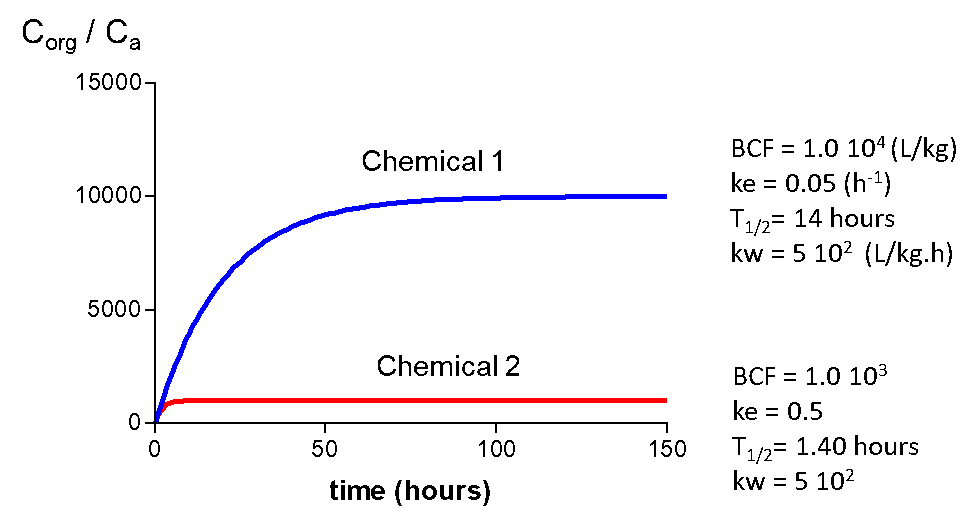
La Figura 5 da curvas de captación para dos productos químicos diferentes y los parámetros cinéticos correspondientes. El químico 2 tiene un BCF de 1000, el químico 1 un BCF de 10,000. Las tasas de absorción (k w) son las mismas, lo que suele ser el caso de los químicos orgánicos. Las vidas medias (tiempo para alcanzar el 50% del nivel de estado estacionario) son 14 y 140 horas. Esto tiene sentido porque tardará más tiempo en alcanzar el estado estacionario para un químico con un BCF más alto. Las constantes de tasa de eliminación también difieren en un factor de 10.
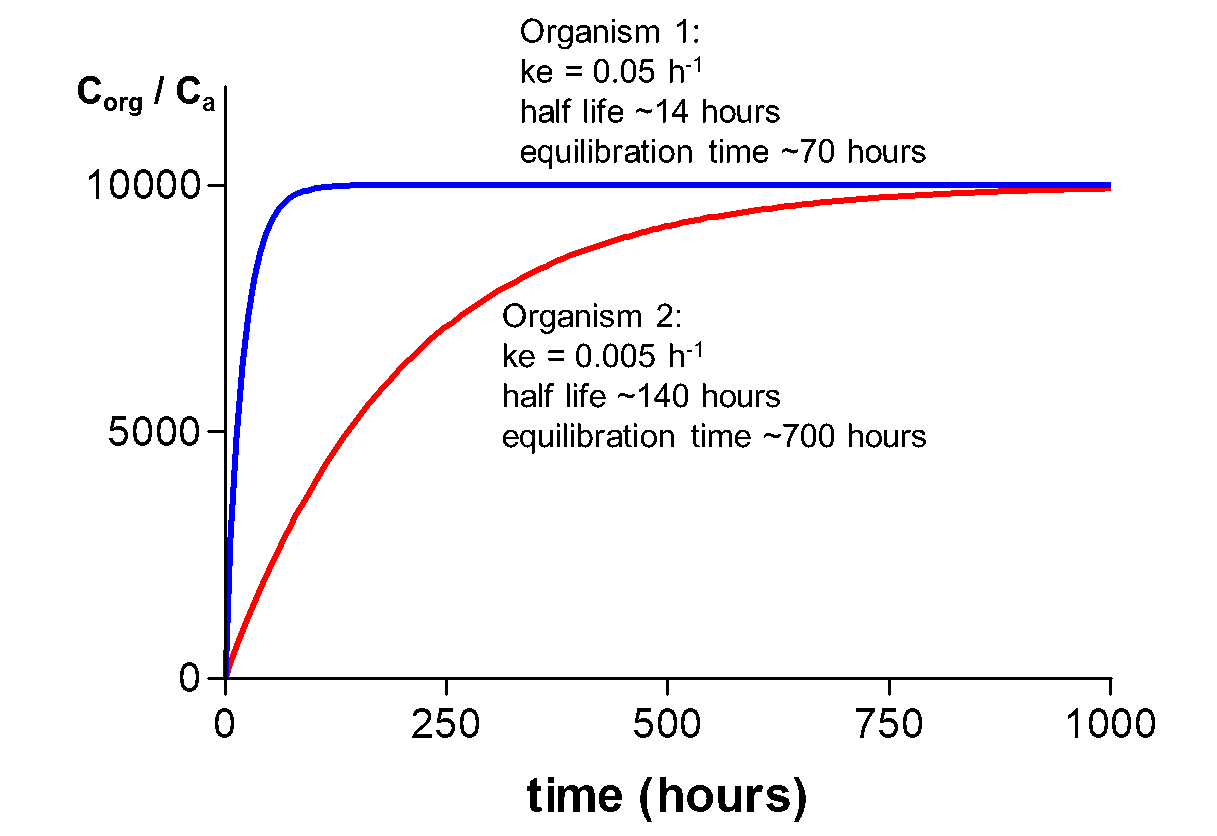
En la figura 6, se presentan curvas de captación para una sustancia química, pero en dos organismos de diferente tamaño/peso. El organismo 1 es mucho más pequeño que el organismo 2 y alcanza el estado estacionario mucho antes. Los valores de T 1/2 para el químico en los organismos 1 y 2 son de 14 y 140 horas, respectivamente. El pequeño tamaño explica este rápido equilibrio. Las tasas de absorción dependen de la relación superficie-volumen (S/V) de un organismo, que es mucho mayor para un organismo pequeño. Por lo tanto, la cinética en organismos pequeños es más rápida dando como resultado tiempos de equilibrado más cortos. El efecto del tamaño sobre la cinética se discute con más detalle en Hendriks et al. (2001) y en la Sección de Relaciones Alométricas.
Bioacumulación que implica biotransformación y diferentes vías de captación
En la ecuación 2, la eliminación solo incluye la eliminación de branquias. Si se consideran otros procesos como la biotransformación y el crecimiento, la ecuación puede extenderse para incluir estos procesos adicionales (ver ecuación 12).
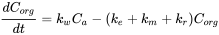 (12)
(12)
Para los organismos que viven en el suelo o sedimento, pueden ser importantes diferentes vías de captación: dérmica (a través de la piel), u oral (por ingestión de alimentos y/o partículas de suelo o sedimentos). Matemáticamente, la captación en un organismo en el sedimento puede describirse como en la ecuación 13.
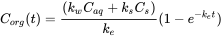 (13)
(13)
Concentración de C org en organismos (mg/kg)
Concentración de C ac en fase acuosa (mg/L)
Concentración de C s suelo o sedimento (mg/kg)
k w constante de la tasa de absorción del agua (L/kg/día)
k s constante de tasa de absorción del suelo o sedimento (kg suelo /kg organismo /día)
k e constante de tasa de eliminación (1/día)
t tiempo (día)
(las dimensiones utilizadas son: cantidad de producto químico: mg; volumen de agua: L; peso del organismo: kg; tiempo: día)
En esta ecuación, k w y k s son las constantes de tasa de absorción del agua y el sedimento, k e es la constante de velocidad de eliminación y C aq y C s son las concentraciones en agua y sedimento o suelo. Para los organismos del suelo, como las lombrices de tierra, la captación oral parece ser más importante al aumentar la hidrofobicidad del químico (Jager et al., 2003). Esto se debe a que la concentración en el suelo (C s) será mayor que la concentración de agua de poro C a para los productos químicos más hidrófobos (ver sección sobre Sorción).
Referencias
Clewell, H.J., 3er (1995). La aplicación de modelos farmacocinéticos de base fisiológica en la evaluación de riesgos para la salud humana de sustancias peligrosas. Cartas de Toxicología 79, 207-217.
Hendriks, A.J., van der Linde, A., Cornelissen, G., Sijm, D. (2001). El poder del tamaño. 1. Constantes de velocidad y relaciones de equilibrio para la acumulación de sustancias orgánicas relacionadas con la proporción de reparto octanol-agua y el peso de la especie. Toxicología y Química Ambiental 20, 1399-1420.
Jager, T., Fleuren, R., Hogendoorn, E.A., De Korte, G. (2003). Elucidar las rutas de exposición de químicos orgánicos en la lombriz, Eisenia andrei (Oligochaeta). Ciencia y Tecnología Ambiental 37, 3399-3404.
Nichols, J.W., Fitzsimmons, P.N., Whiteman, F.W. (2004). Un modelo toxicocinético de base fisiológica para la absorción dietética de compuestos orgánicos hidrófobos por peces - II. Simulación de escenarios de exposición crónica. Ciencias Toxicológicas 77, 219-229.
Van Leeuwen, C.J., Vermeire, T.G. (Eds.) (2007). Evaluación de Riesgos de Químicos: Una Introducción. Springer, Dordrecht, Países Bajos.
¿Cuáles son los supuestos en un modelo cinético de un compartimento?
¿Cómo se puede identificar cuando hay más compartimentos involucrados en un modelo cinético?
Dar ejemplos de compartimentos en un sistema multicompartimental.
¿Por qué se alcanza el equilibrio más rápido en un organismo pequeño en comparación con un organismo más grande?
¿Cuáles dos métodos se pueden aplicar para estimar el factor de bioconcentración de una sustancia química en un organismo?
4.1.3. Acumulación tisular de metales
Autor: Nico M. van Straalen
Críticos: Philip S. Rainbow, Henk Schat
Objetivos de aprendizaje:
Deberías ser capaz de
- indican cuatro tipos de constituyentes celulares inorgánicos que se unen a metales presentes en tejidos biológicos e indican a qué metales se unen.
- describen cómo la fitoquelatina y la metalotioneína son inducidas por los metales.
- mencionan una serie de combinaciones órgano-metal que son críticas para la toxicidad del metal.
Palabras clave: Proteínas de unión a metales; fitoquelatina; metalotioneína;
Sinopsis
El tema de la especiación de metales, que es de vital importancia para entender el destino de los metales en el ambiente, es igualmente importante para la distribución interna en los organismos y la toxicidad dentro de la célula. Muchos metales tienden a acumularse en órganos específicos, por ejemplo el hepatopáncreas de los crustáceos, el tejido cloragógeno de los anélidos y el riñón de los mamíferos. Además, a menudo hay un órgano o tejido específico donde primero se observa disfunción o toxicidad, por ejemplo, en el cuerpo humano, los efectos primarios de la exposición crónica al mercurio se observan en el cerebro, para el plomo en la médula ósea y para el cadmio en el riñón. Este módulo tiene como objetivo aumentar la percepción de los diferentes mecanismos por los cuales los metales se acumulan en los tejidos biológicos.
Introducción
Los metales estarán presentes en tejidos biológicos en una gran variedad de formas químicas: iones metálicos libres, diversas especies inorgánicas con solubilidad muy variable, como cloruros o carbonatos, además de todo tipo de especies metálicas unidas a ligandos bióticos de bajo peso molecular y alto peso molecular. El ión metálico libre se considera la especie más relevante en relación con la toxicidad.
Para explicar las afinidades de los metales con objetivos específicos, se ha propuesto un sistema basado en las propiedades físicas del ión; de acuerdo con este sistema, los metales se dividen en “metales que buscan oxígeno” (clase A, por ejemplo, litio, berilio, calcio y lantano), y “metales que buscan azufre” (clase B, por ejemplo, plata, mercurio y plomo) (Ver sección sobre Metales y metaloides). Sin embargo, la mayoría de los metales de relevancia ambiental caen en una clase intermedia, llamada “borderline” (cromo, cadmio, cobre, zinc, etc.). Esta clasificación es en cierta medida predictiva de la unión de metales a dianas celulares específicas, como los grupos SH en las proteínas, el nitrógeno en la histidina o los carbonatos en el tejido óseo.
No solo los metales difieren enormemente en sus propiedades fisicoquímicas, también los propios organismos difieren ampliamente en la forma en que tratan con los metales. El tipo de ligando al que se une un metal, y cómo este ligando es transportado o almacenado en el cuerpo, determina en gran medida dónde se acumulará el metal y causará toxicidad. Las dianas sensibles o los procesos bioquímicos críticos difieren entre especies y esto también puede conducir a una toxicidad diferencial.
Fijación de metales inorgánicos
Muchos tejidos contienen “concreciones minerales”, es decir, gránulos con una composición mineral específica que, debido a la naturaleza del mineral, atraen diferentes metales. Especialmente el epitelio intestinal de los invertebrados, y sus glándulas digestivas (hepatopáncreas, glándula del intestino medio, tejido cloragógeno) pueden estar llenos de tales concreciones. Se distinguen cuatro clases de gránulos (Figura 1):
- Gránulos de pirofosfato de calcio con magnesio, manganeso, a menudo también zinc, cadmio, plomo y hierro
- Gránulos de azufre con cobre, a veces también cadmio
- Gránulos de hierro, que contengan exclusivamente hierro
- Gránulos de carbonato cálcico, que contienen principalmente calcio
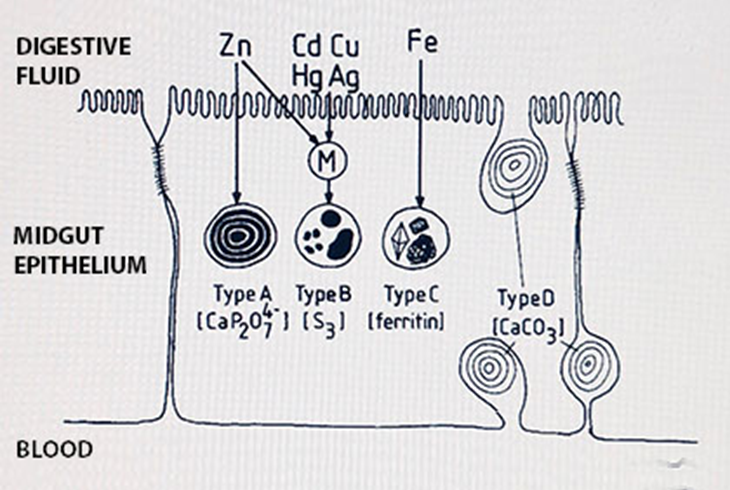
Se supone que los gránulos de tipo B son vesículas lisosómicas que han absorbido péptidos cargados de metal como la metalotioneína o la fitoquelatina, y se han desarrollado en gránulos inorgánicos degradando casi todo el material orgánico; el alto contenido de azufre deriva de los residuos de cisteína en los péptidos.
Los tejidos o células que se especializan en la síntesis de gránulos intracelulares son también los lugares donde los metales tienden a acumularse. Son conocidas las “células S” en los hepatopáncreas de los isópodos. Estas células (células pequeñas, células tipo B sensu Hopkin 1989) contienen cantidades muy grandes de cobre. Lo más probable es que las grandes reservas de cobre en cochinillas y otros crustáceos se relacionen con su uso de hemocianina, una proteína dependiente del cobre, como molécula transportadora de oxígeno. Se han descrito tejidos similares con altas cargas de concreciones minerales para lombrices de tierra, caracoles, colémbolos e insectos.
Encuadernación metálica orgánica
La segunda clase de ligandos de unión a metales es de naturaleza orgánica. Muchas plantas pero también varios animales sintetizan un péptido llamado fitoquelatina (PC). Se trata de un oligómero derivado del glutatión con los tres aminoácidos, ácido γ-glumático, cisteína y glicina, dispuestos de la siguiente manera: (γ-glu-cys) n-gly, donde n puede variar de 2 a 11. Los grupos tiol de varios residuos de cisteína están involucrados en la unión a metales.
El otro ligando orgánico principal para los metales es la metalotioneína (MT). Se trata de una proteína de bajo peso molecular con propiedades hidrófilas y un número inusualmente grande de residuos de cisteína. Varias cisteínas (generalmente nueve o diez) pueden unirse a varios iones metálicos (por ejemplo, cuatro o cinco) en un grupo. Hay dos grupos de este tipo en la metalotioneína de vertebrado. Las metalotioneínas ocurren a lo largo del árbol de la vida, desde bacterias hasta mamíferos, pero la secuencia de aminoácidos, la estructura del dominio y las afinidades metálicas varían enormemente y es dudoso que representen un solo grupo evolutivo-homólogo.
Además de estas dos clases específicas de ligandos orgánicos, MT y PC, los metales también se unirán específicamente a todo tipo de constituyentes celulares, tales como componentes de la pared celular, albúmina en la sangre, etc. A menudo esto representa el mayor almacén de metales; tales sitios de unión específicos entregarán constantemente gratis iones metálicos a la piscina celular y por lo tanto son la causa más importante de toxicidad. Por supuesto, los metales también están presentes en moléculas con funciones específicas dependientes de metales, como el hierro en la hemoglobina, el cobre en la hemocianina, el zinc en la anhidrasa carbónica, etc.
La distinción entre ligandos inorgánicos y orgánicos no es tan estricta como puede parecer. Después de la unión a metalotioneína o fitoquelatina, los metales pueden transferirse a un compartimento de almacenamiento más permanente, como los gránulos intracelulares mencionados anteriormente, o pueden ser excretados.
Regulación de encuadernación metálica
Los iones metálicos libres son fuertes inductores de las vías de respuesta al estrés. Esto puede deberse al ion metálico en sí, pero más a menudo la respuesta al estrés se desencadena por una alteración inducida por metales del estado redox, es decir, una inducción de estrés oxidativo. La respuesta al estrés a menudo implica la síntesis de ligandos de unión a metales como la fitoquelatina y la metalotioneína. Debido a que esto elimina los iones metálicos de la piscina activa, también se llama depuración de metales.
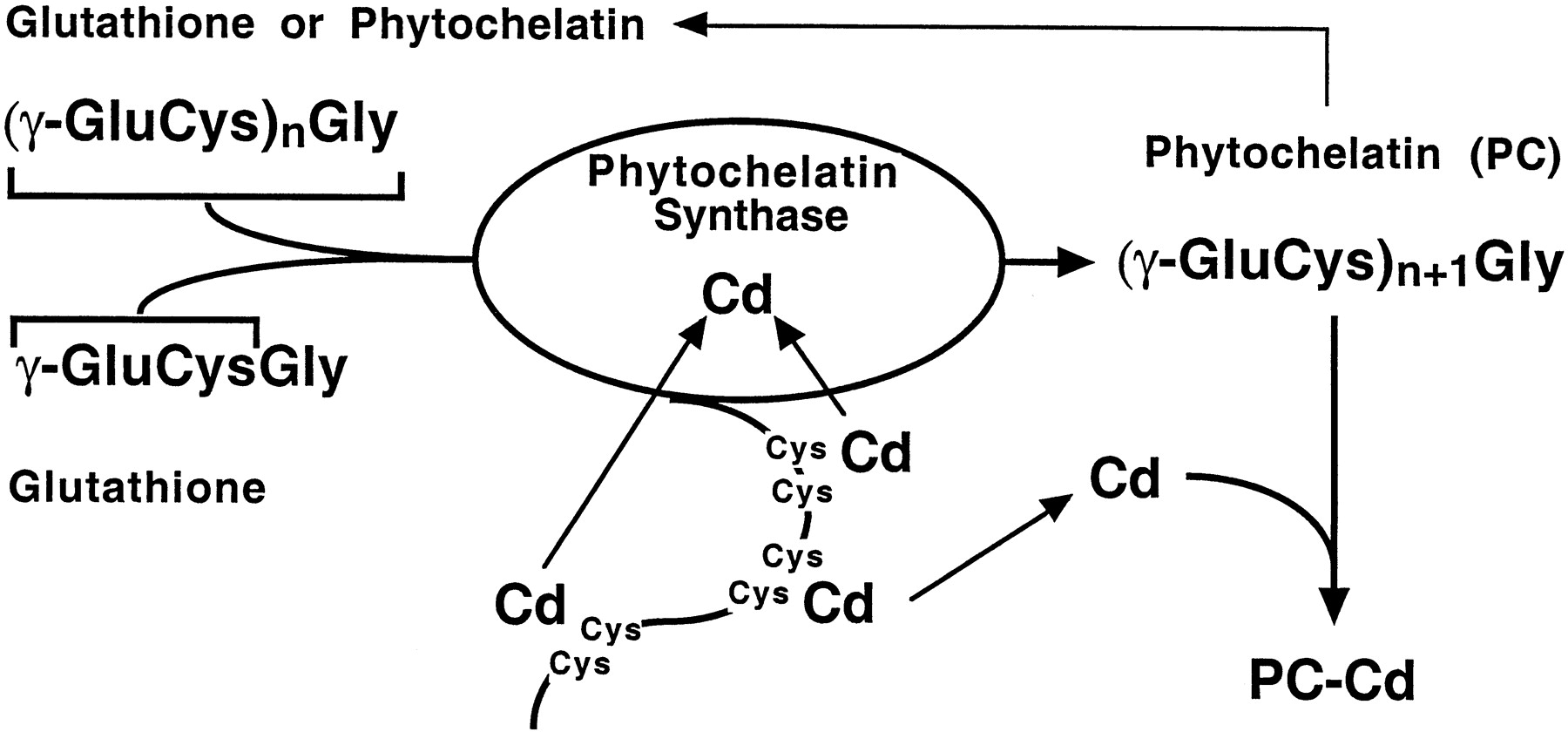
La capacidad de unión de la fitoquelatina se ve potenciada por la activación de la enzima fitoquelatina sintasa (PC sintasa). Según un modelo de su acción, el extremo C de la enzima tiene un “sensor metálico” que consiste en una serie de cisteínas con grupos SH libres. Cualquier ion metálico que reaccione con este centro nucleofílico (y el cadmio es un reactivo fuerte) activará la enzima que luego cataliza la reacción de (γ-glu-cys) n-gly a (γ-glu-cys) n+1 -gly, aumentando así la capacidad de unión de la fitoquelatina celular (Figura 2). Esta reacción, por supuesto, se basa en la presencia de suficiente glutatión en la célula. En las plantas el complejo PC-metal se transporta a la vacuola central, donde se puede estabilizar mediante la incorporación de azufre lábil al ácido (S2). El resto PC se degrada, dando como resultado la formación de cristalitos inorgánicos de sulfuro metálico. Alternativamente, se pueden formar complejos de metales con ácidos orgánicos (por ejemplo, citratos u oxalatos). Se desconoce el destino de la PC cargada con metal en células animales, pero podría ser absorbida en el sistema lisosómico para formar gránulos de tipo B (ver arriba).
La sobrerregulación de la metalotioneína (MT) ocurre de una manera bastante diferente, ya que depende de la síntesis de novo de la apoproteína. Es un ejemplo clásico de regulación génica que contribuye a la protección de la célula. En una amplia variedad de animales, incluyendo vertebrados e invertebrados, los genes de metalotioneína (Mt) son activados por un factor de transcripción llamado factor de transcripción 1 sensible a metales (MTF-1). MTF -1 se une a los llamados elementos sensibles a metales (MREs) en el promotor de Mt. Los MRE son motivos cortos con una secuencia característica de pares de bases que forman el núcleo de un sitio de unión al factor de transcripción en el ADN. En condiciones fisiológicas normales, MTF-1 es inactivo e incapaz de inducir Mt. Sin embargo, puede ser activado por iones Zn 2+, los cuales son liberados, de ligandos no especificados, por metales como el cadmio que pueden reemplazar al zinc (Figura 3).
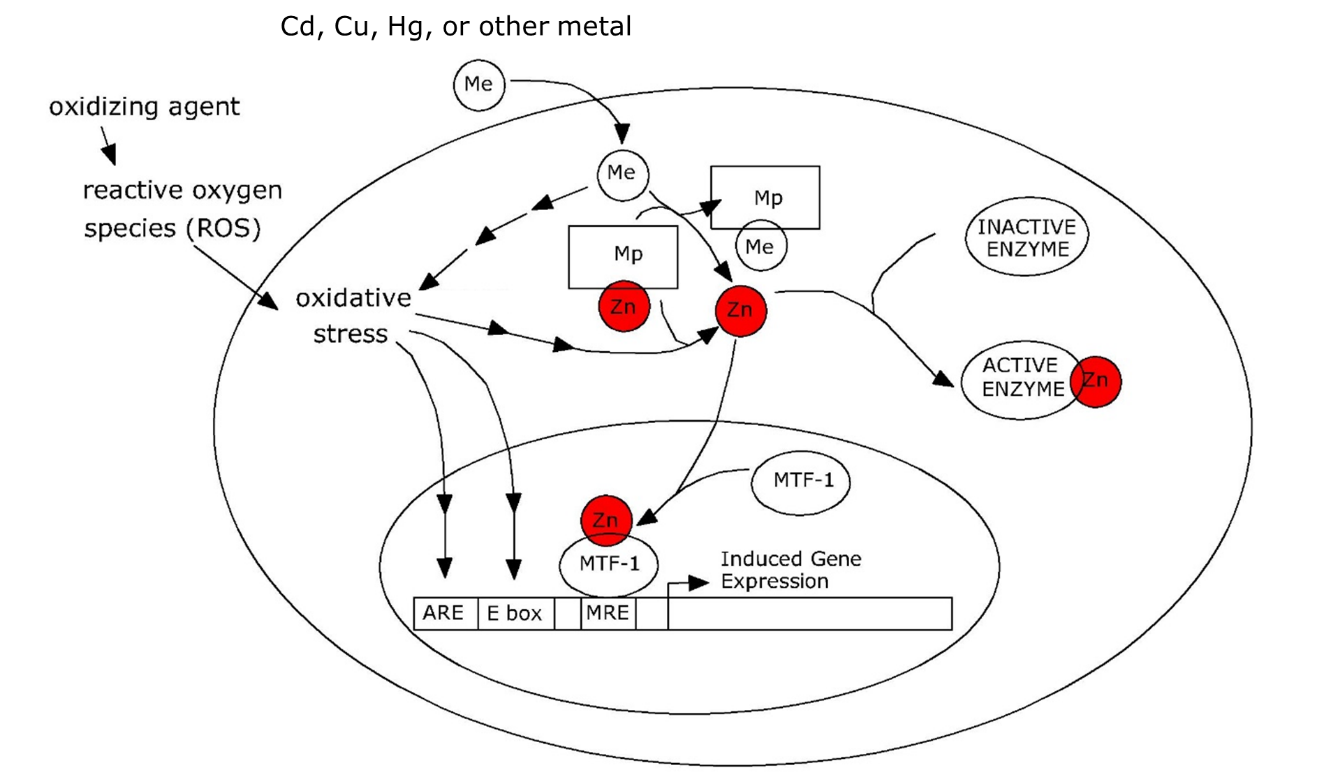
Debe enfatizarse que el modelo discutido anteriormente está inspirado en el trabajo sobre vertebrados. Los artrópodos (Drosophila, Orchesella, Daphnia) podrían tener un mecanismo similar ya que también tienen un homólogo de MTF-1 que activa el Mt, sin embargo, la situación para otros invertebrados como anélidos y gasterópodos no está clara; sus genes Mt parecen carecer de MRE, a pesar de ser inducibles por el cadmio. Además, la variabilidad de metalotioneínas en invertebrados es extremadamente grande y no todas las proteínas de unión a metales pueden ser ortólogos de la metalotioneína de vertebrado. En los caracoles, un MT inducido por cadmio que se une a cadmio funciona junto con un MT de unión a cobre, mientras que los dos MT tienen diferentes distribuciones tisulares y también están regulados de manera bastante diferente.
Si bien tanto la fitoquelatina como la metalotioneína secuestrarán metales esenciales y no esenciales (por ejemplo, Cd) y así contribuirán a la desintoxicación, la presencia generalizada de estos sistemas a lo largo del árbol de la vida sugiere que no evolucionaron principalmente para hacer frente a la contaminación antropogénica por metales. La inducibilidad muy fuerte de estos sistemas por elementos no esenciales como el cadmio puede considerarse un efecto secundario de una función primaria diferente, por ejemplo la regulación del estado redox celular o la unión de metales esenciales.
Órganos objetivo
Cualquier acumulación específica de tejidos de metales puede explicarse por el recambio de ligandos de unión a metales. Por ejemplo, la acumulación de cadmio en riñón de mamífero se debe a que la metalotioneína cargada con cadmio no puede ser excretada. Las altas concentraciones de metales en los segmentos posteriores de las lombrices de tierra se deben a la presencia de “cuerpos residuales” que están completamente llenos de gránulos intracelulares. La acumulación de cadmio en la postrada humana se debe a la alta concentración de citrato de zinc en este órgano, que sirve para proteger de la oxidación a las proteínas contráctiles en las colas de los espermatozoides; el cadmio supuestamente ingresa al postrado a través de transportadores de zinc.
A menudo se afirma que los metales esenciales están sujetos a mecanismos regulatorios, lo que implicaría que su carga corporal, sobre una amplia gama de exposiciones externas, es constante. Sin embargo, no todos los metales “esenciales” están regulados en la medida en que la concentración de todo el cuerpo se mantiene constante. Muchos invertebrados tienen compartimentos corporales asociados con el intestino (glándula del intestino medio, hepatopáncreas, túbulos malpighianos) en los que los metales, a menudo en forma de concreciones minerales, se inactivan y almacenan permanentemente o se intercambian muy lentamente con el charco activo. Dado que estos compartimentos están fuera del alcance de los mecanismos reguladores pero generalmente no están separados en el análisis de metales de todo el cuerpo, la carga corporal en su conjunto no es constante. Algunos invertebrados incluso llevan una “mochila” de metales que se acumulan a lo largo de la vida. Esto es válido, por ejemplo, para zinc en percebes, cobre en isópodos y zinc en lombrices de tierra.
La acumulación de metales en los órganos diana puede provocar toxicidad cuando se agota la capacidad crítica de unión o excreción y los iones metálicos comienzan a unirse específicamente a los constituyentes celulares. El órgano en el que esto sucede a menudo se llama el órgano diana. La concentración total de metal a la que la toxicidad comienza a hacerse evidente se denomina concentración corporal crítica (CBC) o concentración crítica en el tejido. Por ejemplo, se estima que la concentración crítica de cadmio en riñón, por encima de la cual se observa daño renal, es de 50 μg/g En la Tabla 1 se da una lista de órganos críticos para metales en el cuerpo humano.
El concepto de CBC asume que la carga completa de metal en un órgano está en equilibrio con la fracción activa que causa toxicidad y que no hay charco de almacenamiento permanente. En el caso de la desintoxicación por almacenamiento, la carga corporal a la que aparece la toxicidad dependerá del historial de acumulación.
Cuadro 1. Órganos críticos para la toxicidad crónica de metales en el cuerpo humano
|
Metal o metaloide |
Órgano crítico |
Síntomas |
|
Al |
Cerebro |
Enfermedad de Alzheimer |
|
Como |
Pulmón, hígado, corazón, intestino |
Alteración de energía multisistema |
|
Cd |
Riñón, hígado |
Daño renal |
|
Cr |
Piel, pulmón, intestino |
Daño del sistema respiratorio |
|
Cu |
Hígado |
Daño hepático |
|
Hg |
Cerebro, hígado |
Enfermedad mental |
|
Ni |
Piel, riñón |
Reacción alérgica, daño renal |
|
Pb |
Médula ósea, sangre, cerebro |
Anemia, retraso mental |
Referencias
Cobbett, C., Goldsbrough, P. (2002). Fitoquelatinas y metalotioneínas: papeles en la desintoxicación y homeostasis de metales pesados. Revisión Anual de Biología Vegetal 53, 159-182.
Dallinger, R., Berger, B., Hunziker, P., Kägi, J.H.R. (1997). Metalotioneína en el metabolismo de Cd y Cu de caracol. Naturaleza 388, 237-238.
Dallinger, R., Höckner, M. (2013). Conceptos evolutivos en ecotoxicología: trazando el trasfondo genético de sensibilidades diferenciales al cadmio en linajes invertebrados. Ecotoxicología 22, 767-778.
Haq, F., Mahoney, M., Koropatnick, J. (2003) Eventos de señalización para la inducción de metalotioneína. Investigación de Mutación 533, 211-226.
Hopkin, S.P. (1989) Ecofisiología de Metales en Invertebrados Terrestres. Londres, Elsevier Ciencias Aplicadas.
Nieboer, E., Richardson, D.H.S. (1980) La sustitución del término anodino “metales pesados” por una clasificación biológica y químicamente significativa de iones metálicos. Contaminación Ambiental Serie B 1, 3-26.
Rainbow, P.S. (2002) Concentraciones de metales traza en invertebrados acuáticos: ¿por qué y entonces qué? Contaminación Ambiental 120, 497-507.
Mencionar los cuatro principales constituyentes celulares inorgánicos que unen los metales, su composición elemental principal e indican qué metales suelen estar unidos en cada estructura.
¿Cómo se pueden ajustar los niveles intracelulares de moléculas depuradoras de metales como la metalotioneína (MT) y la fitoquelatina (PC) para contrarrestar los posibles efectos adversos de los iones metálicos libres? Describir el mecanismo molecular de metalotioneína y fitoquelatina por separado.
- Mencionar tres órganos del cuerpo humano susceptibles a la intoxicación por metales y a qué metales son particularmente sensibles.
4.1.4. Defensa xenobiótica y metabolismo
Autor: Nico M. van Straalen
Críticos: Timo Hamers, Cristina Fossi
Objetivos de aprendizaje:
Deberías ser capaz de:
- recapitular los mecanismos de fase I, II y III para el metabolismo xenobiótico, y los sistemas moleculares más importantes involucrados.
- describir el destino y los cambios químicos de un compuesto orgánico que es metabolizado por el cuerpo humano, desde la absorción hasta la excreción.
- explicar el principio de activación metabólica y por qué algunos compuestos pueden volverse muy reactivos con el metabolismo xenobiótico.
- desarrollar una hipótesis sobre los efectos ecológicos de compuestos xenobióticos que requieren activación metabólica.
Keywords: biotransformación; fase 1; fase II; fase III; excreción; activación metabólica; citocromo P450
Sinopsis
Todos los organismos están equipados con mecanismos de defensa metabólica para tratar con compuestos extraños. Las reacciones involucradas, llamadas conjuntamente biotransformación, pueden dividirse en tres fases, y suelen tener como objetivo aumentar la solubilidad en agua y la excreción. El primer paso (fase I) es catalizado por el citocromo P450, el cual es seguido por una variedad de reacciones de conjugación (fase II) y excreción (fase III). Las enzimas y transportadores involucrados son a menudo altamente inducibles, es decir, la cantidad de proteína se ve potenciada en gran medida por los propios compuestos xenobióticos. La inducción implica la unión del compuesto a proteínas receptoras citoplásmicas, como el receptor de arilhidrocarburo (AhR), o el receptor constitutivo de androstano (CAR). En algunos casos los metabolitos intermedios, producidos en la fase I, son extremadamente reactivos y una causa principal de toxicidad, siendo un ejemplo bien conocido la activación metabólica de hidrocarburos aromáticos policíclicos como el benzo (a) pireno, que forma fácilmente aductos de ADN y causa cáncer. Además, algunos compuestos inducen en gran medida a las enzimas metabolizantes pero apenas son degradados por ellos y causan estrés celular crónico. Las diversas reacciones de biotransformación son un aspecto crucial tanto de la toxicocinética como de la toxicodinámica de los xenobióticos.
Introducción
El término “xenobiótico” (“ajeno a la biología”) se usa generalmente para indicar un compuesto químico que normalmente no tiene una función metabólica. Utilizaremos el término extensamente en este módulo, a pesar de que es algo problemático (e.g., ¿un compuesto puede considerarse “extraño” si circula en el cuerpo, se metaboliza o se degrada en el cuerpo? , y: lo que es “extraño” para una especie no es necesariamente “extraño” para otra especie).
El cuerpo cuenta con un amplio sistema de defensa para tratar compuestos xenobióticos, débilmente designados como biotransformación. El resultado final de este sistema es la excreción del compuesto de alguna forma u otra. Sin embargo, muchos xenobióticos son bastante lipofílicos, tienden a acumularse y no se excretan fácilmente debido a la baja solubilidad en agua. Por lo general, se requieren modificaciones moleculares antes de que dichos compuestos puedan eliminarse del cuerpo, ya que los principales sistemas circulatorio y excretor (sangre, orina) son a base de agua. Al introducir grupos hidrófilos en la molécula (-OH, =O, -COOH) y conjugarlo a un compuesto endógeno con buena solubilidad en agua, se suele lograr la excreción. Sin embargo, como veremos a continuación, los metabolitos intermedios pueden tener una reactividad potenciada y a menudo sucede que un compuesto se vuelve más tóxico mientras se metaboliza. En el caso de los plaguicidas, se hace uso deliberado de tales respuestas, para aumentar la toxicidad de un insecticida una vez que se encuentra en el organismo diana.
El estudio del metabolismo xenobiótico es un tema clásico no sólo en toxicología sino también en farmacología. El modo de acción de un fármaco a menudo depende críticamente de la velocidad y el modo de metabolismo. Además, muchos fármacos muestran efectos secundarios tóxicos como consecuencia del metabolismo. Finalmente, el metabolismo xenobiótico también se estudia extensamente en entomología, ya que tanto la toxicidad como la resistencia de los pesticidas suelen estar mediadas por el metabolismo.
Los xenobióticos más problemáticos son aquellos con un alto coeficiente de reparto octanol-agua (K ow) que son fuertemente lipofílicos y muy hidrófobos. Suelen acumularse, en proporción a su Log K ow, en tejidos con un alto contenido lipídico como la subcutis de vertebrados, y pueden causar daño tisular por alteración de las funciones de la membrana. Este modo de acción se denomina “toxicidad mínima”. Son bien conocidos los compuestos de petróleo alifáticos de bajo peso molecular y los alcanos clorados como el cloroformo. Estos compuestos causan su daño primario a las membranas celulares; especialmente las neuronas son sensibles a este efecto, de ahí que la toxicidad mínima también se denomina toxicidad narcótica. Los químicos lipofílicos con Log K ow alto no alcanzan concentraciones lo suficientemente altas como para causar toxicidad mínima porque inducen biotransformación a concentraciones más bajas. La toxicidad generalmente se debe entonces a un metabolito reactivo.
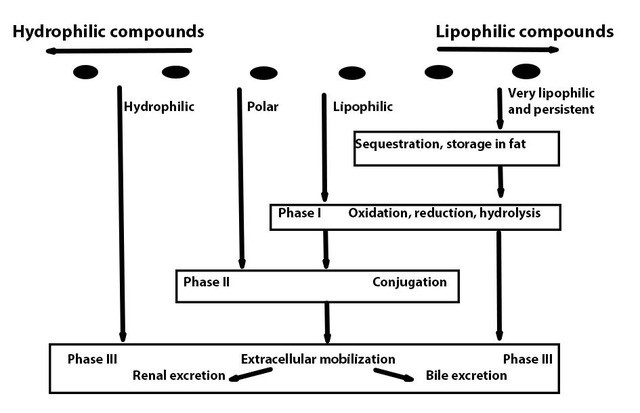
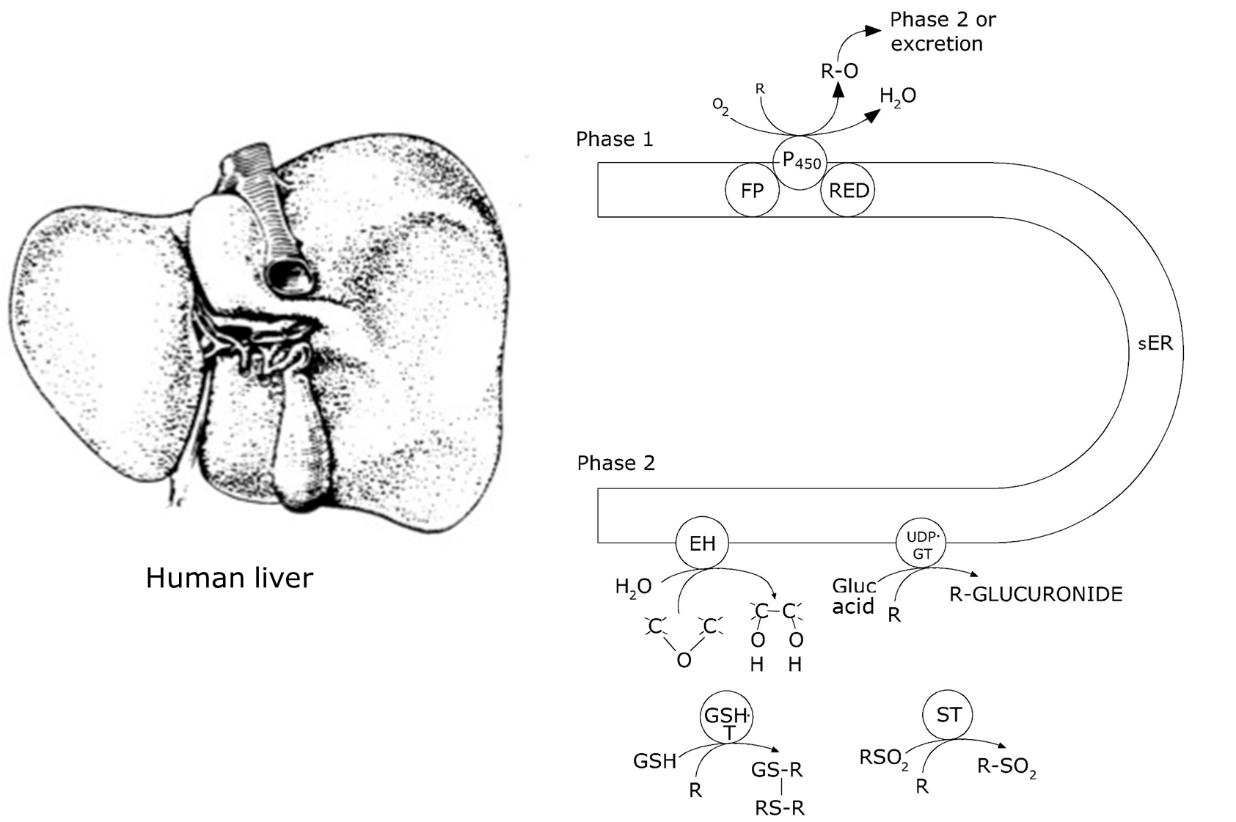
El metabolismo xenobiótico implica tres fases posteriores (Figura 1):
- Activación (generalmente oxidación) del compuesto por una enzima conocida como citocromo P450, que actúa en cooperación con NADPH citocromo P450 reductasa y otros factores.
- Conjugación del producto activado de la fase I a un compuesto endógeno. Un anfitrión de diferentes enzimas está disponible para esta tarea, dependiendo del compuesto, el tejido y la especie. También hay compuestos (ligeramente polares) que entran directamente en la fase II, sin ser activados en la fase I.
- Excreción del compuesto en circulación, orina u otros medios, generalmente por medio de transportadores que atraviesan la membrana pertenecientes a la clase de transportadores de casete de unión a ATP (ABC), incluyendo las infames proteínas multirresistentes. Los compuestos hidrofílicos pueden pasar directamente a la fase III, sin ser activados o conjugados.
Reacciones de Fase I
El citocromo P450 es una enzima unida a la membrana, asociada con el retículo endoplásmico liso. Lleva un anillo de porfirina que contiene un átomo de Fe, que es el centro activo de la molécula. La designación P450 se deriva del hecho de que muestra un máximo de absorción a 450 nm cuando es inhibido por el monóxido de carbono, un método ahora anticuado para demostrar su presencia. Otros nombres (obsoletos) son MFO (oxigenasa de función mixta) y complejo enzimático metabolizador de fármacos. El citocromo P450 está codificado por un gen llamado CYP, del cual hay muchos parálogos en el genoma, todos ligeramente diferentes entre sí en términos de inducibilidad y especificidad de sustrato. Tres clases de genes CYP están involucrados en la biotransformación, denominados CYP1, CYP2 y CYP3 en vertebrados. Cada clase tiene varias isoformas; el genoma humano tiene 57 genes CYP diferentes en total. El complemento CYP de invertebrados y plantas a menudo involucra aún más genes; muchos linajes evolutivos tienen su propio conjunto, que surgen de extensas duplicaciones de genes dentro de ese linaje. En humanos, el complemento genético de los genes CYP de una persona es altamente relevante en cuanto a su perfil metabolizador de fármacos (ver la sección Variación genética en el metabolismo tóxico).
El citocromo P450 opera en conjunto con una enzima llamada NADPH citocromo P450 reductasa, que consiste en dos flavoproteínas, una que contiene dinucleótido de flavina adenina (FAD) y la otra mononucleótido de flavina (FMN). El átomo reducido de Fe 2+ en el citocromo P450 se une al oxígeno molecular, y se oxida a Fe 3+ mientras se divide O 2; un átomo de O se introduce en el sustrato, el otro reacciona con hidrógeno para formar agua. Entonces la enzima se reduce aceptando un electrón de citocromo P450 reductasa. La reacción general se puede escribir como:
RH + O 2 + NADPH + H + → ROH + H 2 O + NADP +
donde R es un sustrato arbitrario.
El citocromo P450 se expresa en gran medida en hepatocitos (células hepáticas), siendo el hígado el órgano principal para el metabolismo xenobiótico en vertebrados (Figura 2), pero también está presente en los epitelios del pulmón y el intestino. En los insectos la actividad es particularmente alta en los túbulos malpighianos además del intestino y el cuerpo graso. En moluscos y crustáceos el principal órgano metabólico es el hepatopáncreas.
Reacciones de Fase II
Después de la activación por el citocromo P450, el sustrato oxidado está listo para conjugarse con un compuesto endógeno, por ejemplo, un grupo sulfato, glucosa, ácido glucurónico o glutatión. Estas reacciones son conducidas por una variedad de enzimas diferentes, de las cuales algunas residen en el SeR como P450, mientras que otras se localizan en el citoplasma de la célula (Figura 2). La mayoría de ellos transfieren un grupo hidrófilo, disponible desde el metabolismo intermedio, al sustrato, de ahí que las enzimas se llamen transferasas. Por lo general, el compuesto se vuelve más polar en la fase II, sin embargo, no todas las reacciones de fase II aumentan la solubilidad en agua; por ejemplo, la metilación (por metiltransferasa) disminuye la reactividad pero aumenta la apolaridad. Otras reacciones de fase II son la conjugación con glutatión, conducida por glutatión-S-transferasa (GST) y con ácido glucurónico, realizada por UDP-glucuronil transferasa. En invertebrados pueden dominar otras conjugaciones, por ejemplo, en artrópodos y plantas, la conjugación con malonil glucosa es una reacción común, que no se ve en vertebrados.
La conjugación con glutatión en el cuerpo humano suele ir seguida por la división del ácido glutámico y la glicina, dejando solo el residuo de cisteína en el sustrato. Posteriormente, la cisteína se acetila, formando así un llamado ácido mercaptúrico. Este es el tipo de metabolito más común para muchos xenobióticos excretados en la orina por los humanos.
Al igual que el citocromo P450, las enzimas de fase II consisten en diversas isoformas, codificadas por diferentes parálogos en el genoma. Especialmente la familia GST es bastante extensa y los polimorfismos en estos genes contribuyen significativamente al perfil metabólico personal (ver la sección Variación genética en el metabolismo tóxico).
Reacciones de fase III
En el cuerpo humano, existen dos vías principales para la excreción, una desde el hígado hacia la bilis (y más hacia el intestino y las heces), la otra a través del riñón y la orina. Estas dos vías son utilizadas por diferentes clases de xenobióticos: compuestos muy hidrófobos como los hidrocarburos aromáticos policíclicos de alto peso molecular aún no son fácilmente solubles en agua incluso después del metabolismo, pero pueden ser emulsionados por la sal biliar y excretados de esta manera. A veces sucede que tales compuestos, una vez que llegan al intestino, son asimilados nuevamente, transportados al hígado por la vena porta y metabolizados nuevamente. A esto se le llama “circulación entero-hepática”. Los compuestos de menor peso molecular y los compuestos hidrófilos se excretan a través de la orina Los compuestos volátiles pueden salir del cuerpo a través de la piel y el aire exhalado.
La excreción de compuestos activados y conjugados de tejidos fuera de la célula generalmente requiere transporte activo, el cual está mediado por transportadores ABC (casete de unión a ATP), una familia muy grande y diversa de proteínas de membrana que tienen en común un casete de unión para ATP. Diferentes subgrupos de transportadores de ATP transportan diferentes tipos de químicos, por ejemplo, moléculas hidrófobas cargadas positivamente, moléculas neutras y compuestos aniónicos solubles en agua. Un grupo bien conocido consiste en proteínas multirresistentes o P-glicoproteínas. Estos transportadores exportan fármacos con el objetivo de atacar las células tumorales. Debido a que su actividad es altamente inducible, estas proteínas pueden potenciar enormemente la excreción, haciendo que la célula sea efectivamente resistente y, por lo tanto, plantear problemas importantes para el tratamiento del cáncer.
Inducción
Todas las enzimas del metabolismo xenobiótico son altamente inducibles: su actividad normalmente se encuentra en un nivel bajo pero se ve muy potenciada en presencia de xenobióticos. Esto se logra a través de un caso clásico de regulación transcripcional sobre CYP y otros genes, lo que lleva a la síntesis de novo de proteínas. Además, puede ocurrir una proliferación extensa del retículo endoplásmico, y en casos extremos incluso hinchazón del hígado (hepatomegalia).
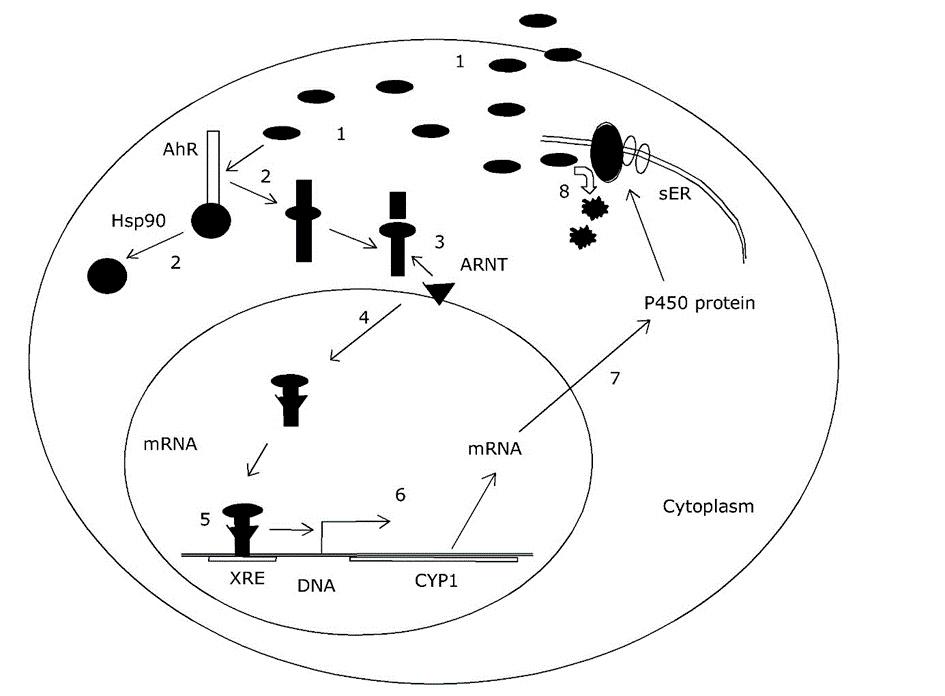
La mejor vía investigada para la activación transcripcional de los genes CYP se debe al receptor arilhidrocarbonado (AhR). En condiciones normales, este péptido se estabiliza en el citoplasma por proteínas de choque térmico, sin embargo, cuando un compuesto xenobiótico se une a AhR, se activa y puede unirse con otra proteína llamada translocador nuclear del receptor Ah (ARNT) para translocarse al núcleo y unirse a elementos de ADN presentes en el promotor de CYP y otros genes. Actúa así como activador transcripcional o factor de transcripción sobre estos genes (Figura 3). Los motivos de ADN a los que se une AhR se denominan elementos sensibles a xenobióticos (XRE) o elementos sensibles a dioxinas (DRE). Los compuestos que actúan de esta manera se denominan inductores de tipo 3-MC, siguiendo el compuesto modelo (altamente cancerígeno) 3-metilcolantreno. La capacidad inductora de un compuesto está relacionada con su afinidad de unión al AhR, que en sí mismo está determinada por la estructura espacial de la molécula. El ajuste de bloqueo y clave entre AhR y xenobióticos explica por qué la inducción de biotransformación por xenobióticos muestra una estereoespecificidad muy fuerte. Por ejemplo, entre los bifenilos clorados y las dibenzodioxinas cloradas, algunos compuestos son inductores extremadamente fuertes de los genes CYP1, mientras que otros, incluso con el mismo número de átomos de cloro, no son inductores en absoluto. La posición precisa de los átomos de cloro determina el “ajuste” molecular en el receptor Ah (ver Sección sobre la interacción del receptor).
Además del tipo 3MC de inducción existen otros modos en los que se inducen enzimas de biotransformación, pero éstas son menos conocidas. Una clase común es la inducción tipo PB (llamada así por otro compuesto modelo, el fenobarbital). La inducción tipo PB no es dependiente de AHR, sino que actúa a través de la activación de otro receptor nuclear, llamado receptor constitutivo de androstano (CAR). Este receptor activa los genes CYP2 y algunos genes CYP3.
La alta inducibilidad de la biotransformación se puede explotar de manera inversa: si se ve que la biotransformación está altamente regulada al alza en una especie que vive en el ambiente, esto indica que esa especie está siendo expuesta a compuestos xenobióticos. Por lo tanto, los ensayos que abordan la actividad del citocromo P450 pueden explotarse en sistemas de bioindicación y biomonitorización. El ensayo EROD (etoxiresorufina-O-deetilasa) se utiliza a menudo para este propósito, aunque no es 100% específico de la isoforma de P450. Otro enfoque es abordar la expresión de CYP directamente, por ejemplo, a través de PCR cuantitativa de transcripción inversa, un método para cuantificar la cantidad de ARNm de CYP.
Efectos secundarios de la biotransformación
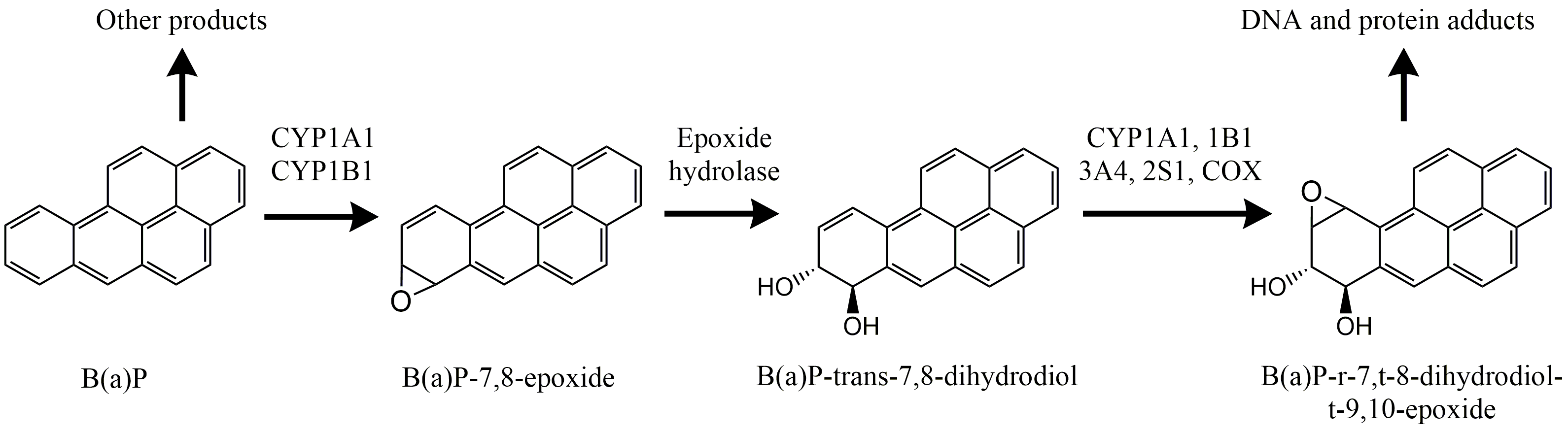
Aunque el objetivo principal del metabolismo xenobiótico es desintoxicar y excretar compuestos extraños, algunas vías de biotransformación realmente mejoran la toxicidad. Esto se debe principalmente al primer paso, la activación por el citocromo P450. La activación puede conducir a metabolitos intermedios que son altamente reactivos y la causa real de toxicidad. Los mejores ejemplos investigados se deben a la bioactivación de hidrocarburos aromáticos policíclicos (HAP), un grupo de químicos presentes en diesel, hollín, humo de cigarrillo y productos alimenticios carbonizados. Muchos de estos compuestos, por ejemplo benzo (a) pireno, benz (a) antraceno y 3-metilcolantreno, no son reactivos ni tóxicos como tales sino que son activados por el citocromo P450 a moléculas extremadamente reactivas. El benzo (a) pireno, por ejemplo, se activa a un diol-epóxido, que se une fácilmente al ADN, especialmente al grupo amino libre de la guanina (Figura 4). El complejo se llama aducto de ADN, la doble hélice se interrumpe localmente y esto da como resultado una mutación. Si esto ocurre en un oncogén, se puede desarrollar un tumor (ver la Sección de Carcinogénesis y genotoxicidad).
No todos los HAP son cancerígenos. Su actividad depende críticamente de la estructura espacial de la molécula, que nuevamente determina su “ajuste” en el receptor Ah. Los HAP con una “muesca” (a menudo llamada región bahía) en la molécula tienden a ser carcinógenos más fuertes que los compuestos con una estructura molecular simétrica (redonda o lineal).
Otro mecanismo de toxicidad inducida por biotransformación se debe a algunos compuestos organoclorados muy recalcitrantes como las dibenzodioxinas policloradas (PCDD, o dioxinas para abreviar) y los bifenilos policlorados (PCB). Algunos de estos compuestos son inductores muy potentes de la biotransformación, pero apenas se degradan ellos mismos. La consecuencia es que la actividad altamente regulada del citocromo P450 continúa generando una gran cantidad de oxígeno reactivo (ROS), causando estrés oxidativo y daño a los constituyentes celulares. Se supone que la toxicidad crónica de 2,3,7,8-tetraclorodibenzo (para) dioxina (TCDD), uno de los compuestos más tóxicos que emite la actividad humana, se debe a su alta capacidad para inducir estrés oxidativo prolongado. A nivel molecular, existe una estrecha relación entre el estrés oxidativo y la actividad de biotransformación. Muchos tóxicos que inducen principalmente estrés oxidativo (por ejemplo, cadmio) también aumentan las enzimas CYP. Dos mecanismos de defensa, la defensa del estrés oxidativo y la biotransformación forman parte del mismo sistema integrado de defensa contra el estrés de la célula.
Referencias
Bui, P.H., Hsu, E.L., Hankinson, O. (2009), Los hidroperóxidos de ácidos grasos apoyan la bioactivación mediada por el citocromo P450 2S1 de benzo [a] pireno-7-8-dihidrodiol. Farmacología Molecular 76, 1044-1052.
Stroomberg, G.J., Zappey, H., Steen, R.J.C.A., Van Gestel, C.A.M., Ariese, F., Velthorst, N.H., Van Straalen, N.M. (2004). Biotransformación de PAH en invertebrados terrestres - un nuevo metabolito de fase II en isópodos y coléculos. Bioquímica y Fisiología Comparada Parte C 138, 129-137.
Timbrell, J.A. (1982). Principios de Toxicología Bioquímica. Taylor & Francis Ltd, Londres.
Van Straalen, N.M., Roelofs, D. (2012). Una introducción a la genómica ecológica, 2ª Ed. Oxford University Press, Oxford.
Vermeulen, N.P.E., Van den Broek, J.M. (1984). Opname es verwerking van chemicaliën en de mens. Revista Chemisch. Maart: 167-171.
Describir los principales procesos involucrados en cada una de las tres fases generales del metabolismo xenobiótico, así como los sistemas moleculares involucrados.
La regulación positiva de la actividad del citocromo P450 es un ejemplo clásico de regulación a través de la síntesis mejorada de novo de la enzima. El mecanismo es conocido con bastante detalle e involucra una variedad de componentes. Describir la implicación de los siguientes componentes
- Receptor de hidrocarburos arílicos
- Proteína de choque térmico 70
- Translocador nuclear del receptor de arilhidrocarburo
- Elementos de respuesta xenobiótica
- Gen CYP1A1
- ARNm de CYP1A1
- Proteína CYP 1A1
- Actividad enzimática del CYP 1A1
En el pasado, la actividad del citocromo P450 a menudo se evaluó utilizando un sustrato fluorescente sintético, la resorufina; la actividad se midió como etoxiresorufina-O-deetilasa (EROD). Discutir las ventajas y desventajas del uso de dicho ensayo en la evaluación de riesgos ambientales.
4.1.5. Relaciones alométricas
Autor: A. Jan Hendriks
Revisores: Nico van den Brink, Nico van Straalen
Objetivos de aprendizaje:
Deberías ser capaz de
- explicar por qué la alometría es importante en la evaluación de riesgos entre químicos y especies
- resumir cómo las características biológicas tales como consumo, vida útil y tamaño de la escala de abundancia
- describir cómo las cantidades toxicológicas, como las tasas de absorción y las concentraciones letales, se escalan
Palabras clave: tamaño corporal, propiedades biológicas, descamación, extrapolación entre especies, cinética de absorción relacionada con el tamaño
Introducción
A nivel mundial se han registrado más de 100,000,000 químicos. En la Unión Europea más de 100 mil compuestos están a la espera de evaluación de riesgos para proteger el ecosistema y la salud humana, mientras que 1,500,000 sitios contaminados potencialmente requieren limpieza. De igual manera, 8 mil millones de especies, de las cuales 10 mil están en peligro de extinción, necesitan protección a nivel mundial, con una perdida por hora (Hendriks, 2013). Debido a limitaciones financieras, prácticas y éticas (bienestar animal), los estudios empíricos por sí solos no pueden abarcar tantas sustancias y especies, y mucho menos sus combinaciones. En consecuencia, el enfoque tradicional de las pruebas ecotoxicológicas se complementa gradualmente o se sustituye por enfoques de modelización. Los químicos ambientales y toxicólogos desde hace mucho tiempo han desarrollado relaciones que permiten la extrapolación entre químicos. Hoy en día, las llamadas Relaciones Estructura-Actividad Cuantitativas (QSARs) proporcionan estimaciones de acumulación y toxicidad para compuestos basados en sus propiedades físico-químicas. Por ejemplo, los factores de bioacumulación y las concentraciones letales medias se han relacionado con el tamaño molecular y el reparto octanol-agua, propiedades características de una sustancia química que suelen estar disponibles en su proceso de producción industrial.
En analogía con el enfoque QSAR en química ambiental, se puede preguntar si es posible predecir las características toxicológicas, fisiológicas y ecológicas de las especies a partir de rasgos biológicos, especialmente rasgos que se miden fácilmente, como el tamaño corporal. Este enfoque ha pasado bajo el nombre de “Relaciones Cuantitativas de Sensibilidad a las Especies” (QSSR) (Notenboom, 1995).
Entre los diversos rasgos disponibles, el tamaño corporal es de particular interés. Se mide fácilmente y gran parte de la variabilidad entre organismos se puede explicar a partir del tamaño corporal, con r 2 > 0.5. No es sorprendente que el tamaño corporal también juegue un papel importante en toxicología y farmacología. Por ejemplo, los criterios de valoración tóxicos, como LC 50 s, a menudo se expresan por kg de peso corporal. Los valores de ingesta diaria recomendados asumen un peso corporal “estándar”, a menudo 60 kg. Sin embargo, los humanos adultos pueden diferir en peso corporal por un factor de 3 y la diferencia entre ratón y humano es aún mayor. Aquí se explorará cómo las relaciones cuerpo-tamaño, que se han estudiado en biología comparada desde hace mucho tiempo, afectan la extrapolación en toxicología y pueden ser utilizadas para extrapolar entre especies.
Fundamentos del escalamiento en biología
¿Esperas que un elefante de 10 4 kg coma 10 4 veces más de un conejo de 1 kg al día? ¿O menos, o más? Al ser preguntado, a la mayoría de la gente se le ocurre intuitivamente la respuesta correcta. En efecto, el consumo diario por parte del probóscide es menor que 10 4 veces el del roedor. En consecuencia, la cantidad de alimento o agua utilizada por kilogramo de peso corporal del elefante es menor que la del conejo. Sin embargo, ¿cuánto menos exactamente? Y ¿por qué sostener 1 kg de tejido de conejo debería requerir más energía que 1 kg de carne de elefante en primer lugar?
Un siglo de investigación (Peters, 1983) ha demostrado que muchas características biológicas Y escalan al tamaño X de acuerdo con una función de potencia:
Y = a X b
donde la variable independiente X representa la masa corporal, y la variable dependiente Y puede ser prácticamente cualquier característica de interés que va, por ejemplo, desde el área branquial de los peces hasta la densidad de insectos en una comunidad.
Trazada en una gráfica, la ecuación produce una línea curva, aumentando superlinealmente si b > 1 y sublinealmente si b < 1. Si b=1, Y y X son directamente proporcionales y la relación se llama isométrica. Como las líneas curvas son difíciles de interpretar, la ecuación a menudo se simplifica tomando el logaritmo de las partes izquierda y derecha. La fórmula entonces se convierte en:
log Y = log a + b log X
Cuando se traza log Y contra log X, se obtiene una línea recta con pendiente b e intercepción log a.Si los datos se trazan de esta manera, el parámetro de pendiente b puede estimarse mediante regresión lineal simple.
A través de amplios rangos de tamaño, la pendiente b a menudo resulta ser una multitud de ¼ o, ocasionalmente, ⅓. Las tasas [kg∙d -1] de consumo, crecimiento, reproducción, supervivencia y lo que no, aumentan con la masa a la potencia ¾, mientras que las constantes de tasa, a veces llamadas tasas específicas [kg∙kg -1 ∙d -1], disminuyen con la masa a la potencia -¼. Entonces, mientras que el elefante pesa 10 4 kg más que el conejo de 1 kg, come solo (10 4) ¾ = 10 3 veces más cada día. Viceversa, 1 kg de probóscide aparentemente requiere un consumo de (10 4) -¼ kg∙kg -1 ∙d -1, es decir, 10 veces menos. Las variables con una dimensión de tiempo [d] como la vida útil o los períodos de oscilación depredador-presa escalan inversamente a las constantes de velocidad y, por lo tanto, cambian con la masa corporal a la potencia ¼. Entonces, un elefante se vuelve (10 4) ¼ = 10 veces mayor que un conejo. Abundancia, es decir, el número de individuos por superficie [m -2] disminuye con la masa corporal a la potencia -¾. Las áreas, como la superficie branquial o el rango del hogar, escalan inversamente a la abundancia, típicamente como masa corporal a la potencia ¾.
Ahora bien, ¿por qué sostener 1 kg de elefante requeriría 10 veces menos comida que 1 kg de conejo? Biólogos, farmacólogos y toxicólogos primero atribuyeron esta diferencia a las relaciones área-volumen. Si se comparan objetos de la misma forma pero de diferente tamaño, el volumen aumenta con la longitud a la potencia 3 y la superficie aumenta con la longitud a la potencia 2. Para una esfera con radio r, por ejemplo, el área A y el volumen V aumentan como A ~ r 2 y V ~ r 3, por lo que el área escala al volumen como A ~ r 2 ~ (V ⅓) 2 ~ V ⅔. Entonces, los animales más grandes tienen superficies relativamente más pequeñas, siempre y cuando la forma del organismo siga siendo la misma. Dado que muchos procesos biológicos, como la absorción de oxígeno y alimentos o la pérdida de calor, tratan las superficies, se pensó que el metabolismo se ralentizaba, por mucho tiempo, como estructuras geométricas, es decir, con multitudes de ⅓. Sin embargo, las regresiones empíricas, por ejemplo, la “curva ratón-elefante” desarrollada por Max Kleiber a principios de la década de 1930 muestran una pendiente universal de ¼ (Peters, 1983. Esto se conoció como la “ley de Kleiber”. Si bien los datos dejan pocas dudas de que este es el caso, no está del todo claro por qué debería ser ¼ y no ⅓. Se han propuesto varias explicaciones para la pendiente de ¼ pero continúa el debate sobre el valor exacto así como el mecanismo subyacente.
Aplicación de escalamiento en toxicología
Dado que las sustancias químicas son transportadas por flujos de aire y agua, y dentro del organismo por savia y sangre, también se espera que la toxicocinética y la toxicodinámica escalen a su tamaño. De hecho, los datos confirman que las constantes de la tasa de absorción y eliminación disminuyen con el tamaño, con un exponente de aproximadamente -¼ (Figura 1). Las pendientes varían alrededor de este valor, más aún para las regresiones que cubren rangos de tamaño pequeño y organismos fisiológicamente diferentes. La intercepción está determinada por las resistencias en capas de agua no agitadas y membranas a través de las cuales pasan las sustancias, así como por los retrasos en los flujos por los que son transportadas. Las resistencias dependen principalmente de la afinidad y tamaño molecular de los productos químicos, reflejados por, por ejemplo, el coeficiente de reparto octanol-agua K ow para productos químicos orgánicos o masa atómica para metales. El límite superior de la intercepción se establece por los retrasos impuestos por el consumo y, posteriormente, la egestión y excreción. El extremo inferior se determina por dilución de crecimiento. Tanto la absorción como la eliminación escalan a masa con el mismo exponente de manera que su relación, reflejando el factor de bioconcentración o biomagnificación en equilibrio, sea independiente del tamaño corporal.
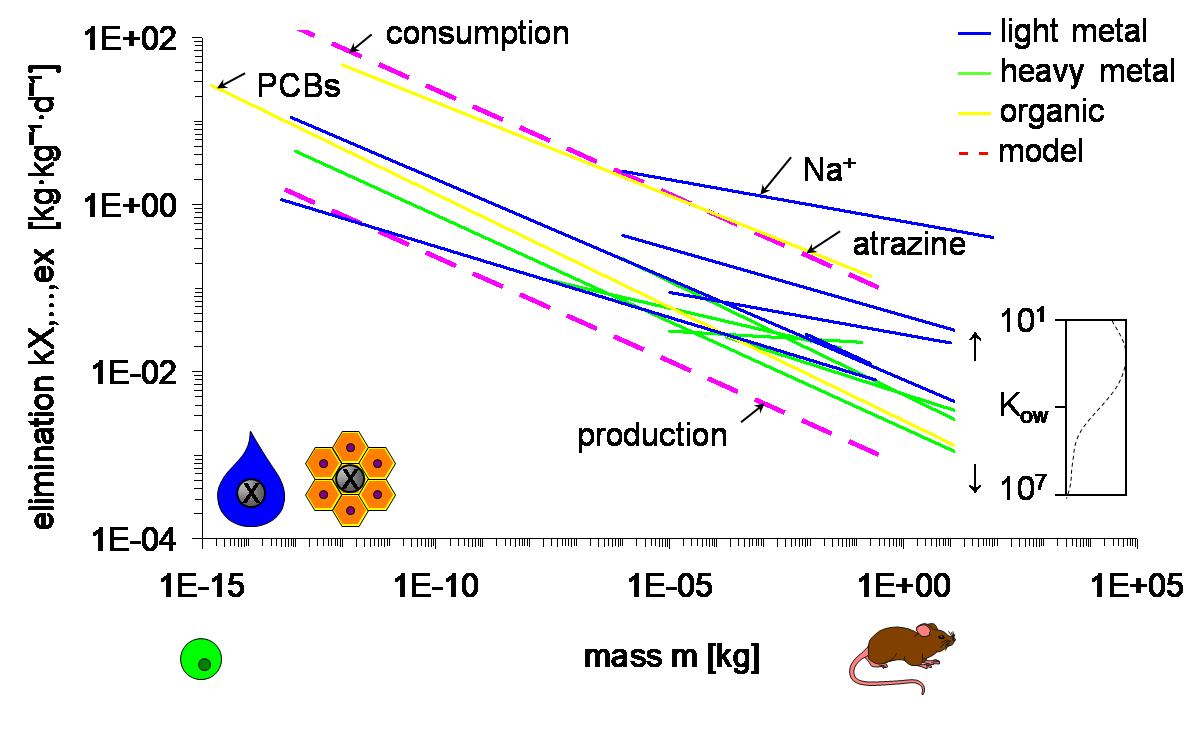
El escalado de las constantes de velocidad de captación y eliminación, como en la Figura 1, implica que los organismos pequeños alcanzan una concentración interna dada más rápido que los grandes. Por el contrario, las concentraciones letales en el agua o los alimentos necesarios para alcanzar el mismo nivel interno después de una duración de exposición igual (a corto plazo) son menores en comparación con los organismos más grandes. Así, la aparente “sensibilidad” de los dafnidos puede atribuirse, al menos parcialmente, a su pequeño tamaño corporal. Esto enfatiza la necesidad de comprender las relaciones de escalado simples antes de desarrollar explicaciones más elaboradas.
Usando la Figura 1, se puede, en condiciones estrictas no elaboradas aquí, teóricamente relacionar las concentraciones letales medias LC 50 [μg L -1] con el K ow del químico y el tamaño del organismo, con r 2 > 0.8 (Hendriks, 1995; Cuadro 1). Respuestas complicadas como la susceptibilidad a tóxicos se pueden predecir solo a partir de K ow y tamaño corporal, lo que ilustra la generalidad y el poder del escalado alométrico. Por supuesto, las regresiones describen las tendencias generales y en casos individuales las desviaciones pueden ser grandes. Aún así, considerando los desafíos de la evaluación de riesgos como se señaló anteriormente, y en ausencia de datos específicos, las predicciones en la Tabla 1 pueden considerarse como una primera aproximación razonable.
Cuadro 1. Concentraciones letales y dosis en función de la masa corporal del animal de prueba
|
Especies |
Endpoint |
Unidad |
b (IC 95%) |
r 2 |
n c |
n s |
Fuente |
|
Guppy |
LC 50 |
Mg∙l -1 |
0.66 (0.51-0.80) |
0.98 |
6 |
1 |
1 |
|
Mamíferos |
LD 10 ≈MTD |
mg∙animal -1 |
0.73 |
0.69‑0.77 |
27 |
5 |
2 |
|
Aves |
Oral LD 50 |
mg∙animal -1 |
1.19 (0.67-0.82) |
0.76 |
194 |
3... 37 |
3 |
|
Mamíferos |
Oral LD 50 |
mg∙animal -1 |
0.94 (1.18-1.20) |
0.89 |
167 |
3... 16 |
4 |
|
Mamíferos |
Oral LD 50 |
mg∙animal -1 |
1.01 (1.00-1.01) |
>5000 |
2... 8 |
5 |
MTD = dosis umbral máxima, dosificación repetida. LD 50 dosis única, b = pendiente de la línea de regresión, n c = número de sustancias químicas, n s = número de especies. Fuentes: 1 Anderson & Weber (1975), 2 Travis & White (1987), 4 Sample & Arenal (1999), 5 Burzala-Kowalczyk & Jongbloed (2011).
La alometría también es importante cuando se trata de otros niveles de organización biológica. El área foliar o branquial, el número de óvulos en los ovarios, el número de tipos celulares y muchas otras características celulares y de órganos también varían al tamaño corporal. Asimismo, las tasas intrínsecas de incremento (r) de las poblaciones y las relaciones producción-biomasa (P/B) de las comunidades también se pueden obtener a partir de la masa (promedio) de especies. Incluso el área que necesitan los animales en ensayos de laboratorio escala a su tamaño, es decir, en m ¾, aproximadamente la misma pendiente señalada para rangos hogareños de individuos en el campo.
Perspectivas de futuro
Dado que casi cualquier proceso fisiológico y ecológico en toxicocinética y toxicodinámica depende del tamaño de la especie, los modelos alométricos están ganando interés. Tal enfoque permite atribuir cuantitativamente valores atípicos (como los dafnidos aparentemente “sensibles”) a rasgos biológicos simples, en lugar de mecanismos químico-toxicológicos detallados.
El escalado se ha utilizado en la evaluación de riesgos a nivel molecular durante mucho tiempo. El tamaño molecular de un compuesto suele ser un descriptor en QSARs para acumulación y toxicidad. Si no inmediatamente evidente ya que la masa molecular, volumen o área a menudo aparece como un indicador de las propiedades estéricas. El escalado no solo se aplica a la bioacumulación y toxicidad desde el nivel molecular hasta el nivel comunitario, sino que también se observa dependencia del tamaño en otras secciones de la cadena causa-efecto ambiental. Las emisiones de sustancias, por ejemplo, escalan de manera no lineal al tamaño de motores y ciudades. Las concentraciones de químicos en los ríos dependen de la descarga de agua, que en sí misma es una función alométrica del tamaño de la cuenca. Por lo tanto, es probable que comprender los principios de la escala interdisciplinaria dé sus frutos al proteger a muchas especies contra muchos químicos.
Referencias
Anderson, P.D., Weber, L.J. (1975). Respuesta tóxica como función cuantitativa del tamaño corporal. Toxicología y Farmacología Aplicada 33, 471-483.
Burzala-Kowalczyk, L., Jongbloed, G. (2011). Escalado alométrico: Análisis de datos LD50. Análisis de Riesgo 31, 523-532.
Hendriks, A.J. (1995). Modelización de la respuesta de especies a microcontaminantes: Ecotoxicología comparada por cargas corporales (sub) letales en función del tamaño de las especies y la partición octanol-agua de los químicos. Ecotoxicología y Seguridad Ambiental 32, 103-130.
Hendriks, A.J. (2013). Cómo lidiar con más de 100.000 sustancias, sitios y especies: Principios generales en la evaluación de riesgos ambientales. Ciencia y Tecnología Ambiental 47, 3546−3547.
Hendriks, A.J., Van der Linde, A., Cornelissen, G., Sijm, D.T.H.M. (2001). El poder del tamaño: 1. Constantes de velocidad y relaciones de equilibrio para acumulación de sustancias orgánicas. Toxicología y Química Ambiental 20, 1399-1420.
Notenboom, J., Vaal, M.A., Hoekstra, J.A. (1995). Utilizando ecotoxicología comparativa para desarrollar relaciones cuantitativas de sensibilidad de especies (QSSR). Ciencia Ambiental e Investigación en Contaminación 2, 242-243.
Peters, R.H. (1983). Las implicaciones ecológicas del tamaño corporal. Cambridge University Press, Cambridge.
Muestra, B.E., Arenal, C.A. (1999) Modelos alométricos para extrapolación interespecies de datos de toxicidad de vida silvestre. Boletín de Contaminación Ambiental y Toxicología 62, 653-66.
Travis, C.C., White, R.K. (1988) Escala interespecífica de datos de toxicidad. Análisis de Riesgos 8, 119-125.
Piensa en un rasgo biológico que te interese. ¿Cómo crees que escalará al tamaño del organismo?
¿Cuál es la constante de velocidad de eliminación de un químico con un K ow de 10 4 de un insecto con una masa de 10 -5 kg?
¿Por qué el escalado de tamaño es más prominente en la toxicocinética que en la toxicodinámica?
4.1.6. Transferencia de cadena alimentaria
Autor: Nico van den Brink
Revisores: Kees van Gestel. Jan Hendriks
Objetivos de aprendizaje:
Deberías ser capaz de:
- Mencionar las propiedades químicas que determinan el potencial de los químicos para acumularse en las cadenas alimentarias
- Explicar el papel de los factores biológicos y ecológicos en la acumulación de productos químicos en la cadena alimentaria
Palabras clave: biomagnificación, transferencia de cadena alimentaria,
Acumulación de químicos a través de diferentes niveles tróficos.
Los químicos pueden ser transferidos de un organismo a otro. Los pastoreros ingerirán los químicos que se encuentran en la vegetación que comen. De igual manera, los depredadores están expuestos a químicos en sus artículos de presa. Esta llamada acumulación de la red alimentaria se rige por las propiedades del químico, pero también por algunos rasgos del organismo receptor (por ejemplo, el pastor o el depredador).
Propiedades químicas que impulsan la acumulación de redes alimentarias
Se sabe que algunos químicos se acumulan en las redes alimentarias, alcanzando las concentraciones más altas en los depredadores superiores. Ejemplos de tales productos químicos son los plaguicidas organoclorados como el DDT y los retardantes de llama bromados (por ejemplo, PBDE; véase la sección sobre COP). Dichos químicos acumuladores tienen algunas propiedades en común: necesitan ser persistentes y necesitan tener afinidad por el organismo. Los químicos orgánicos con un log Kow relativamente alto, lo que indica una alta afinidad por los lípidos, ingresarán a los organismos de manera bastante efectiva (ver sección sobre Bioconcentración y modelado cinético). Una vez en el cuerpo, estos químicos se distribuirán a los tejidos ricos en lípidos, y la excreción es bastante limitada. En caso de sustancias químicas persistentes que no se metabolizan, las concentraciones aumentarán con el tiempo cuando la absorción sea mayor que la excreción. Además, es probable que dichos químicos se transmitan a los organismos en el siguiente nivel trófico en caso de interacciones depredador y depredador. Algunas de estas sustancias químicas pueden ser metabolizadas por el organismo, la mayoría de las veces en metabolitos más solubles en agua (ver sección sobre Metabolismo y defensa xenobióticos). Estos metabolitos se excretan más fácilmente, y de esta manera las concentraciones de sustancias químicas metabolizables no aumentan tanto con el tiempo, y por lo tanto también se transferirán menos a niveles tróficos más altos. Los efectos del metabolismo en las concentraciones internas de organismos se ilustran claramente mediante un estudio sobre la absorción de sustancias químicas orgánicas por diferentes especies acuáticas (Kwok et al., 2013). En ese estudio se comparó la captación de sustancias químicas persistentes (plaguicidas organoclorados; OCPs) con la captación de sustancias químicas que pueden ser metabolizadas (hidrocarburos aromáticos policíclicos; HAP). Los autores compararon camarones con peces, los primeros tienen una capacidad limitada para metabolizar HAP mientras que los peces pueden. En la Figura 1 se muestran los Factores de Acumulación de Biota a Sedimento (BSAFs; ver sección Bioacumulación), que es la relación entre la concentración en el organismo y en el sedimento. Se muestra que los OCP se acumulan en gran medida en ambas especies, reflejando químicos persistentes, no metabolizables. Para los HAP los resultados son diferentes por especie, los peces son capaces de metabolizarse y como resultado las concentraciones de HAP en los peces son bajas, mientras que en camarón, con una capacidad metabólica limitada, la acumulación de HAP es comparable a los OCP. Estos resultados muestran que no solo las propiedades de los químicos son de importancia, sino también algunos rasgos de los organismos involucrados, en este caso la capacidad metabólica.
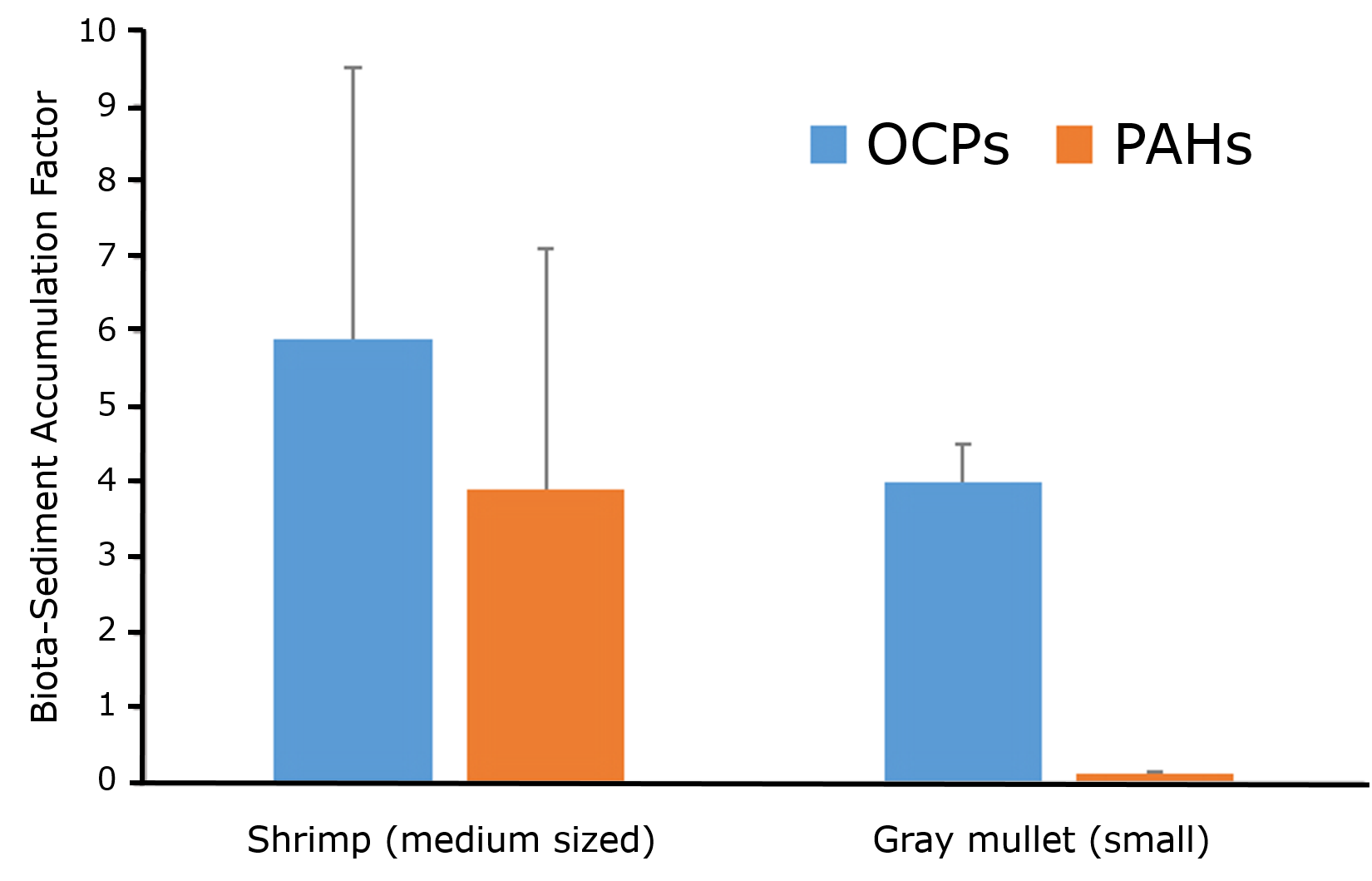
Efectos de los rasgos de las especies y la estructura de la red alimentaria en la acumulación de
La acumulación de productos químicos en la red alimentaria es impulsada por la absorción de alimentos. A niveles tróficos más bajos, la mayoría de los organismos adquirirán concentraciones relativamente bajas del ambiente ambiente. Primero los consumidores, forrajeando estos organismos acumularán los químicos de todos ellos, y en caso de que los químicos persistentes ingresen al organismo con facilidad, las concentraciones en los consumidores serán mayores que en su dieta. De igual manera, las concentraciones aumentarán cuando los químicos sean transferidos al siguiente nivel trófico. Este proceso se denomina biomagnificación, lo que indica concentraciones crecientes de químicos persistentes y acumulativos en las redes alimentarias. El ejemplo más icónico de esto está en las crecientes concentraciones de DDT en peces que comen American Osprey (Figura 2), un casus que ha llevado a la prohibición de muchos productos químicos organoclorados.
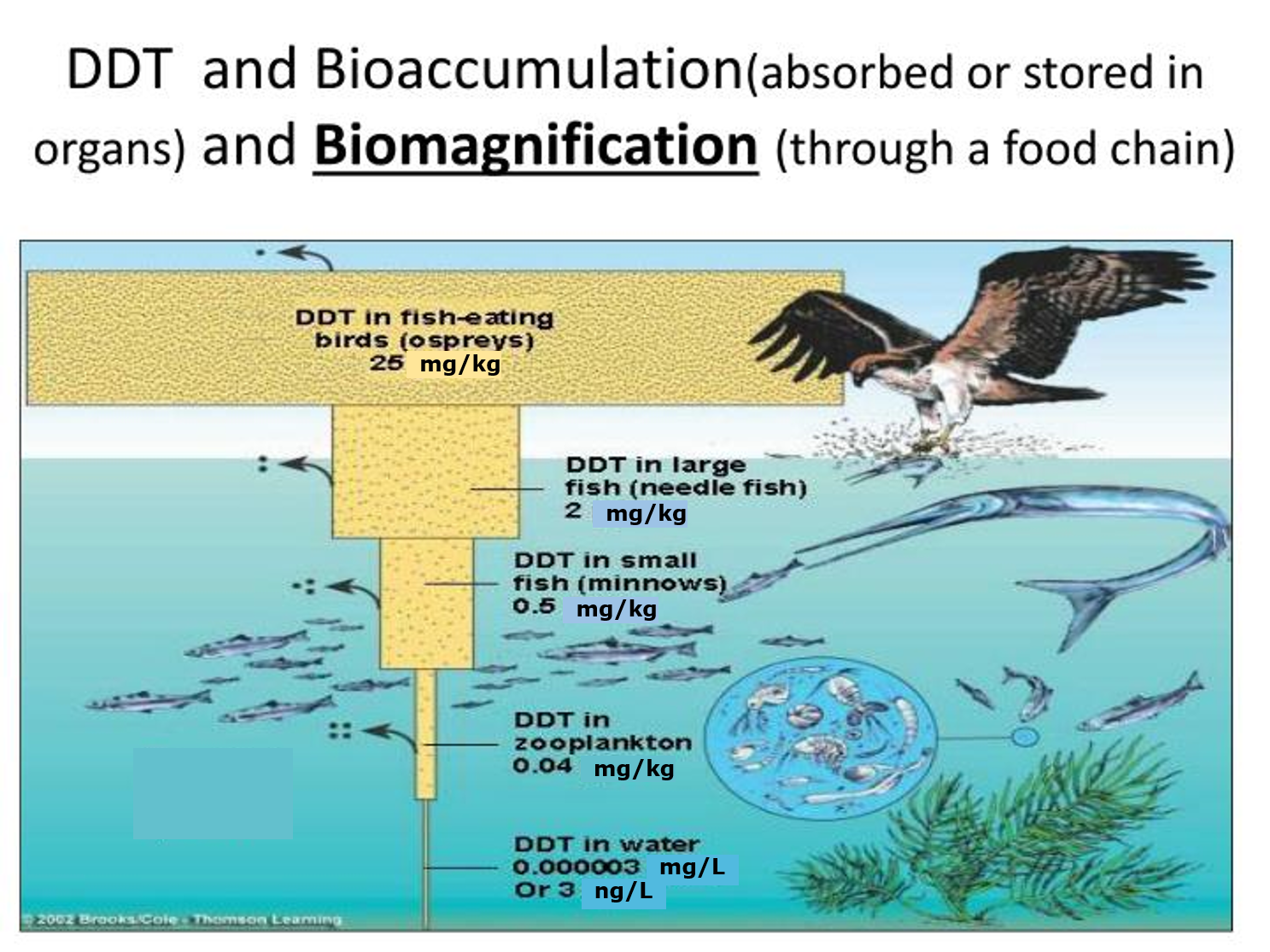
Dado que la biomagnificación a lo largo de los niveles tróficos es impulsada por los alimentos, es importante incluir la composición de la dieta en los estudios. Esto puede explicarse con un ejemplo sobre pequeños mamíferos en los Países Bajos. Dos especies similares de pequeños mamíferos, el topillo de banco (Myodes glareolus) y el topillo común (Microtus arvalis) coexisten en gran parte de los Países Bajos. Aunque las especies se ven muy similares, son diferentes en su dieta y uso del hábitat. El topillo de banco es una especie omnívora, que habita diferentes tipos de hábitat mientras que el topillo común es estrictamente vegetariano viviendo en pastos. En un estudio sobre la absorción específica de cadmio por especie, se analizaron los ítems dietéticos de ambas especies, indicando diferencias de casi 3 órdenes de magnitudes en las concentraciones de cadmio entre lombrices de tierra y bayas de la vegetación (Fig 3A, van den Brink et al., 2010). Se utilizaron relaciones isotópicas estables de carbono y nitrógeno para evaluar las dietas generales de los organismos. El topillo común comía principalmente ortiga y pasto, incluyendo semillas, mientras que el topillo de banco mostró alimentarse de hierbas de pasto y lombrices de tierra. Esta diferencia en la dieta se reflejó en el aumento de las concentraciones de cadmio en el topillo bancario en comparación con el topillo común (ambos que habitan la misma área). Las concentraciones de un topillo de banco parecían ser extremadamente bajas (diamante rojo en la Figura 3b), e inicialmente se consideró un artefacto. Sin embargo, el análisis detallado de las proporciones isotópicas estables en este individuo reveló que se había alimentado de ortiga y pasto, de ahí una dieta que reflejaba más el topillo común. Esto enfatiza una vez más que los organismos se acumulan a través de su dieta (¡acumulas lo que comes!)
Estudios de casos
Las orcas o orcas (Orcinus orca) son grandes mamíferos depredadores marinos, que deambulan por todos los océanos, desde el Ártico hasta la región sur profunda de la Antártida. Aunque aparecen ubicuos en todo el mundo, generalmente diferentes vainas de Orcas ocurren en diferentes regiones del ecosistema marino. A menudo, cada vaina ha desarrollado comportamientos especializados de forrajeo dirigidos a especies específicas de presas. Aunque las orcas son generalmente depredadores superiores del ápice en la parte superior de la red alimentaria (local), las diferentes estrategias de forrajeo sugieren que la exposición a los químicos acumulados puede diferir considerablemente entre vainas. De hecho, este fue el caso en un estudio muy elaborado sobre diferentes vainas de Orcas de la costa oeste de Canadá realizado por Ross et al. (2000). En la región de Vancouver hay una vaina residente, mientras que la región también suele ser visitada por dos grupos transitorios de Orcas. Las concentraciones de PCB fueron altas en todos los animales, pero los animales transitorios contenían niveles significativamente mayores. Las ballenas transitorias se alimentaron principalmente de mamíferos marinos, mientras que los animales residentes se alimentaron principalmente de peces, y esta diferencia en la dieta se pensó que era la causa de las diferencias en los niveles de PCB entre los grupos. En ese estudio, también se demostró que los niveles de PCB aumentaron con la edad, debido a la persistencia de los PCB, mientras que las orcas hembras contenían concentraciones significativamente menores de PCB. Esta última es causada por la lactancia de las Orcas hembras durante la cual alimentan a sus terneros con leche rica en lípidos, conteniendo niveles relativamente altos de PCB (lipófilos). Por este proceso, las hembras descargan grandes partes de su carga corporal de PCB, sin embargo transfiriendo estos PCB a sus terneros en desarrollo (véase también la Figura 3 en la sección sobre Bioacumulación). Un estudio reciente mostró que aunque los PCB han sido prohibidos desde hace décadas, todavía representan amenazas para las poblaciones de Orcas (Deforges et al., 2018). En ese estudio, se confirmaron diferencias regionales en las cargas de PCB, probablemente debido a diferencias en las preferencias dietéticas aunque no se mencionaron específicamente. Se demostró que los niveles de PCB en la mayoría de las poblaciones de Orcas aún estaban por encima de los niveles de umbral tóxico y se plantearon preocupaciones con respecto a la viabilidad de estas poblaciones. Este estudio confirma que 1) las orcas están expuestas a diferentes niveles de PCB de acuerdo a su dieta, lo que influye en la biomagnificación de los PCB, 2) Las poblaciones de orcas son muy ineficientes en la limpieza de los PCB del individuo debido al escaso metabolismo pero también de la población debido a la eficiencia materna transferencia de madre a parto, y 3) los químicos persistentes y acumulados pueden representar amenazas para los organismos incluso décadas después de su uso. Comprender los mecanismos y procesos subyacentes a la biomagnificación de compuestos persistentes y tóxicos es esencial para una evaluación profunda del riesgo.
Referencias
Desforges, J.-P., Hall, A., McConnell, B., Rosing-Asvid, A., Barbero, J.L., Brownlow, A., De Guise, S., Eulaers, I., Jepson, P.D., Letcher, R.J., Levin, M., Ross, P.S., Samarra, F., Víkingson, G., Sonne, C., Dietz, R. (2018). Predecir el colapso de la población mundial de orcas por contaminación por PCB. Ciencia 361, 1373-1376.
Ford, J.K.B., Ellis, G.A., Matkin, D.R., Balcomb, K.C., Briggs, D., Morton, A.B. (2005). Ataques de orcas a ballenas minke: captura de presas y tácticas antidepredadores. Ciencia de Mamíferos Marinos 21, 603-618.
Guinet, C. (1992). Comportamiento depredador de orcas (Orcinus orca) alrededor de las islas Grozet. Revista Canadiense de Zoología 70, 1656-1667.
Kwok, C.K., Liang, Y., Leung, S.Y., Wang, H., Dong, Y.H., Young, L., Giesy, J.P., Wong, M.H. (2013). Factor de acumulación biota-sedimento (BSAF), factor de bioacumulación (BAF) y niveles de contaminantes en peces presa para indicar el grado de contaminación de HAP y OCP en huevos de aves acuáticas. Ciencia Ambiental e Investigación en Contaminación 20, 8425-8434.
Ross, P.S., Ellis, G.M., Ikonomou, M.G., Barrett-Lennard, L.G., Addison, R.F. (2000). Altas concentraciones de PCB en orcas del Pacífico de rango libre, Orcinus orca: Efectos de la edad, sexo y preferencia dietética. Boletín de Contaminación Marina 40, 504-515.
Samarra, F.I.P., Bassoi, M., Beesau, J., Eliasdottir, M.O., Gunnarsson, K., Mrusczok, M.T., Rasmussen, M., Rempel, J.N., Thorvaldsson, B., Vikingsson, G.A. (2018). Presa de orcas (Orcinus orca) en Islandia. Plos Uno 13, 20.
van den Brink, N., Lammertsma, D., Dimmers, W., Boerwinkel, M.-C., van der Hout, A. (2010). Efectos de las propiedades del suelo sobre la acumulación de metales pesados en la red alimentaria en el ratón de madera (Apodemus sylvaticus). Contaminación Ambiental 158, 245-251.
En un lago, el ecosistema consiste en algas, dáfnidos que se alimentan de las algas y peces que se alimentan de los dáfnidos. El químico A tiene un log K ow bajo, pero es persistente. El químico B tiene un alto log K ow, pero puede ser metabolizado por dafnidos y peces, y el químico C tiene alto log K ow y también es persistente. ¿Dónde puede encontrar las concentraciones más altas de Químicos A, B y C?
Nombrar los dos rasgos de las especies determinando el potencial de que los químicos alcancen altas concentraciones en ella.
Esta es una pregunta más general, tratando de poner la información del texto de esta sección sobre la bioacumulación a través de diferentes niveles tróficos en una perspectiva más amplia:
¿Qué propiedad necesita un químico, además de un alto potencial de bioacumulación y persistencia, para tener una alta probabilidad de plantear graves riesgos ambientales para los organismos?
4.1.7. Concentración crítica del cuerpo
Autor: Martina G. Vijver
Críticos: Kees van Gestel y Frank Gobas
Objetivos de aprendizaje:
Deberías ser capaz de
- describir el concepto de Concentración Crítica Corporal (CBC) para evaluar la toxicidad de los químicos.
- explicar gráficamente el concepto de CBC y hacer una distinción entre cinética lenta y rápida.
- mencionar casos en los que falla el enfoque CBC.
Palabras clave:
Efectos dependientes del tiempo, concentraciones internas del cuerpo, modelo de un compartimento
Introducción
Una de las búsquedas en ecotoxicología es cómo vincular la toxicidad con la exposición y comprender por qué algunos organismos experimentan efectos tóxicos mientras que otros no están al mismo nivel de exposición. Un enfoque generalmente aceptado para evaluar los posibles efectos adversos sobre la biota, independientemente del tipo de especie, es el concepto de Concentración Crítica Corporal (CBC) (McCarty 1991). De acuerdo con este concepto, la toxicidad está determinada por la cantidad de sustancia química absorbida, así por la concentración interna, que tiene una relación con la duración de la exposición así como la concentración de la exposición.
La Figura 1 muestra la relación entre el desarrollo con el tiempo de las concentraciones internas de un químico en un organismo y el tiempo en que se produce la mortalidad a diferentes concentraciones de exposición bajo exposición constante. Independientemente del tiempo de exposición o concentración de exposición, la mortalidad ocurre a una concentración interna más o menos fija. El CBC se define como la mayor concentración interna de una sustancia en un organismo que sí causa un efecto definido, por ejemplo, 50% de mortalidad o 50% de reducción en el número de crías producidas. Al comparar las concentraciones internas medidas en organismos expuestos con los valores de CBC derivados en el laboratorio, se obtiene una medida de riesgo. El CBC se aplica tanto a la letalidad como a efectos subletales como la reproducción o inhibición del crecimiento.
Relacionar la toxicidad con la toxicocinética
A partir de la Figura 1A, también puede quedar claro que los químicos que tienen una cinética de absorción rápida alcanzarán el CBC más rápido que los químicos que tienen cinética lenta (ver Sección Cinética de bioacumulación). Como consecuencia, también el tiempo para alcanzar una LC 50 constante (indicada como la LC 50 final: LC 50 ¥; Figura 1B) depende de la cinética. Por lo tanto, tanto los efectos tóxicos como la concentración química están controlados por la misma cinética.El CBC puede derivarse de la relación LC 50 time y vincularse a la LC 50 ¥ usando constantes de tasa de absorción y eliminación (k 1 y k 2). Cabe señalar que el k 2 en este caso no refleja la tasa de excreción química sino más bien la tasa de eliminación de los efectos tóxicos causados por el químico (así, anote la diferencia aquí con la Sección Cinética de Bioacumulación).
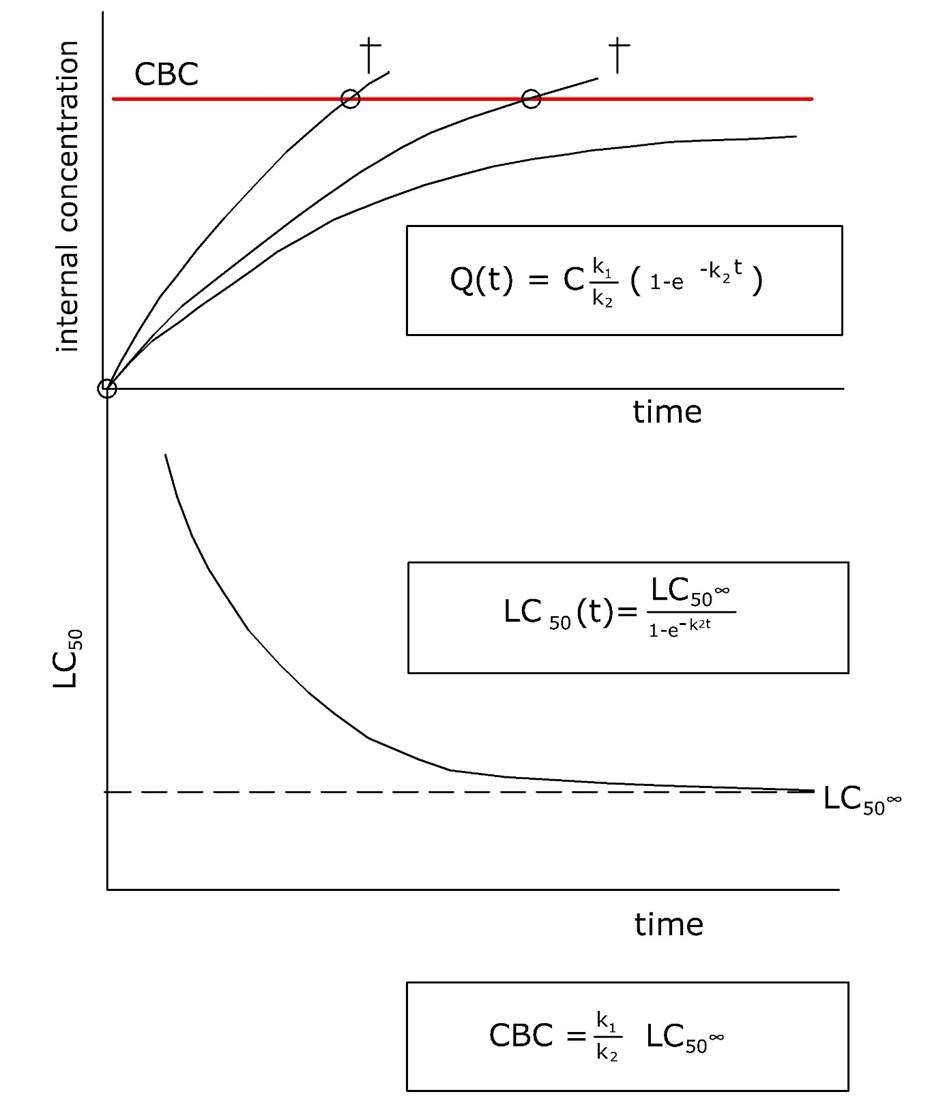

El tiempo necesario para alcanzar el estado estacionario depende del tamaño corporal de los organismos, ya que los organismos más grandes tardan más en alcanzar el estado estacionario en comparación con los organismos más pequeños (McCarty 1991). El tiempo necesario para alcanzar el estado estacionario depende también de la superficie de exposición de los organismos expuestos (Pawlisz y Peters 1993) así como de su actividad metabólica. Los organismos no capaces de excretar o metabolizar una sustancia química continuarán acumulándose con el tiempo, y el LC 50 ¥ será cero. Este es, por ejemplo, el caso del cadmio en isópodos (Crommentuijn et al. 1994), pero la cinética es tan lenta que el cadmio en estos animales nunca alcanza concentraciones letales en ambientes relativamente limpios ya que su vida útil es demasiado corta.
El CBC integra fracciones ambientalmente disponibles con concentraciones biodisponibles y toxicidad en receptores específicos (McCarty y MacKay 1993). Ver también Sección de Biodisponibilidad. De esta manera, no es necesario conocer la concentración real de exposición en el ambiente para realizar una evaluación de riesgos. La concentración interna del químico en el organismo es la única concentración requerida para una evaluación de riesgos. Por lo tanto, se superan muchas dificultades con respecto a los problemas de biodisponibilidad, por ejemplo, elimina algunas de las desventajas de la concentración de exposición expresada por unidad de suelo, así como de lidiar con exposiciones que varían en el tiempo o el espacio.
Prueba del concepto CBC
Se recolectó un cuerpo convincente de evidencia para apoyar el enfoque de CBC. Para compuestos orgánicos con un modo de acción narcótico, los efectos podrían evaluarse en una amplia gama de organismos, compuestos de prueba y medios de exposición. Para los compuestos narcóticos con coeficientes de partición octanol-agua (K ow) que varían de 10 a 1,000,000 (ver para más detalles Sección Propiedades químicas relevantes), la concentración de sustancia química requerida para la letalidad a través de la narcosis es de aproximadamente 1-10 mmol/kg: Figura 2 (McCarty y MacKay 1993).
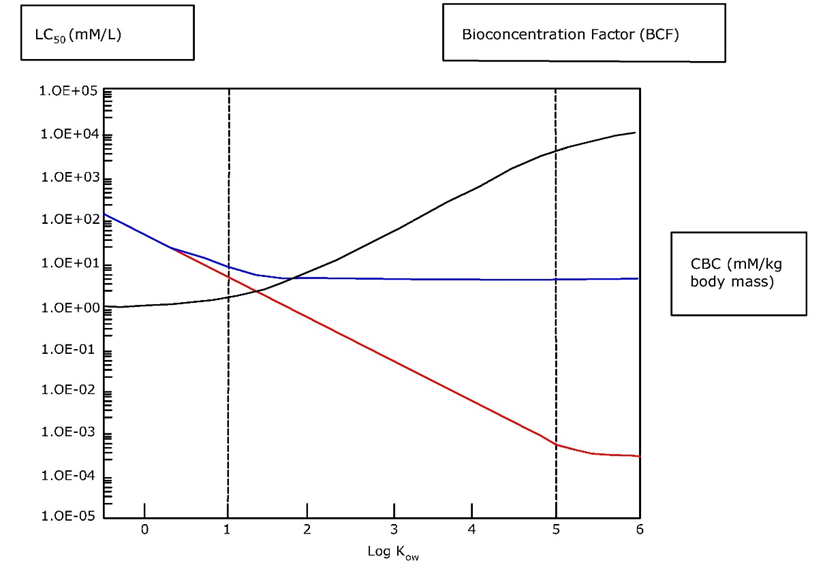
Para reducir la variación en los valores del factor de bioconcentración (FBC) para la acumulación de sustancias químicas en organismos a partir del agua, se ha sugerido la normalización por contenido lipídico que permite determinar la actividad química dentro del cuerpo de un organismo (US EPA 2003). Por esa razón, los protocolos de extracción de lípidos se describen de manera intensiva dentro de la Guía actualizada de la OCDE para la prueba de químicos No. 305 para las pruebas de bioacumulación de peces, junto con un programa de muestreo de medición de lípidos en peces. La corrección del BCF por diferencias en el contenido lipídico también se describe en la misma directriz de la OCDE No. 305. Si se han realizado análisis químicos y lipídicos en el mismo pez, esto requiere la corrección del contenido lipídico correspondiente de cada concentración medida individual en el pez. Esto se debe hacer antes de usar los datos para calcular el BCF cinético. Si no se mide el contenido lipídico en todos los peces muestreados, se debe utilizar un contenido medio de lípidos de aproximadamente 5% para normalizar el BCF. Cabe señalar que esta corrección se mantiene solo para los químicos que se acumulan en los lípidos y no para los químicos que se unen principalmente a proteínas (por ejemplo, sustancias perfluoradas).
¿Cuándo no se aplica el concepto CBC?
El concepto de CBC también tiene algunas limitaciones. Crommentuijn et al. (1994) encontraron que la toxicidad de los metales para los invertebrados del suelo no se pudo explicar usando concentraciones corporales críticas. La forma en que diferentes organismos tratan con los metales acumulados tiene un gran impacto en la magnitud de las concentraciones corporales alcanzadas y la sensibilidad a los metales que lo acompaña (Rainbow 2002). Además, la adaptación o desarrollo de tolerancia a metales limita la aplicación de CBC para metales. Cuando la concentración interna de metal no muestra una relación monótona con la concentración de exposición, no es posible derivar CBC. Esto significa que siempre que los organismos sean capaces de capturar una porción del metal en formas que no sean biológicamente reactivas, una relación directa entre las concentraciones de metales corporales y la toxicidad puede estar ausente o menos evidente (Luoma y Rainbow 2005, Vijver et al. 2004). En consecuencia, para los metales existe un amplio rango de concentraciones corporales con diferente significación biológica. Por lo tanto, sigue siendo una cuestión abierta si el enfoque es aplicable a modos de acción tóxica distintos de la narcosis. Otro punto importante es la pregunta en qué medida el enfoque CBC es aplicable para evaluar el efecto de las mezclas químicas, especialmente en los casos en que los químicos tienen un modo de acción diferente.
Referencias
Crommentuijn, T., Doodeman, C.J.A.M., Doornekamp, A., Van der Pol, J.J.C., Bedaux, J.J.M., Van Gestel, C.A.M. (1994). Las concentraciones corporales letales y los patrones de acumulación determinan la toxicidad dependiente del tiempo del cadmio en artrópodos del suelo Toxicología y Química Ambiental 13, 1781-1789.
Luoma, S.N., Rainbow, P.S. (2005). ¿Por qué la bioacumulación de metales es tan variable? La biodinámica como concepto unificador. Ciencia y Tecnología Ambiental 39, 1921-1931
McCarty, L.S. (1991). Residuos corporales tóxicos: implicaciones para bioensayos acuáticos con algunos químicos orgánicos. En: Mayes, M.A., Barron, M.G. (Eds.), Toxicología Acuática y Evaluación de Riesgos: Decimocuarto Volumen. ASTM STP 1124. Filadelfia: Sociedad Americana de Pruebas y Materiales. pp. 183-192. DOI: 10.1520/STP23572S
McCarty, L.S., Mackay, D. (1993). Potenciación de la modelización y evaluación ecotoxicológica. Ciencia y Tecnología Ambiental 27, 1719-1727
Pawlisz, A.V., Peters, R.H. (1993). Una prueba de la equipotencia de cargas internas de nueve químicos narcóticos usando Daphnia magna. Ciencia y Tecnología Ambiental 27, 2801-2806
Rainbow P.S. (2002). Concentraciones de metales traza en invertebrados acuáticos: ¿por qué y qué? Contaminación Ambiental 120, 497-507.
U.S. EPA. (2003). En: Metodología para Derivar Criterios de Calidad del Agua Ambiental para la Protección de la Salud Humana: Documento de Apoyo Técnico. Volumen 2. Agencia de Protección Ambiental de Estados Unidos, Washington, D.C: Desarrollo de Factores Nacionales de Bioacumulación.
Vijver M.G., Van Gestel, C.A.M., Lanno, R.P., Van Straalen, N.M., Peijnenburg, W.J.G.M. (2004) Secuestración interna de metales y su relevancia ecotoxicológica: una revisión. Ciencia y Tecnología Ambiental 18, 4705-4712.
Explicar por qué el enfoque CBC integra la disponibilidad química y biológica.
¿Cómo intervienen las dinámicas de tiempo en el enfoque CBC?
¿En qué condiciones no se puede aplicar el enfoque CBC?