1.4: Bufferes de pH
- Page ID
- 76211
Controlar el pH es de vital importancia en el análisis cualitativo de cationes. A menudo, el pH necesita mantenerse en un rango estrecho en el análisis de cationes.
Un tampón de pH es una solución acuosa que consiste en un ácido débil y su base conjugada o viceversa, lo que minimiza el cambio de pH cuando se le agrega una pequeña cantidad de un ácido fuerte o una base fuerte.
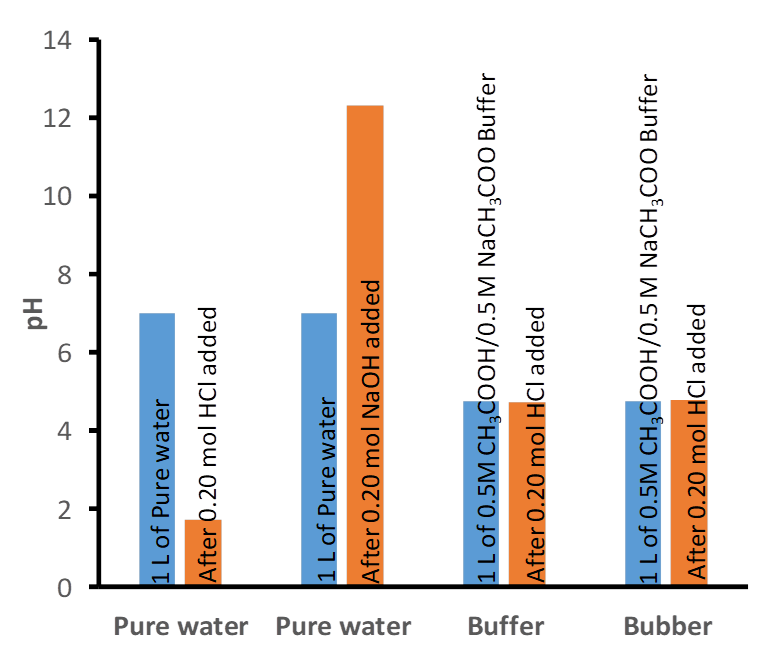
Por ejemplo, la adición de 0.020 mol\(\ce{HCl}\) a 1 L de agua cambia el pH de 7 a 1.7, es decir, aproximadamente 80% de cambio en el pH. De igual manera, la adición de 0.020 mol\(\ce{NaOH}\) a la misma agua cambia el pH de 7 a 12.3, es decir, nuevamente, aproximadamente 80% de cambio en el pH. A diferencia del agua pura, 1 L de solución tampón que contiene 0.50 mol a la semana ácido acético (\(\ce{CH3COOH}\)) y 0.50 mol de su base conjugada\(\ce{CH3COO^-}\) cambia el pH de 4.74 a 4.70 por la adición de los mismos 0.020 mol\(\ce{HCl}\) y de 4.74 a 4.77 por la adición de 0.020 mol\(\ce{NaOH}\), es decir, aproximadamente 1% cambio en el pH, como se ilustra en la Fig. 1.7.1.
El tampón contiene un ácido débil y su base conjugada en equilibrio. Por ejemplo, el tampón de ácido acético/acetato de sodio tiene el siguiente equilibrio:
\[\ce{CH3COOH + H2O <<=> H3O^{+} + CH3COO^{-}}\nonumber\]
La concentración molar de iones hidronio [\(\ce{H3O^+}\)] define el pH de la solución, es decir,\(\mathrm{pH}=-\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\). La base conjugada consume cualquier ácido fuerte agregado a la mezcla:
\[\ce{HA + CH3COO^{-} -> CH3COOH + A^{-}}\nonumber\]
, donde\(\ce{HA}\) está cualquier ácido fuerte y\(\ce{A^-}\) es su base conjugada. La concentración de\(\ce{CH3COOH}\) aumenta y\(\ce{CH3COO^-}\) disminuye, pero el pH disminuye poco porque [\(\ce{H3O^+}\)] casi no se ve afectado. De igual manera, el ácido débil consume cualquier base fuerte añadida.
\[\ce{MOH + CH3COOH -> CH3COO^{-} + M^{+} + H2O}\nonumber\]
, donde\(\ce{M^+}\) está su ácido conjugado. La concentración de\(\ce{CH3COOH}\) disminuye y\(\ce{CH3COO^-}\) aumenta, pero el pH aumenta poco porque [\(\ce{H3O^+}\)] casi no se ve afectado. Los tampones se emplean en varias ocasiones durante el análisis cualitativo de cationes.


