1.5: Separación de cationes en grupos
- Page ID
- 76212
El análisis cualitativo de los cationes que se encuentran comúnmente en la solución acuosa generalmente se realiza en tres etapas:
- los iones se separan en grupos más amplios mediante precipitación selectiva basada en sus propiedades de solubilidad,
- los iones miembros en un grupo se separan usualmente por disolución selectiva de los precipitados, y
- los iones individuales se identifican mediante una prueba de confirmación específica.
Para la primera etapa, es decir, separación de cationes en grupos, se selecciona un reactivo adecuado que precipita selectivamente ciertos iones dejando el resto de los iones en la solución.
Un reactivo adecuado es aquel que:
- elimina casi por completo los iones pertenecientes al grupo para que los iones residuales no puedan interferir en el análisis de los otros iones que quedan en la solución,
- no debe precipitar una fracción de iones que no pertenezcan al grupo que se está separando, y
- no debe dejar atrás contraión que no interfiera en el análisis del resto de los iones.
Los reactivos se agregan en un orden tal que el reactivo más selectivo, el que precipita el menor número de iones, se agrega primero.
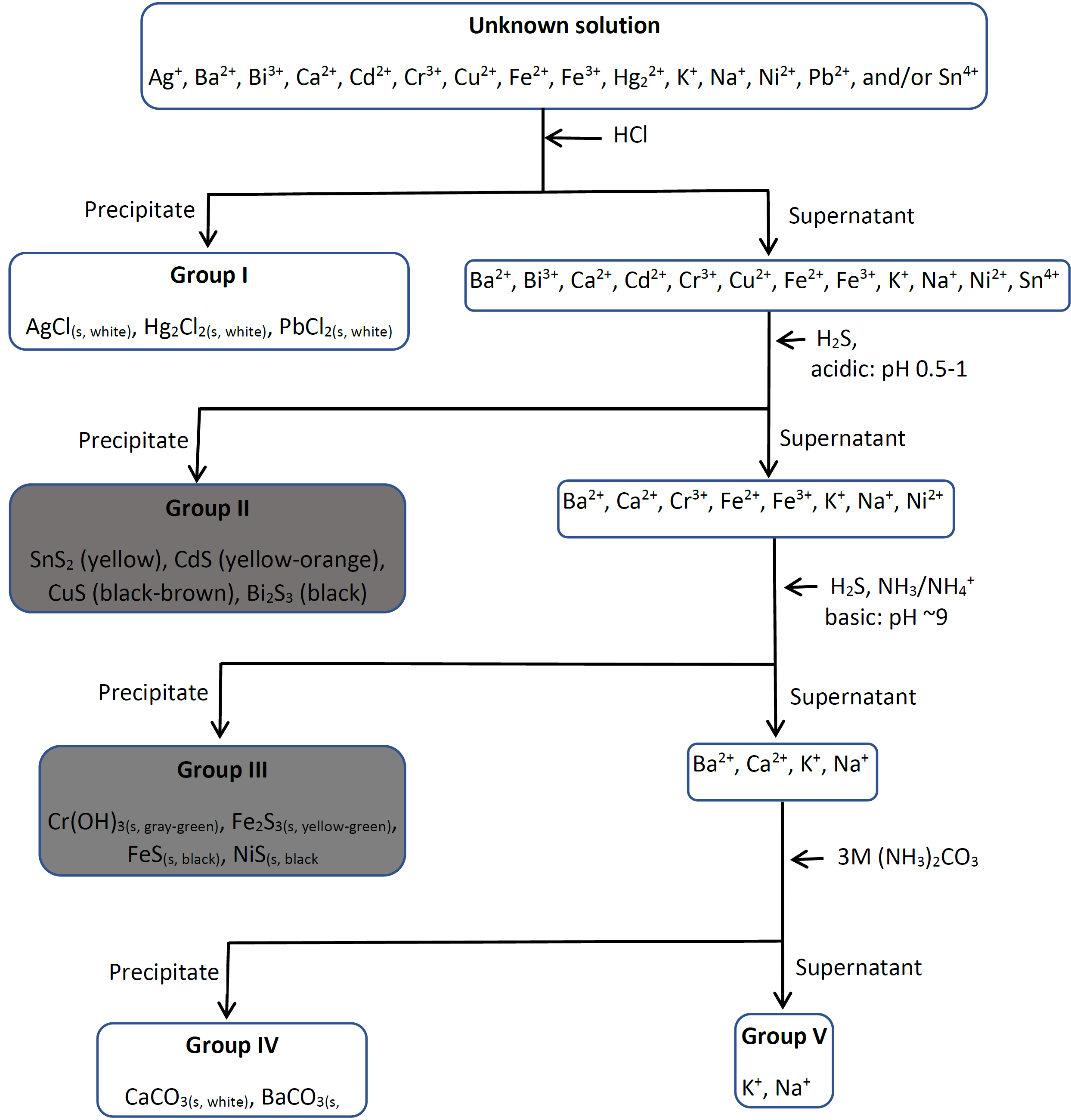
Los catorce cationes comunes que se encuentran en el agua que se seleccionan en estos ejercicios se separan en cinco grupos.
El grupo I comprende plomo II (\(\ce{Pb^{2+}}\)), mercurio (I) (\(\ce{Hg2^{2+}}\)) y plata (I) (\(\ce{Ag^{+}}\)) que se precipitan selectivamente como cloruros al agregar 6M\(\ce{HCl}\) a la mezcla.
\[\ce{HCl + H2O(l) -> H3O^{+}(aq) + Cl^{-}(aq)}\nonumber\]
\(\ce{HCl}\)solución se selecciona como reactivo para el grupo I en base a los hechos: i) es una fuente de ion cloruro (\(\ce{Cl^{-}}\)) que es el reactivo más selectivo que hace sales insolubles con solo\(\ce{Pb^{2+}}\),\(\ce{Hg2^{2+}}\), y\(\ce{Ag^{+}}\) (recordar iones solubles regla #3 descrita en la sección 1.1), ii) deja detrás de\(\ce{H3O^{+}}\) eso hace ácida la solución que es beneficiosa para la separación de cationes del siguiente grupo.
El grupo II comprende estaño (IV) (\(\ce{Sn^{4+}}\)), cadmio (II) (\(\ce{Cd^{2+}}\)), cobre (II) (\(\ce{Cu^{2+}}\)) y bismuto (III) (\(\ce{Bi^{3+}}\)) que se precipitan selectivamente como sulfuros mediante la adición de\(\ce{H2S}\) reactivo en un medio ácido. \(\ce{H2S}\)es una fuente de ion sulfuro (\(\ce{S^{2-}}\)) en agua:
\[\ce{H2S(aq) + 2H2O(l) -> 2H3O^{+}(aq) + S^{2-}(aq)}\nonumber\]
El\(\ce{S^{2-}}\) ion produce sales insolubles con muchos cationes como se establece en la regla #1 de iones insolubles en la sección 1.1, es decir, “El hidróxido (\(\ce{OH^{-}}\)) y los sulfuros (\(\ce{S^{2-}}\)) son insolubles excepto cuando el catión es un ion de metal alcalinotérreo pesado:\(\ce{Ca^{2+}}\)\(\ce{Ba^{2+}}\),\(\ce{Sr^{2+}}\), y, o un ion de metal alcalino, o amoníaco.”
\(\ce{H2S}\)en medio ácido se selecciona como fuente de la\(\ce{S^{2-}}\) cual es el reactivo para la precipitación selectiva del grupo II, ya que la concentración de\(\ce{S^{2-}}\) puede controlarse ajustando el pH. El medio ácido tiene mayor [\(\ce{H3O^{+}}\)] que disminuye\(\ce{S^{2-}}\) debido al efecto iónico común del\(\ce{HeO{+}}\) ion. Por lo tanto, entre las sales insolubles en sulfuro, solo precipitan selectivamente los cationes del grupo II que tienen muy baja solubilidad.
El grupo III comprende cromo (III) (\(\ce{Cr^{3+}}\)), hierro (II) (\(\ce{Fe^{2+}}\)), hierro (III) (\(\ce{Fe^{3+}}\)) y níquel (II) (\(\ce{Ni^{2+}}\)) precipitados selectivamente como hidróxidos y sulfuros insolubles mediante la adición\(\ce{H2S}\) en medio alcalino con pH mantenido a ~9\(\ce{NH3}\) por/\(\ce{NH4^{+}}\) tampón.
\(\ce{H2S}\)en un medio alcalino es el reactivo para la precipitación selectiva de cationes del grupo III.
Cuando el pH se establece en 9\(\ce{NH3}\) por/\(\ce{NH4^{+}}\) tampón, la\(\ce{OH^{-}}\) concentración es lo suficientemente alta como para precipitar los cationes del grupo III como hidróxido insoluble excepto el níquel que forma iones del complejo de coordinación soluble con amoníaco. Cuando\(\ce{H2S}\) se agrega en un medio alcalino, produce una mayor concentración de\(\ce{S^{2-}}\) debido a la eliminación\(\ce{H3O^{+}}\) de su equilibrio al reaccionar con\(\ce{OH^{-}}\):
\[\ce{H3O^{+}(aq) + OH^{-}(aq)-> 2H2O(l)} \nonumber\]
Todos los cationes del grupo III se convierten en sulfuros insolubles excepto cromo.
El grupo IV comprende calcio (\(\ce{Ca^{2+}}\)) y bario (\(\ce{Ba^{2+}}\)) precipitan selectivamente como carbonatos insolubles mediante la adición de carbonato de amonio (\(\ce{(NH4)2CO3}\)) como fuente de ion carbonato (\(\ce{CO3^{2-}}\)):
\[\ce{(NH4)2CO3(s) + 2H2O <=> 2NH4^{+}(aq) + CO3^{2-}(aq)}\nonumber\]
El\(\ce{CO3^{2-}}\) ion produce sales insolubles con muchos cationes como lo establece la regla #2 de iones insolubles en la sección 1.1, es decir, “Los carbonatos (\(\ce{CO3^{2-}}\)), fosfatos (\(\ce{PO4^{3-}}\)) y óxido (\(\ce{O^{2-}}\)) son insolubles excepto cuando el catión es un ion de metal alcalino o amoníaco”. Todos los demás iones ya han sido precipitados en esta etapa en los grupos I, II y III excepto los cationes del grupo IV y los iones de metales alcalinos.
El\(\ce{CO3^{2-}}\) ion es un reactivo selectivo para cationes del grupo IV porque
El grupo V comprende iones de metales alcalinos, es decir, sodio (\(\ce{Na^{+}}\)) y potasio (\(\ce{K^{+}}\)) en la mezcla de iones seleccionados. De acuerdo con la regla #1 de iones solubles en la sección 1.1, los iones de metal alcalino y amonio forman sales solubles. Entonces, los cationes del grupo V permanecen en solución después de que los cationes I, II, III y IV se eliminan como insolubles, cloruro, sulfuro en medio ácido, sulfuro en medio básico y carbonatos, respectivamente.
La separación de cationes en grupos, junto con la separación de iones dentro de un grupo y sus pruebas de confirmación se describen en detalle en capítulos posteriores. El diagrama de flujo que se muestra a continuación muestra el resumen de la separación de cationes comunes en el agua en los cinco grupos.