23.3: Electrodos selectivos de iones de membrana
- Page ID
- 78990
Si los metales fueran los únicos materiales útiles para construir electrodos indicadores, entonces habría pocas aplicaciones útiles de potenciometría. En 1906, Cremer descubrió que la diferencia de potencial a través de una fina membrana de vidrio es una función del pH cuando lados opuestos de la membrana están en contacto con soluciones que tienen diferentes concentraciones de H 3 O +. La existencia de este potencial de membrana condujo al desarrollo de una nueva clase de electrodos indicadores, a los que llamamos electrodos selectivos de iones (ISE). Además del electrodo de pH de vidrio, los electrodos selectivos de iones están disponibles para una amplia gama de iones. También es posible construir un electrodo de membrana para un analito neutro mediante el uso de una reacción química para generar un ion que se monitoriza con un electrodo selectivo de iones. El desarrollo de nuevos electrodos de membrana selectivos de iones continúa siendo un área activa de investigación.
Clasificación de Membranas Selectivas de Iones
Existen dos clases amplias de materiales que se utilizan como membranas: membranas cristalinas en estado sólido y membranas no cristalinas. Ejemplos de membranas cristalinas en estado sólido son cristales simples de LaF 3 y AG policristalinos. Ejemplos de membranas no cristalinas son membranas de vidrio e hidrófobas que contienen un intercambiador iónico líquido. Cada uno de estos se considera a continuación.
Propiedades de las membranas selectivas de iones
Para ser útil, una membrana selectiva de iones debe ser estructuralmente estable (una membrana cristalina que sea soluble, por ejemplo, no es estructuralmente estable), capaz de mecanizarse a un tamaño y forma adecuados que puedan incorporarse al electrodo indicador en una celda electroquímica potenciométrica, eléctricamente conductiva por lo que es posible medir el potencial de la celda electroquímica, y selectiva hacia el analito.
El potencial límite de la membrana
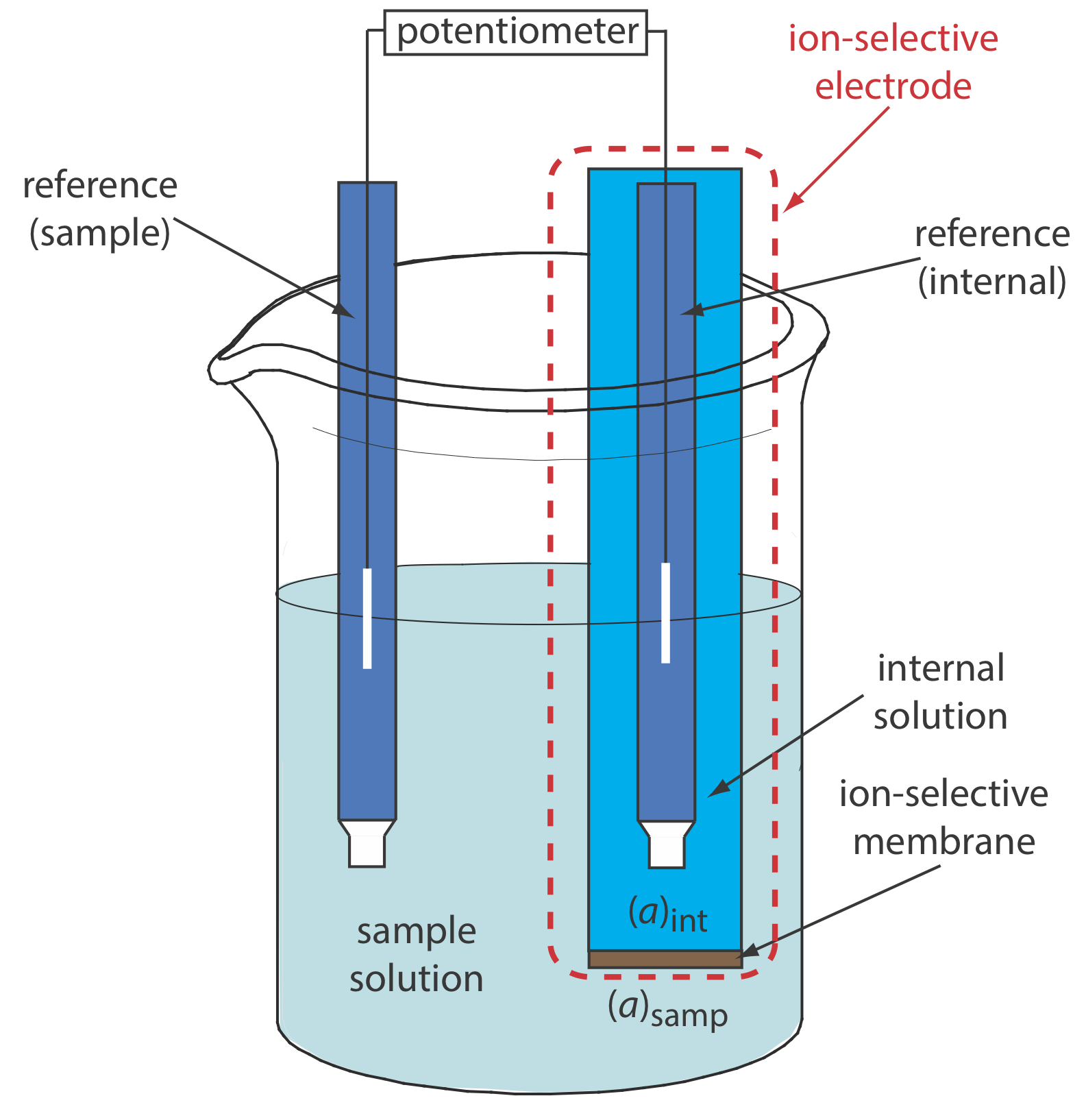
La figura\(\PageIndex{1}\) muestra una celda electroquímica potenciométrica típica equipada con un electrodo selectivo de iones. La notación de mano corta para esta celda es
\[\text { ref (sample) }\left\|\mathrm{A}_{\text { samp }}\left(a q, a_{\mathrm{A_{\text{samp}}}}=x\right) | \text{membrane} | \mathrm{A}_{\text { int }}\left(a q, a_{\mathrm{A_{\text{int}}}}=y\right)\right\| \text { ref (internal) } \nonumber \]
donde la membrana selectiva de iones separa las dos soluciones que contienen analito con actividades de x e y: la solución de muestra y la solución interna del electrodo selectivo de iones. El potencial de esta celda electroquímica
\[E_\text{cell} = E_\text{ref(int)} - E_\text{ref(samp)} + E_\text{mem} \label{membrane1} \]
incluye el potencial de cada electrodo de referencia y la diferencia de potencial a través de la membrana, E mem, que es el potencial límite de la membrana. Las anotaciones ref (muestra) y ref (interna) representan un electrodo de referencia sumergido en la muestra y un electrodo de referencia sumergido en la solución interna del electrodo selectivo de iones. Debido a que el potencial de los dos electrodos de referencia es constante, cualquier cambio en la celda E refleja un cambio en el potencial límite de la membrana.
La interacción del analito con la membrana genera un potencial límite si hay una diferencia en su actividad en los dos lados de la membrana. La corriente es transportada a través de la membrana por el movimiento del analito o de un ion ya presente en la matriz de la membrana. El potencial de membrana viene dado por la siguiente ecuación similar a Nernst
\[E_{\mathrm{mem}}=E_{\mathrm{asym}}-\frac{R T}{z F} \ln \frac{\left(a_{A}\right)_{\mathrm{int}}}{\left(a_{A}\right)_{\mathrm{samp}}} \label{membrane2} \]
donde (a) samp es la actividad del analito en la muestra, (a) int es la actividad del analito en la solución interna del electrodo selectivo de iones, y z es la carga del analito. Idealmente, E mem es cero cuando (a A) int = (a A) samp. El término E asym, que es un potencial de asimetría, explica el hecho de que E mem generalmente no es cero bajo estas condiciones.
Por ahora simplemente notamos que una diferencia en la actividad del analito da como resultado el potencial límite de la membrana. Al considerar diferentes tipos de electrodos selectivos de iones, exploraremos más específicamente la fuente del potencial de membrana.
Sustituyendo la Ecuación\ ref {membrana2} en la Ecuación\ ref {membrana1}, asumiendo una temperatura de 25 o C, y reordenando da
\[E_{\mathrm{cell}}=K+\frac{0.05916}{z} \log \left(a_{A}\right)_{\mathrm{samp}} \label{membrane3} \]
donde K es una constante que incluye los potenciales de los dos electrodos de referencia, el potencial de asimetría y la actividad del analito en la solución interna. La ecuación\ ref {membrane3} es una ecuación general y se aplica a todos los tipos de electrodos selectivos de iones.
Selectividad de membrana
El potencial límite de la membrana es el resultado de una interacción química entre el analito y los sitios activos en la superficie de la membrana. Debido a que la señal depende de un proceso químico, la mayoría de las membranas no son selectivas hacia un solo analito. En cambio, el potencial límite de la membrana es proporcional a la concentración de cada ion que interactúa con los sitios activos de la membrana. Podemos reescribir la Ecuación\ ref {membrane3} para incluir la contribución al potencial de un interferente, I
\[E_\text{cell} = K + \frac {0.05916} {z_A} \log \left\{ a_A + K_{A,I}(a_I)^{z_A/z_I} \right\} \label{membrane4} \]
donde z A y z I son las cargas del analito y el interferente, y K A, I es un coeficiente de selectividad que da cuenta de la respuesta relativa del interferente. El coeficiente de selectividad se define como
\[K_{A,I} = \frac {(a_A)_e} {(a_I)_e^{z_A/z_I}} \label{membrane5} \]
donde (a) e y (a I) e son las actividades del analito y el interferente que producen potenciales celulares idénticos. Cuando el coeficiente de selectividad es 1.00, la membrana responde por igual al analito y al interferente. Una membrana muestra buena selectividad para el analito cuando K A, I es significativamente menor a 1.00.
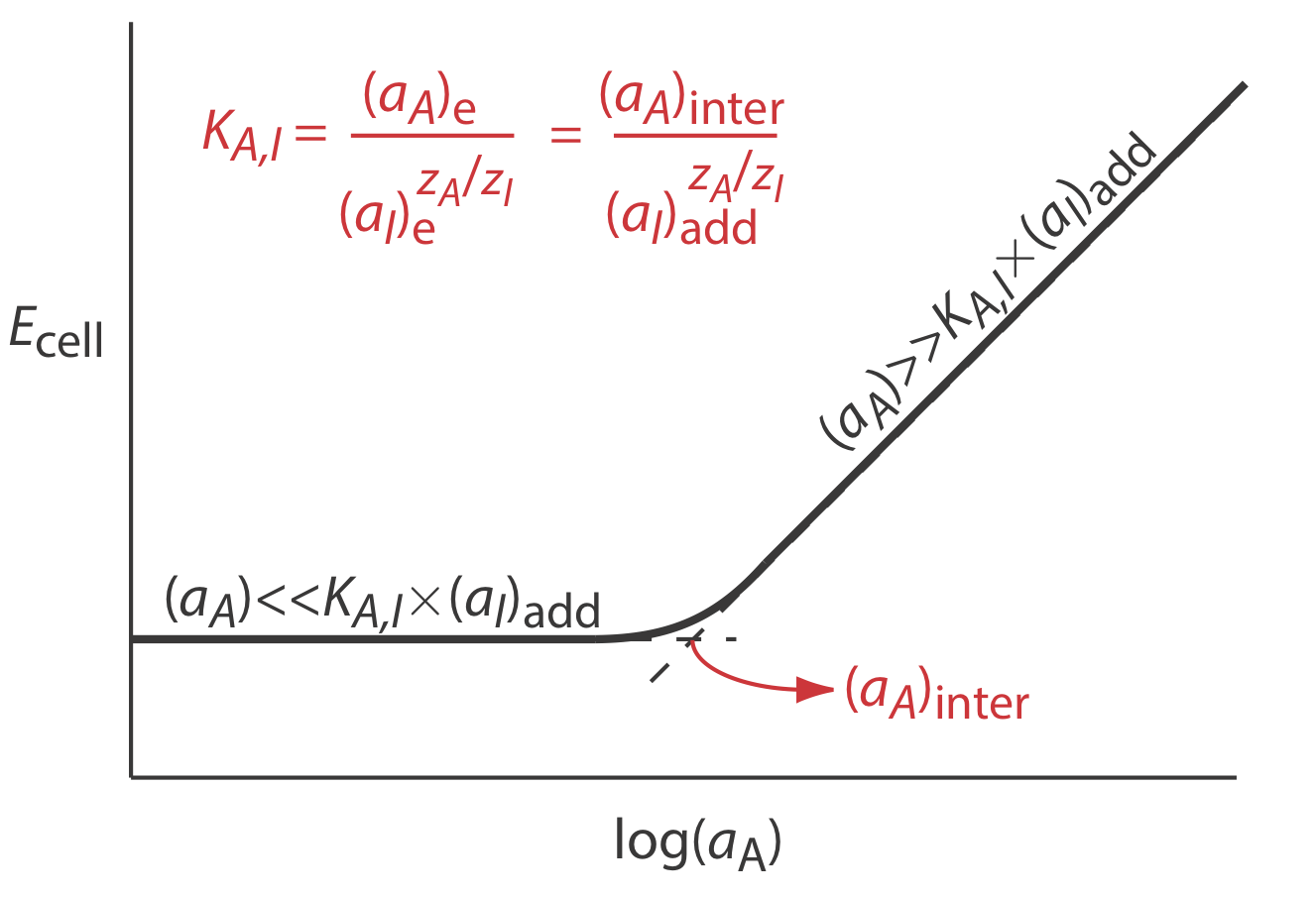
Los coeficientes de selectividad para la mayoría de los electrodos selectivos de iones disponibles comercialmente son proporcionados por el fabricante. Si no se conoce el coeficiente de selectividad, es fácil determinar su valor experimentalmente preparando una serie de soluciones, cada una de las cuales contiene la misma actividad de interferente, (a I) agregar, pero una actividad diferente de analito. Como se muestra en la Figura\(\PageIndex{2}\), una gráfica del potencial celular frente al logaritmo de la actividad del analito tiene dos regiones lineales distintas. Cuando la actividad del analito es significativamente mayor que K A, I\(\times\) (a I) add, el potencial es una función lineal de log (a A), como lo da la Ecuación\ ref {membrane3}. Si K A, I\(\times\) (a I) add es significativamente mayor que la actividad del analito, sin embargo, el potencial de la célula permanece constante. La actividad de analito e interferente en la intersección de estas dos regiones lineales se utiliza para calcular K A, I.
Sokalski y sus colaboradores describieron un método para preparar electrodos selectivos de iones con selectividades significativamente mejoradas [Sokalski, T.; Ceresa, A.; Zwicki, T.; Pretsch, E. J. Am. Chem. Soc. 1997, 119, 11347—11348]. Por ejemplo, un ISE convencional Pb 2 + tiene un valor\(\log K_{\text{Pb}^{2+}/\text{Mg}^{2+}}\) de —3.6. Si el potencial para una solución en la que la actividad de Pb 2 +\(4.1 \times 10^{-12}\) es idéntico al de una solución en la que la actividad de Mg 2 + es 0.01025, ¿cuál es el valor de\(\log K_{\text{Pb}^{2+}/\text{Mg}^{2+}}\) para su ISE?
Solución
Haciendo las sustituciones apropiadas en la Ecuación\ ref {membrane5}, encontramos que
\[K_{\text{Pb}^{2+}/\text{Mg}^{2+}} = \frac {(a_{\text{Pb}^{2+}})_e} {(a_{\text{Mg}^{2+}})_e^{z_{\text{Pb}^{2+}}/z_{\text{Mg}^{2+}}}} = \frac {4.1 \times 10^{-12}} {(0.01025)^{+2/+2}} = 4.0 \times 10^{-10} \nonumber \]
El valor de\(\log K_{\text{Pb}^{2+}/\text{Mg}^{2+}}\), por lo tanto, es —9.40.
El electrodo de vidrio para mediciones de pH
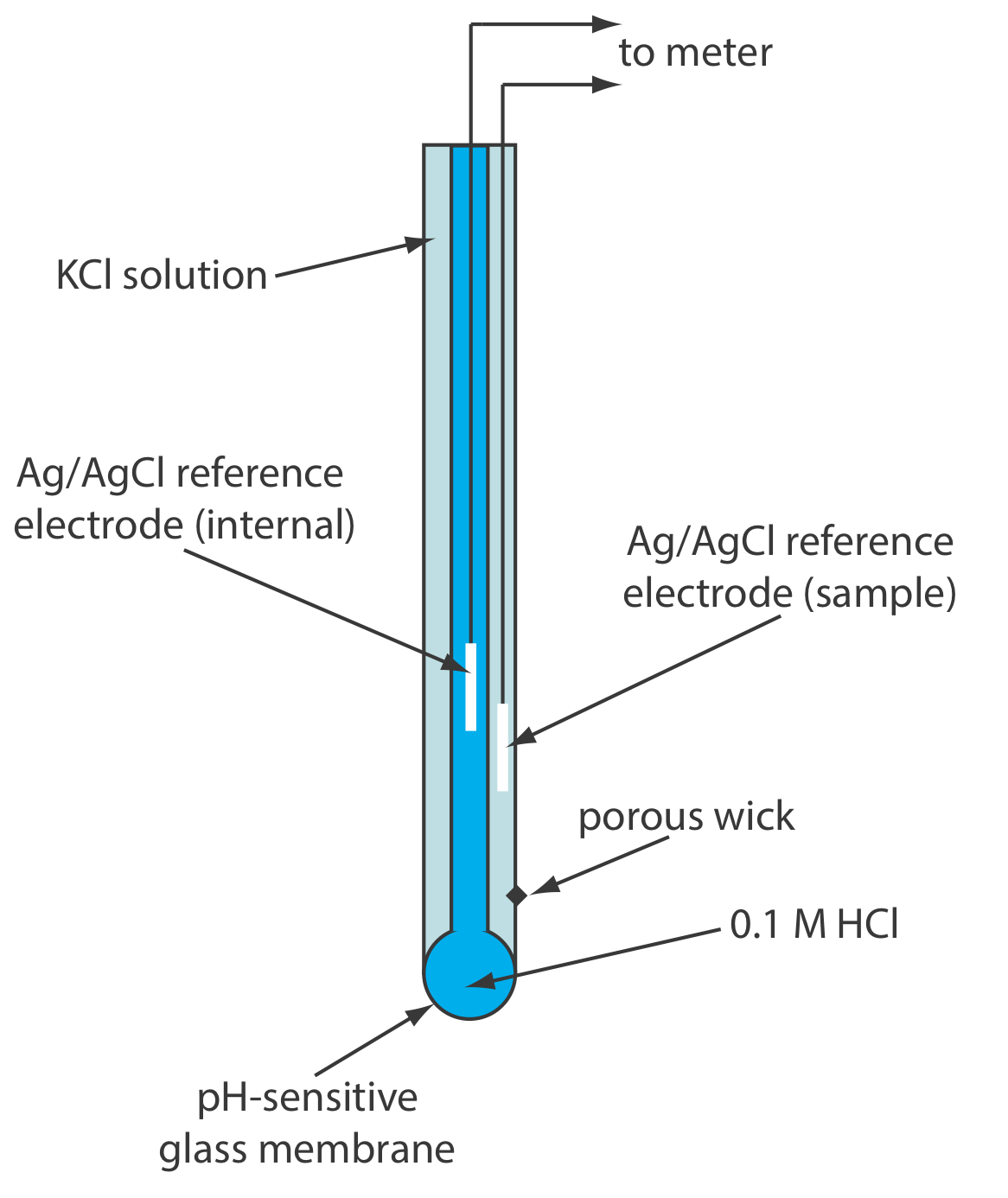
Los primeros electrodos selectivos de iones se basaron en la observación de que una fina membrana de vidrio que separa dos soluciones con diferentes niveles de acidez desarrolla una diferencia medible de potencial en lados opuestos de la membrana. La incorporación del electrodo de vidrio en un potenciómetro junto con un electrodo de referencia proporciona una manera de medir el potencial. Los electrodos de pH de membrana de vidrio comerciales a menudo están disponibles en una forma combinada que incluye tanto el electrodo indicador como el electrodo de referencia. El uso de un solo electrodo simplifica enormemente la medición del pH. Un ejemplo de un electrodo de combinación típico se muestra en la Figura\(\PageIndex{3}\).
La composición y estructura de las membranas de vidrio
Los primeros electrodos de vidrio comerciales se fabricaron utilizando Corning 015, un vidrio con una composición que es aproximadamente 22% Na 2 O, 6% CaO y 72% SiO 2. Las membranas elaboradas a partir de Corning 015 tienen una excelente selectividad para los iones hidrógeno, H +, por debajo de un pH de 9; por encima de este pH la membrana se vuelve más selectiva para otros cationes y el valor de pH medido se desvía de su valor real. La sustitución de Na 2 O y CaO por Li 2 O y BaO extiende el rango de pH útil de las membranas de vidrio a niveles de pH mayores a 12.
Origen del potencial límite para una membrana de vidrio
Cuando se sumerge en una solución acuosa durante varias horas, el exterior de aproximadamente 10 nm de la superficie de la membrana de vidrio se hidrata, resultando en la formación de sitios cargados negativamente, —SiO —. Los iones sodio, Na +, sirven como contraiones. Debido a que H + se une más fuertemente a —SiO — que Na +, desplazan los iones de sodio en ambos lados de la membrana.
\[\mathrm{H}^{+}+-\mathrm{SiO}^{-} \mathrm{Na}^{+}\rightleftharpoons-\mathrm{SiO}^{-} \mathrm{H}^{+}+\mathrm{Na}^{+} \label{glass1} \]
explicando la selectividad de la membrana para H +. El transporte de carga a través de la membrana es transportado por los iones Na + dentro de la membrana de vidrio. El potencial de un electrodo de vidrio obedece a la ecuación
\[E_{\mathrm{cell}}=K+0.05916 \log a_{\mathrm{H}^{+}} \label{glass2} \]
Errores alcalinos y ácidos
Como se señaló anteriormente, a valores de pH suficientemente básicos un electrodo de vidrio ya no proporciona una medida precisa del pH de una muestra ya que la membrana se vuelve más selectiva para otros cationes monovalentes, como Na + y K +.
Para una membrana de vidrio Corning 015, el coeficiente de selectividad K H + /Na + es\(\approx 10^{-11}\). ¿Cuál es el error esperado si medimos el pH de una solución en la que se encuentra la actividad de H +\(2 \times 10^{-13}\) y la actividad de Na + es 0.05?
Solución
Una solución en la que la actividad de H +, (a H +) actúa,\(2 \times 10^{-13}\) tiene un pH de 12.7. Debido a que el electrodo responde tanto a H + como a Na +, la actividad aparente de H +, (a H +) app, es
\[(a_{\text{H}^+})_\text{app} = (a_{\text{H}^+})_\text{act} + (K_{\text{H}^+ / \text{Na}^+} \times a_{\text{Na}^+}) = 2 \times 10^{-13} + (10^{-11} \times 0.05) = 7 \times 10^{-13} \nonumber \]
La actividad aparente de H + es equivalente a un pH de 12.2, un error de —0.5 unidades de pH.
Los electrodos de pH de vidrio también muestran desviaciones del comportamiento ideal a niveles de pH menores a 0.5, aunque las razones de esto no están claras. Aún así, un electrodo de vidrio tiene un amplio rango dinámico para medir el pH.
Otras limitaciones a los electrodos de vidrio
Debido a que la membrana de vidrio de un electrodo selectivo de iones es muy delgada (solo tiene aproximadamente 50 μm de grosor), deben manejarse con cuidado para evitar grietas o roturas. Los electrodos de vidrio generalmente se almacenan en un tampón de almacenamiento recomendado por el fabricante, lo que asegura que la superficie externa de la membrana permanezca hidratada. Si un electrodo de vidrio se seca, se reacondiciona remojándolo durante varias horas en una solución que contiene el analito. La composición de una membrana de vidrio cambiará con el tiempo, lo que afecta el rendimiento del electrodo. La vida útil promedio de un electrodo de vidrio típico es de varios años.
Electrodos de Vidrio para Otros Cationes
La observación de que la membrana de vidrio Corning 015 responde a iones distintos de H + condujo al desarrollo de membranas de vidrio con una mayor selectividad por otros cationes. Por ejemplo, se usa una membrana de vidrio con una composición de 11% de Na 2 O, 18% de Al 2 O 3 y 71% de SiO 2 como electrodo selectivo de iones para Na +. Se han desarrollado otros electrodos selectivos de iones de vidrio para el análisis de Li +, K +, Rb +, Cs +\(\text{NH}_4^+\), Ag + y Tl +. La tabla\(\PageIndex{1}\) proporciona varios ejemplos.
Electrodos de membrana cristalina
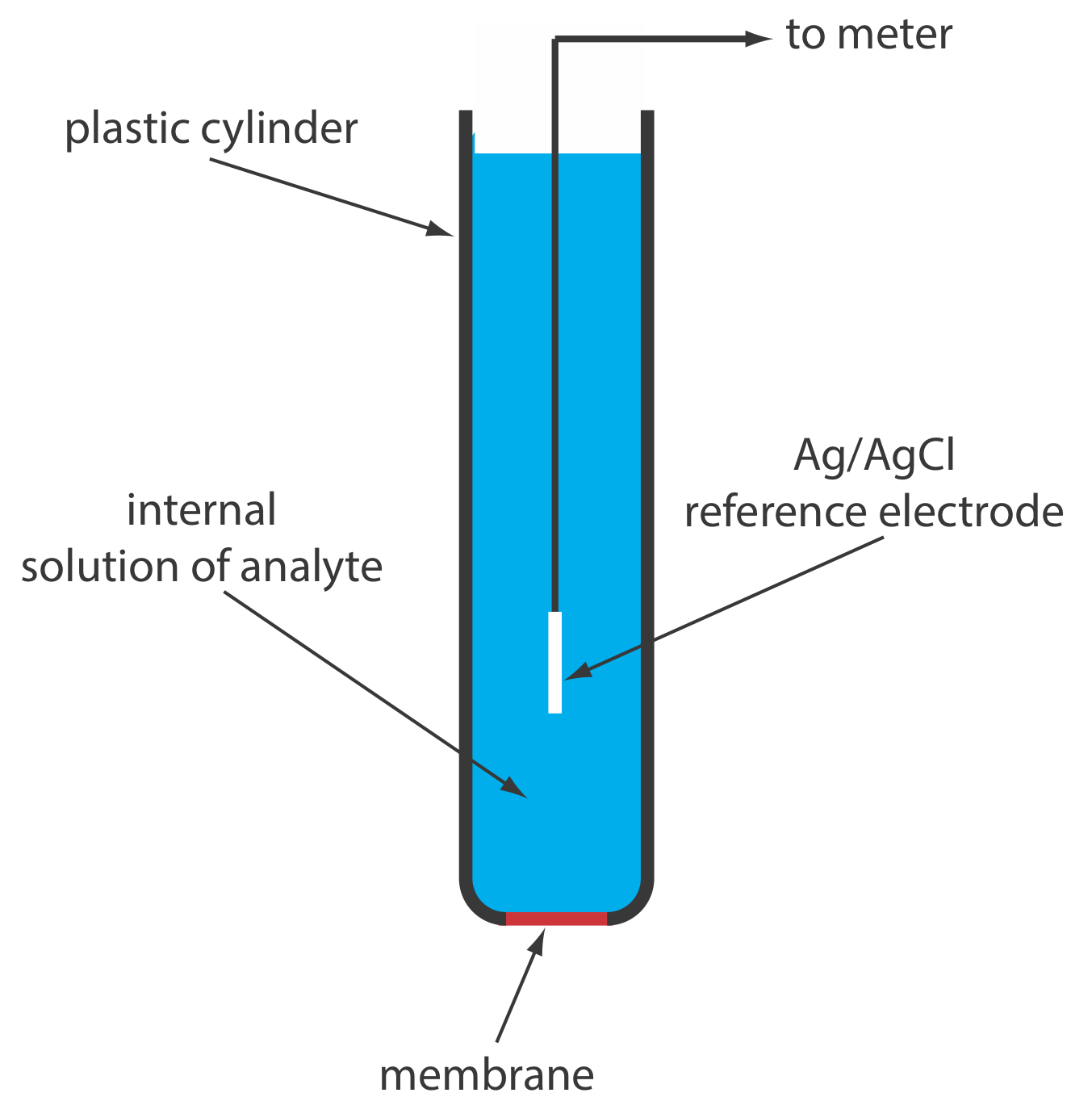
Un electrodo selectivo de iones en estado sólido tiene una membrana que consiste en una sal inorgánica policristalina o un solo cristal de una sal inorgánica. Podemos formar un electrodo policristalino selectivo de iones en estado sólido sellando un pellet de Ags de 1—2 mm de espesor, o una mezcla de AG y una segunda sal de plata u otro sulfuro metálico, en el extremo de un cilindro de plástico no conductor, llenando el cilindro con una solución interna que contenga el analito y colocando un electrodo de referencia en la solución interna. La figura\(\PageIndex{4}\) muestra un diseño típico.
El NaCl en un salero es un ejemplo de material policristalino porque consiste en muchos pequeños cristales de cloruro de sodio. Las placas de sal de NaCl utilizadas en la espectroscopia IR, por otro lado, son un ejemplo de un solo cristal de cloruro de sodio.
El potencial de membrana para un pellet de Ag 2 S se desarrolla como resultado de una diferencia en la extensión de la reacción de solubilidad
\[\mathrm{Ag}_{2} \mathrm{S}(s)\rightleftharpoons2 \mathrm{Ag}^{+}(a q)+\mathrm{S}^{2-}(a q) \label{ss1} \]
en los dos lados de la membrana, con carga transportada a través de la membrana por iones Ag +. Cuando usamos el electrodo para monitorear la actividad de Ag +, el potencial celular es
\[E_{\text {cell }}=K+0.05916 \log a_{\mathrm{Ag}^{+}} \label{ss2} \]
La membrana también responde a la actividad de\(\text{S}^{2-}\), con un potencial celular de
\[E_{\mathrm{cell}}=K-\frac{0.05916}{2} \log a_{\text{S}^{2-}} \label{ss3} \]
Si combinamos una sal de plata insoluble, como AgCl, con el Ag 2 S, entonces el potencial de membrana también responde a la concentración de Cl —, con un potencial celular de
\[E_{\text {cell }}=K-0.05916 \log a_{\mathrm{Cl}^{-}} \label{ss4} \]
Al mezclar Ag 2 S con CdS, Cu o PbS, podemos hacer un electrodo selectivo de iones que responda a la actividad de Cd 2 +, Cu 2 + o Pb 2 +. En este caso el potencial celular es
\[E_{\mathrm{cell}}=K+\frac{0.05916}{2} \ln a_{M^{2+}} \label{ss5} \]
donde un M 2 + es la actividad del ión metálico.
\(\PageIndex{2}\)La tabla proporciona ejemplos de electrodos selectivos de iones de estado sólido basados en Ag 2 policristalinos. La selectividad de estos electrodos selectivos de iones depende de la solubilidad relativa de los compuestos. Un Cl — ISE usando una membrana Ag 2 S/AgCl es más selectivo para Br — (K Cl — /Br — = 10 2) y para I — (K Cl — /I — = 10 6) porque AgBr y AgI son menos solubles que AgCl. Si la actividad de Br — es suficientemente alta, AgCl en la interfaz membrana/solución es reemplazado por AgBr y la respuesta del electrodo a Cl — disminuye sustancialmente. La mayoría de los electrodos policristalinos selectivos de iones enumerados en la Tabla\(\PageIndex{2}\) operan en un rango extendido de niveles de pH. El equilibrio entre S 2— y HS — limita el análisis para S2— a un rango de pH de 13—14.
| analito | composición de membrana | coeficientes de selectividad |
|---|---|---|
| Ag + | Ag 2 S |
\(K_{\text{Ag}^+/\text{Cu}^{2+}} = 10^{-6}\) \(K_{\text{Ag}^+/\text{Pb}^{2+}} = 10^{-10}\) Hg 2 + interfiere |
| Cd 2 + | Cds/Ag 2 S |
\(K_{\text{Cd}^{2+}/\text{Fe}^{2+}} = 200\) \(K_{\text{Cd}^{2+}/\text{Pb}^{2+}} = 6\) Ag +, Hg 2 + y Cu 2 + deben estar ausentes |
| Cu 2 + | Cus/AG 2 S |
\(K_{\text{Cu}^{2+}/\text{Fe}^{3+}} = 10\) \(K_{\text{Cu}^{2+}/\text{Cu}^{+}} = 10^{-6}\) Ag + y Hg 2 + deben estar ausentes |
| Pb 2 + | Pbs/Ag 2 S |
\(K_{\text{Pb}^{2+}/\text{Fe}^{3+}} = 1\) \(K_{\text{Pb}^{2+}/\text{Cd}^{2+}} = 1\) Ag +, Hg 2 + y Cu 2 + deben estar ausentes |
| Br — | Agbr/AG 2 S |
\(K_{\text{Br}^-/\text{I}^{-}} = 5000\) \(K_{\text{Br}^-/\text{Cl}^{-}} = 0.005\) \(K_{\text{Br}^-/\text{OH}^{-}} = 10^{-5}\) S 2— debe estar ausente |
| Cl — | AGCL/AG 2 S |
\(K_{\text{Cl}^-/\text{I}^{-}} = 10^{6}\) \(K_{\text{Cl}^-/\text{Br}^{-}} = 100\) \(K_{\text{Cl}^-/\text{OH}^{-}} = 0.01\) S 2— debe estar ausente |
| I — | Agi/AG 2 S |
\(K_{\text{I}^-/\text{S}^{2-}} = 30\) \(K_{\text{I}^-/\text{Br}^{-}} = 10^{-4}\) \(K_{\text{I}^-/\text{Cl}^{-}} = 10^{-6}\) \(K_{\text{I}^-/\text{OH}^{-}} = 10^{-7}\) |
| SCN — | AGSCN/Ag 2 S |
\(K_{\text{SCN}^-/\text{I}^{-}} = 10^{3}\) \(K_{\text{SCN}^-/\text{Br}^{-}} = 100\) \(K_{\text{SCN}^-/\text{Cl}^{-}} = 0.1\)\(K_{\text{SCN}^-/\text{OH}^{-}} = 0.01\) S 2— debe estar ausente |
| S 2— | Ag 2 S | Hg 2 + debe estar ausente |
| Los coeficientes de selectividad son aproximados; los valores encontrados experimentalmente pueden variar sustancialmente de los valores listados. Ver Cammann, K. Trabajando con electrodos selectivos de iones, Springer-Verlag: Berlín, 1977. | ||
La membrana de un electrodo selectivo de iones F se forma a partir de un solo cristal de LaF 3, que generalmente está dopado con una pequeña cantidad de EuF 2 para mejorar la conductividad de la membrana. Debido a que EuF 2 proporciona solo dos iones F, en comparación con los tres iones F, en LaF 3, cada EuF 2 produce una vacante en la red cristalina. Los iones fluoruro pasan a través de la membrana moviéndose a las vacantes adyacentes. Como se muestra en la Figura\(\PageIndex{4}\), la membrana LaF 3 se sella en el extremo de un cilindro de plástico no conductor, que contiene una solución estándar de F —, típicamente NaF 0.1 M, y un electrodo de referencia de Ag/AgCl.
El potencial de membrana para un F — ISE resulta de una diferencia en la solubilidad de LaF 3 en lados opuestos de la membrana, con el potencial dado por
\[E_{\mathrm{cell}}=K-0.05916 \log a_{\mathrm{F}^-} \label{ss6} \]
Una ventaja del electrodo selectivo de iones F es su libertad de interferencia. La única excepción significativa es OH — (K F — /OH — = 0.1), que impone un límite máximo de pH para un análisis exitoso. Por debajo de un pH de 4 la forma predominante de fluoruro en solución es HF, que no contribuye al potencial de membrana. Por esta razón, se realiza un análisis de fluoruro a un pH mayor a 4.
¿Cuál es el pH máximo que podemos tolerar si necesitamos analizar una solución en la que la actividad de F — sea\(1 \times 10^{-5}\) con un error inferior al 1%?
Solución
En presencia de OH — el potencial celular es
\[E_{\mathrm{cell}}=K-0.05916\left\{a_{\mathrm{F}^-}+K_{\mathrm{F}^- / \mathrm{OH}^{-}} \times a_{\mathrm{OH}^-}\right\} \nonumber \]
Para lograr un error inferior al 1%, el término\(K_{\mathrm{F}^- / \mathrm{OH}^{-}} \times a_{\mathrm{OH}^-}\) debe ser inferior al 1% de un F —; así
\[K_{\mathrm{F}^- / \mathrm{OH}^-} \times a_{\mathrm{OH}^{-}} \leq 0.01 \times a_{\mathrm{F}^-} \nonumber \]
\[0.10 \times a_{\mathrm{OH}^{-}} \leq 0.01 \times\left(1.0 \times 10^{-5}\right) \nonumber \]
Resolviendo para un OH — da la actividad máxima permisible para OH — as\(1 \times 10^{-6}\), que corresponde a un pH de menos de 8.
A diferencia de un electrodo selectivo de iones de membrana de vidrio, un ISE de estado sólido no necesita ser acondicionado antes de ser utilizado, y puede almacenarse en seco. La superficie del electrodo está sujeta a envenenamiento, como se describió anteriormente para un Cl — ISE en contacto con una concentración excesiva de Br —. Si un electrodo es envenenado, puede ser devuelto a su estado original lijando y puliendo la membrana cristalina.
Envenenamiento simplemente significa que la superficie ha sido modificada químicamente, como AgBr que se forma en la superficie de una membrana de AgCl.
Electrodos de membrana líquida
Otra clase de electrodos selectivos de iones utiliza una membrana hidrofóbica que contiene un agente complejante orgánico líquido que reacciona selectivamente con el analito. Se han utilizado tres tipos de agentes complejantes orgánicos: intercambiadores catiónicos, intercambiadores aniónicos e ionóforos neutros. Existe un potencial de membrana si la actividad del analito es diferente en los dos lados de la membrana. La corriente es transportada a través de la membrana por el analito.
Un ionóforo es un ligando cuyo exterior es hidrófobo y cuyo interior es hidrófilo. El éter corona que se muestra aquí es un ejemplo de un ionóforo neutro.
Un ejemplo de un electrodo selectivo de iones basado en líquido es el de Ca 2 +, que utiliza una membrana plástica porosa saturada con el intercambiador catiónico di- (n-decil) fosfato. Como se muestra en la Figura\(\PageIndex{5}\), la membrana se coloca en el extremo de un tubo cilíndrico no conductor y está en contacto con dos depósitos. El reservorio externo contiene di- (n-decil) fosfato en di- n-octilfenilfosfonato, el cual se empapa en la membrana porosa. El depósito interno contiene una solución acuosa estándar de Ca 2 + y un electrodo de referencia de Ag/AgCl. También están disponibles electrodos selectivos de iones de calcio en los que el fosfato de di- (n-decilo) se inmoviliza en una membrana de cloruro de polivinilo (PVC) que elimina la necesidad del reservorio externo.
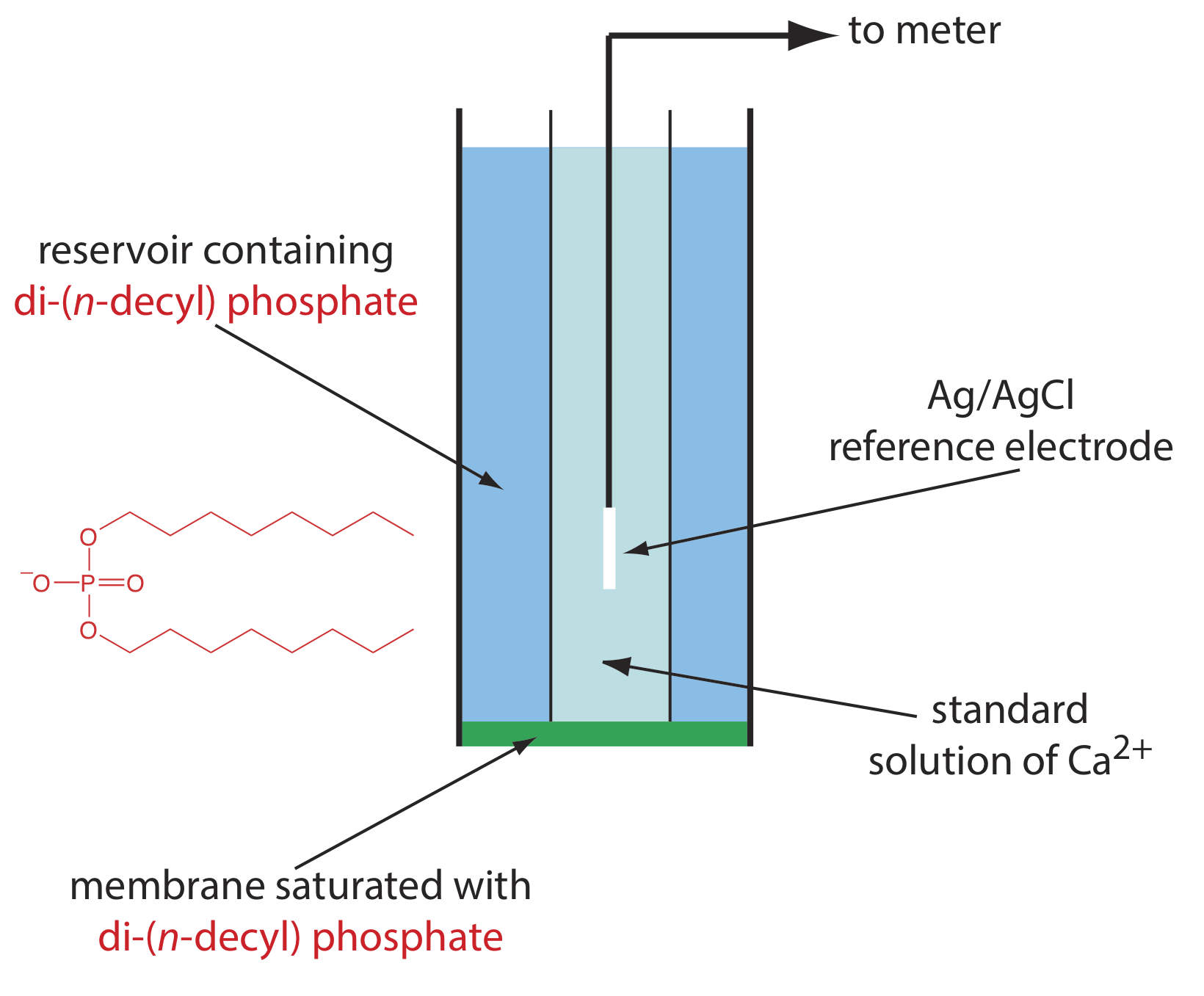
El potencial de membrana para el ISE Ca 2 + se desarrolla como resultado de una diferencia en la extensión de la reacción de complejación
\[\mathrm{Ca}^{2+}(a q)+2\left(\mathrm{C}_{10} \mathrm{H}_{21} \mathrm{O}\right)_{2} \mathrm{PO}_{2}^{-}(mem) \rightleftharpoons \mathrm{Ca}\left[\left(\mathrm{C}_{10} \mathrm{H}_{21} \mathrm{O}\right)_{2} \mathrm{PO}_{2}\right]_2 (mem) \label{liq1} \]
en los dos lados de la membrana, donde (mem) indica una especie que está presente en la membrana. El potencial celular para el electrodo selectivo de iones Ca 2 + es
\[E_{\mathrm{cell}}=K+\frac{0.05916}{2} \log a_{\mathrm{ca}^{2+}} \label{liq2} \]
La selectividad de este electrodo para Ca 2 + es muy buena, con solo Zn 2 + mostrando mayor selectividad.
En la\(\PageIndex{3}\) tabla se enumeran las propiedades de varios electrodos selectivos de iones basados en líquidos. Un electrodo que utiliza un depósito de líquido se puede almacenar en una solución diluida de analito y no necesita acondicionamiento adicional antes de su uso. La vida útil de un electrodo con membrana de PVC, sin embargo, es proporcional a su exposición a soluciones acuosas. Por esta razón estos electrodos se almacenan mejor cubriendo la membrana con una tapa junto con una pequeña cantidad de gasa humedecida para mantener un ambiente húmedo. Antes de usar el electrodo se acondiciona en una solución de analito durante 30—60 minutos.


