23.4: Sistemas de Electrodos Molecular-Selectivos
- Page ID
- 78984
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los electrodos del Capítulo 23.3 son selectivos hacia los iones. En esta sección consideramos cómo podemos incorporar un electrodo selectivo de iones en un electrodo que responda a especies neutras, como analitos volátiles, como CO 2 y NH 3, y compuestos bioquímicamente importantes, como aminoácidos y urea.
Electrodos de membrana con detección de
Varios electrodos de membrana responden a la concentración de un gas disuelto. El diseño básico de un electrodo sensor de gas, como se muestra en la Figura\(\PageIndex{1}\), consiste en una membrana delgada que separa la muestra de una solución interna que contiene un electrodo selectivo de iones. La membrana es permeable al analito gaseoso, pero impermeable a los componentes no volátiles en la matriz de la muestra. El analito gaseoso pasa a través de la membrana donde reacciona con la solución interna, produciendo una especie cuya concentración es monitoreada por el electrodo selectivo de iones. Por ejemplo, en un electrodo de CO 2, el CO 2 se difunde a través de la membrana donde reacciona en la solución interna para producir H 3 O +.
\[\mathrm{CO}_{2}(a q)+2 \mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons\text{ HCO}_{3}^{-}(a q)+\text{ H}_{3} \mathrm{O}^{+}(a q) \label{gas1} \]
El cambio en la actividad de H 3 O + en la solución interna se monitorea con un electrodo de pH, para lo cual el potencial celular, del Capítulo 23.3, es
\[E_\text{cell} = K + 0.09516 \log a_{\ce{H+}} \label{gas2} \]
Para encontrar la relación entre la actividad de H 3 O + en la solución interna y la actividad del CO 2 en la solución interna reorganizamos la expresión constante de equilibrio para la reacción\ ref {gas1}; así
\[a_{\mathrm{H}_{3} \mathrm{O}^{+}}=K_{\mathrm{a}} \times \frac{a_{\mathrm{CO}_{2}}}{a_{\mathrm{HCO}_{3}^{-}}} \label{gas3} \]
donde K a es la constante de equilibrio. Si la actividad de\(\text{HCO}_3^-\) en la solución interna es suficientemente grande, entonces su actividad no se ve afectada por la pequeña cantidad de CO 2 que pasa a través de la membrana. Sustituyendo la ecuación\ ref {gas3} en la ecuación\ ref {gas2} da
\[E_{\mathrm{cell}}=K^{\prime}+0.05916 \log a_{\mathrm{co}_{2}} \label{gas4} \]
donde K' es una constante que incluye la constante para el electrodo de pH, la constante de equilibrio para la reacción\ ref {gas1} y la actividad de\(\text{HCO}_3^-\) en la solución interna.
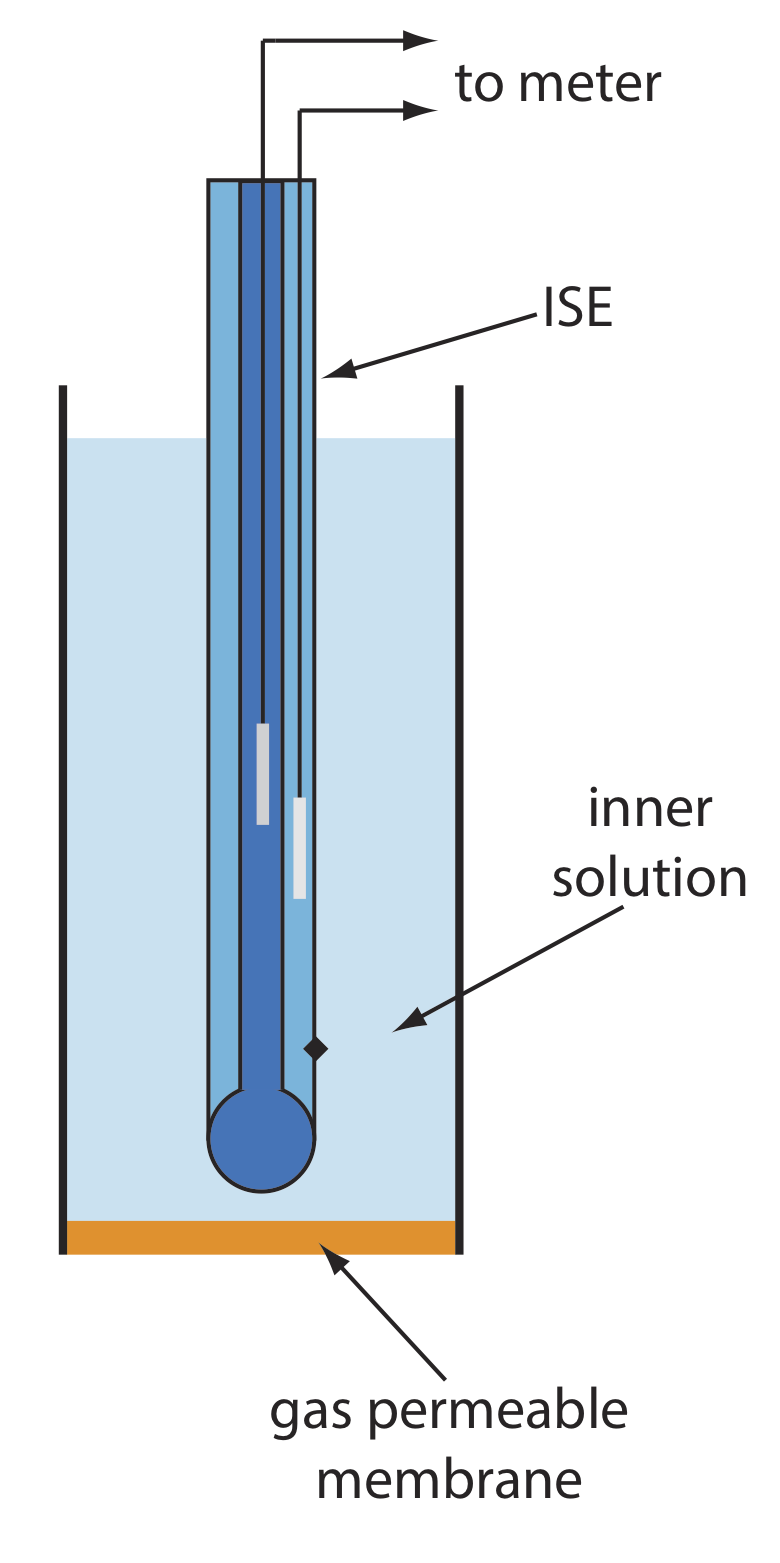
En la\(\PageIndex{1}\) tabla se enumeran las propiedades de varios electrodos sensores de gas. La composición de la solución interna cambia con el uso, y tanto la solución interna como la membrana deben reemplazarse periódicamente. Los electrodos sensores de gas se almacenan en una solución similar a la solución interna para minimizar su exposición a los gases atmosféricos.
Electrodos de membrana biocatalítica
El enfoque para el desarrollo de electrodos sensores de gas se puede modificar para crear electrodos potenciométricos que respondan a especies bioquímicamente importantes. La clase más común de biosensores potenciométricos son los electrodos enzimáticos, en los que atrapamos o inmovilizamos una enzima en la superficie de un electrodo potenciométrico. La reacción del analito con la enzima produce un producto cuya concentración es monitoreada por el electrodo potenciométrico. Los biosensores potenciométricos también se han diseñado alrededor de otras especies biológicamente activas, incluyendo anticuerpos, partículas bacterianas, tejidos y receptores hormonales.
Un ejemplo de un electrodo enzimático es el electrodo de urea, que se basa en la hidrólisis catalítica de la urea por la ureasa
\[\mathrm{CO}\left(\mathrm{NH}_{2}\right)_{2}(a q)+2 \mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons 2 \mathrm{NH}_{4}^{+}(a q)+\text{ CO}_{3}^{-}(a q) \label{bio1} \]
La figura\(\PageIndex{2}\) muestra una versión del electrodo de urea, que modifica un electrodo NH 3 sensor de gas mediante la adición de una membrana de diálisis que atrapa una solución tamponada de ureasa a pH 7.0 entre la membrana de diálisis y la membrana permeable a los gases [(a) Papastathopoulos, D. S.; Rechnitz, G. A. Anal. Chim. Acta 1975, 79, 17—26; b) Riechel, T. L. J. Chem. Educ. 1984, 61, 640—642]. Un electrodo NH 3, como se muestra en la Tabla\(\PageIndex{1}\), utiliza una membrana permeable a los gases y un electrodo de pH de vidrio. El NH 3 se difunde a través de la membrana donde cambia el pH de la solución interna.
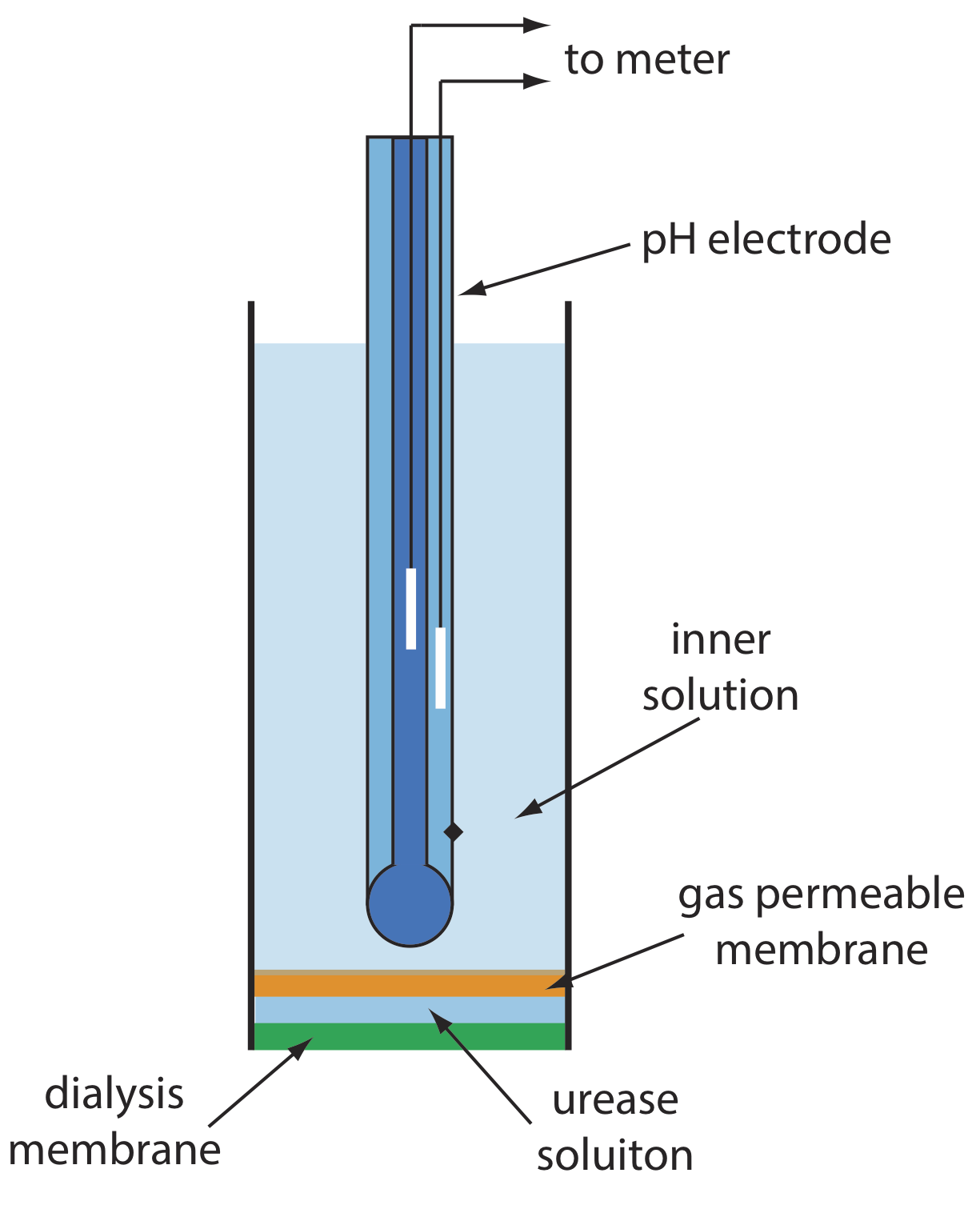
Al sumergirse en la muestra, la urea se difunde a través de la membrana de diálisis donde reacciona con la enzima ureasa para formar el ión amonio\(\text{NH}_4^+\), que se encuentra en equilibrio con NH 3.
\[\mathrm{NH}_{4}^{+}(a q)+\mathrm{H}_{2} \mathrm{O}(l ) \rightleftharpoons \text{ H}_{3} \mathrm{O}^{+}(a q)+\text{ NH}_{3}(a q) \label{bio2} \]
El NH 3, a su vez, se difunde a través de la membrana permeable a los gases donde un electrodo de pH mide el cambio resultante en el pH. La respuesta del electrodo a la concentración de urea es
\[E_{\text {cell }}=K-0.05916 \log a_{\text {urea }} \label{bio3} \]
Otra versión del electrodo de urea (Figura\(\PageIndex{3}\)) inmoviliza la enzima ureasa en una membrana polimérica formada directamente en la punta de un electrodo de pH de vidrio [Tor, R.; Freeman, A. Anal. Chem. 1986, 58, 1042—1046]. En este caso la respuesta del electrodo es
\[\mathrm{pH}=K a_{\mathrm{urea}} \label{bio4} \]
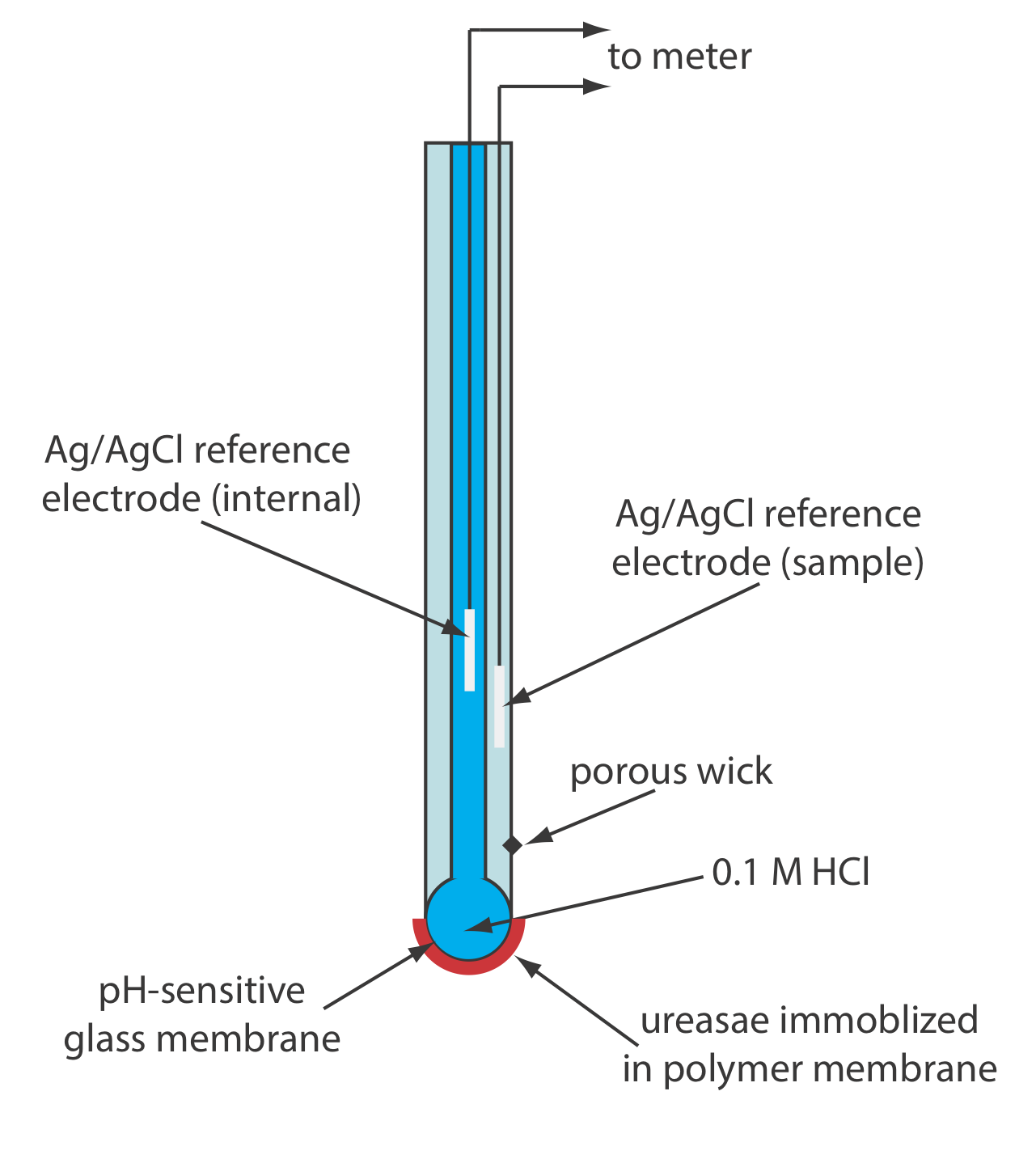
Pocos biosensores potenciométricos están disponibles comercialmente. Como se muestra en la Figura\(\PageIndex{2}\) y la Figura\(\PageIndex{3}\), sin embargo, es posible convertir un electrodo selectivo de iones o un electrodo sensor de gas en un biosensor. En la Tabla se describen varios ejemplos representativos\(\PageIndex{2}\), y se pueden encontrar ejemplos adicionales en los recursos adicionales de este capítulo.
| analito | fase biológicamente activa | sustancia determinada |
|---|---|---|
| \(5^{\prime}\)-AMP | AMP-desaminasa (E) | NH 3 |
| L-arginina | arginina y ureasa (E) | NH 3 |
| asparagina | asparaginasa (E) | \(\text{NH}_4^+\) |
| L-cisteína | Proteus morganii (B) | H 2 S |
| L-glutamato | calabaza amarilla (T) | CO 2 |
| L-glutamina | Sarcina flava (B) | NH 3 |
| oxalato | oxalato descarboxilasa (E) | CO 2 |
| penicilina | peniclinasa (E) | H 3 O + |
| L-fenilalanina | L-aminoácido oxidasa/peroxidasa de rábano picante (E) | I — |
| azúcares | bacterias de la placa dental (B) | H 3 O + |
| urea | ureasa (E) | NH 3 o H 3 O + |
|
Fuente: Cumplido de Cammann, K. Trabajando con electrodos selectivos de iones, Springer-Verlag: Berlín, 1977 y Lunte, C. E.; Heineman, W. R. “Técnicas electroquímicas en bioanálisis”, en Steckham, E. ed. Temas en Química Actual, Vol. 143, Springer-Verlag: Berlín, 1988, p.8. Abreviaturas para la fase biológicamente activa: E = enzima; B = partícula bacteriana; T = tejido. |
||


