28.6: Cromatografía de intercambio iónico
- Page ID
- 79037
En la cromatografía de intercambio iónico (IEC) la fase estacionaria es una resina polimérica reticulada, generalmente poliestireno reticulado con divinilbenceno, con grupos funcionales iónicos unidos covalentemente (ver Figura 28.6.1 y Tabla 28.6.1 ). Los contraiones a estas cargas fijas son móviles y son desplazados por iones que compiten más favorablemente por los sitios de intercambio. Las resinas de intercambio iónico se dividen en cuatro categorías: intercambiadores catiónicos ácidos fuertes; intercambiadores catiónicos ácidos débiles; intercambiadores aniónicos de base fuerte; e intercambiadores aniónicos de base débil.
 |
 |
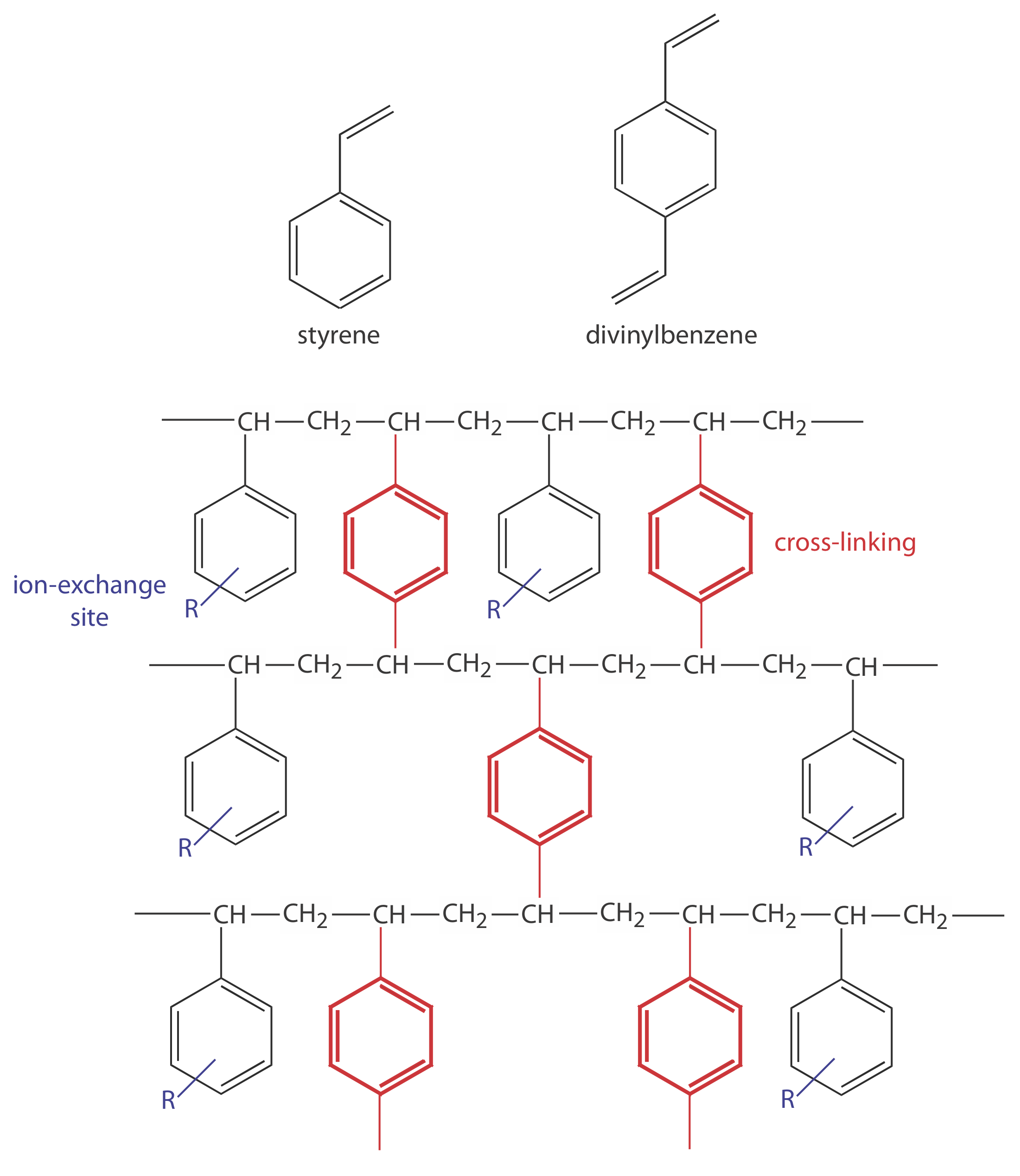
Figura 28.6.1 . Las estructuras de estireno, divinilbenceno y un copolímero de estireno-divinilbenceno modificado para su uso como resina de intercambio iónico se muestran a la izquierda. Los sitios de intercambio iónico, indicados por R y mostrados en azul, están en su mayoría en la posición para y no están necesariamente unidos a todas las unidades de estireno. La reticulación se muestra en rojo. La foto de la derecha muestra un ejemplo de las perlas de polímero. Estas cuentas tienen aproximadamente 0.30—0.85 mm de diámetro. Las resinas para su uso en cromatografía de intercambio iónico suelen tener un diámetro de 5—11 μm.
Los intercambiadores catiónicos de ácido fuerte incluyen un grupo funcional ácido sulfónico que lo retiene en forma aniónica y, por lo tanto, su capacidad de intercambio iónico, en soluciones fuertemente ácidas. Los grupos funcionales para un intercambiador catiónico ácido débil, por otro lado, están completamente protonados a niveles de pH inferiores a 4 y pierden su capacidad de intercambio. Los intercambiadores aniónicos de base fuerte incluyen una amina cuaternaria, que retiene una carga positiva incluso en soluciones fuertemente básicas. Los intercambiadores aniónicos de base débil permanecen protonados solo a niveles de pH moderadamente básicos. Bajo condiciones más básicas, un intercambiador aniónico de base débil pierde un protón y su capacidad de intercambio.
La reacción de intercambio iónico de un sitio de intercambio catiónico monovalente, M +, es
\[-\mathrm{SO}_{3}^{-} \mathrm{H}^{+}(s)+\mathrm{M}^{+}(a q)\rightleftharpoons-\mathrm{SO}_{3}^{-} \mathrm{M}^{+}(s)+\mathrm{H}^{+}(a q) \nonumber \]
La constante de equilibrio para esta reacción de intercambio iónico, que llamamos el coeficiente de selectividad, K, es
donde usamos corchetes, {}, para indicar una concentración superficial en lugar de una concentración de solución.
No solemos pensar en la concentración de un sólido. Hay una buena razón para ello. En la mayoría de los casos, la concentración de un sólido es una constante. Si rompes un trozo de tiza en dos partes, por ejemplo, la masa y el volumen de cada pieza conservan la misma relación proporcional que en la pieza de tiza original. Sin embargo, cuando consideramos una unión iónica a un sitio reactivo en la superficie del sólido, la fracción de sitios que están unidos, y por lo tanto la concentración de sitios unidos, puede tomar cualquier valor entre 0 y algún valor máximo que sea proporcional a la densidad de sitios reactivos.
Reordenando la ecuación\ ref {12.1} nos muestra que la relación de distribución, D, para la reacción de intercambio
\[D=\frac{\text { amount of } \mathrm{M}^{+} \text { in the stationary phase }}{\text { amount of } \mathrm{M}^{+} \text { in the mobile phase }} \nonumber \]
es una función de la concentración de H + y, por tanto, del pH de la fase móvil.
La selectividad de una resina de intercambio iónico depende en cierto modo de si incluye sitios de intercambio fuertes o débiles y del grado de reticulación. Esto último es particularmente importante ya que controla la permeabilidad de la resina y, por lo tanto, la accesibilidad de los sitios de intercambio. Un orden aproximado de selectividad para una resina de intercambio catiónico de ácido fuerte típica, en orden decreciente de D, es
Al 3 + > Ba 2 + > Pb 2 + > Ca 2 + > Ni 2 + > Cd 2 + > Cu 2 + > Co 2 + > Zn 2 + > Mg 2 + > Ag + > K +\(\text{NH}_4^+\) > > Na + > H + > Li +
Tenga en cuenta que los cationes altamente cargados se unen más fuertemente que los cationes de menor carga, y que para los cationes de carga similar, aquellos con un radio hidratado más pequeño, o que son más polarizables, se unen más fuertemente. Para un intercambiador aniónico de base fuerte, el orden general de elución es
\(\text{SO}_4^{2-}\)> I — >\(\text{HSO}_4^-\) >\(\text{NO}_3^-\) > Br —\(\text{NO}_2^-\) > > Cl — >\(\text{HCO}_3^-\) > CH3COO — > OH — > F —
Los aniones de mayor carga y de menor radio hidratado se unen con mayor fuerza que los aniones con menor carga y mayor radio hidratado.
La fase móvil en IEC suele ser un tampón acuoso, cuyo pH y composición iónica determinan el tiempo de retención de un soluto. Las eluciones en gradiente son posibles en las que la fuerza iónica o el pH de la fase móvil se cambia con el tiempo. Por ejemplo, una separación IEC de cationes podría usar una solución diluida de HCl como fase móvil. El aumento de la concentración de HCl acelera la tasa de elución para cationes retenidos más fuertemente porque la mayor concentración de H + le permite competir con mayor éxito por los sitios de intercambio iónico.
A partir de la Ecuación\ ref {12.2}, la relación de distribución de un catión, D, se vuelve más pequeña cuando aumenta la concentración de H + en la fase móvil.
Una resina de intercambio iónico se incorpora a una columna de HPLC ya sea como perlas de polímero poroso de 5—11 μm o recubriendo la resina sobre partículas porosas de sílice. Las columnas suelen tener una longitud de 250 mm con diámetros internos que van de 2 a 5 mm.
La medición de la conductividad de la fase móvil a medida que eluye de la columna sirve como detector universal para analitos catiónicos y aniónicos. Debido a que la fase móvil contiene una alta concentración de iones —una fase móvil de HCl diluido, por ejemplo, contiene concentraciones significativas de iones H + y Cl —, necesitamos un método para detectar los analitos en presencia de una conductividad de fondo significativa.
Para minimizar la contribución de la fase móvil a la conductividad, se coloca una columna supresora de iones entre la columna analítica y el detector. Esta columna elimina selectivamente iones de fase móvil sin eliminar iones soluto. Por ejemplo, en cromatografía de intercambio catiónico usando una solución diluida de HCl como fase móvil, la columna supresora contiene una resina de intercambio aniónico de base fuerte. La reacción de intercambio
\[\mathrm{H}^{+}(a q)+\mathrm{Cl}^{-}(a q)+\mathrm{Resin}^{+} \mathrm{OH}^{-}(s)\rightleftharpoons\operatorname{Resin}^{+} \mathrm{Cl}^{-}(s)+\mathrm{H}_{2} \mathrm{O}(l ) \nonumber \]
reemplaza los iones de fase móvil H + y Cl — por H 2 O. Un proceso similar se utiliza en la cromatografía de intercambio aniónico donde la columna supresora contiene una resina de intercambio catiónico. Si la fase móvil es una solución de Na 2 CO 3, la reacción de intercambio
\[2 \mathrm{Na}^{+}(a q)+\mathrm{CO}_{3}^{2-}(a q)+2 \operatorname{Resin}^{-} \mathrm{H}^{+}(s)\rightleftharpoons2 \operatorname{Resin}^{-} \mathrm{Na}^{+}(s)+\mathrm{H}_{2} \mathrm{CO}_{3}(a q) \nonumber \]
reemplaza un electrolito fuerte, Na 2 CO 3, por un electrolito débil, H 2 CO 3.
La supresión de iones es necesaria cuando la fase móvil contiene una alta concentración de iones. La cromatografía iónica de una sola columna, en la que no se necesita una columna supresora de iones, es posible si la concentración de iones en la fase móvil es pequeña. Típicamente, la fase estacionaria es una resina con una baja capacidad de intercambio iónico y la fase móvil es una solución muy diluida de ácido metansulfónico para analitos catiónicos, o benzoato de potasio o hidrógeno ftalato de potasio para analitos aniónicos. Debido a que la conductividad de fondo es suficientemente pequeña, es posible monitorear un cambio en la conductividad a medida que los analitos eluyen de la columna.
Se puede usar un detector de absorbancia UV/Vis si los analitos absorben radiación ultravioleta o visible. Alternativamente, podemos detectar indirectamente analitos que no absorben en los UV/Vis si la fase móvil contiene una especie absorbente de UV/Vis. En este caso, cuando una banda de soluto pasa a través del detector, se mide una disminución en la absorbancia en el detector.
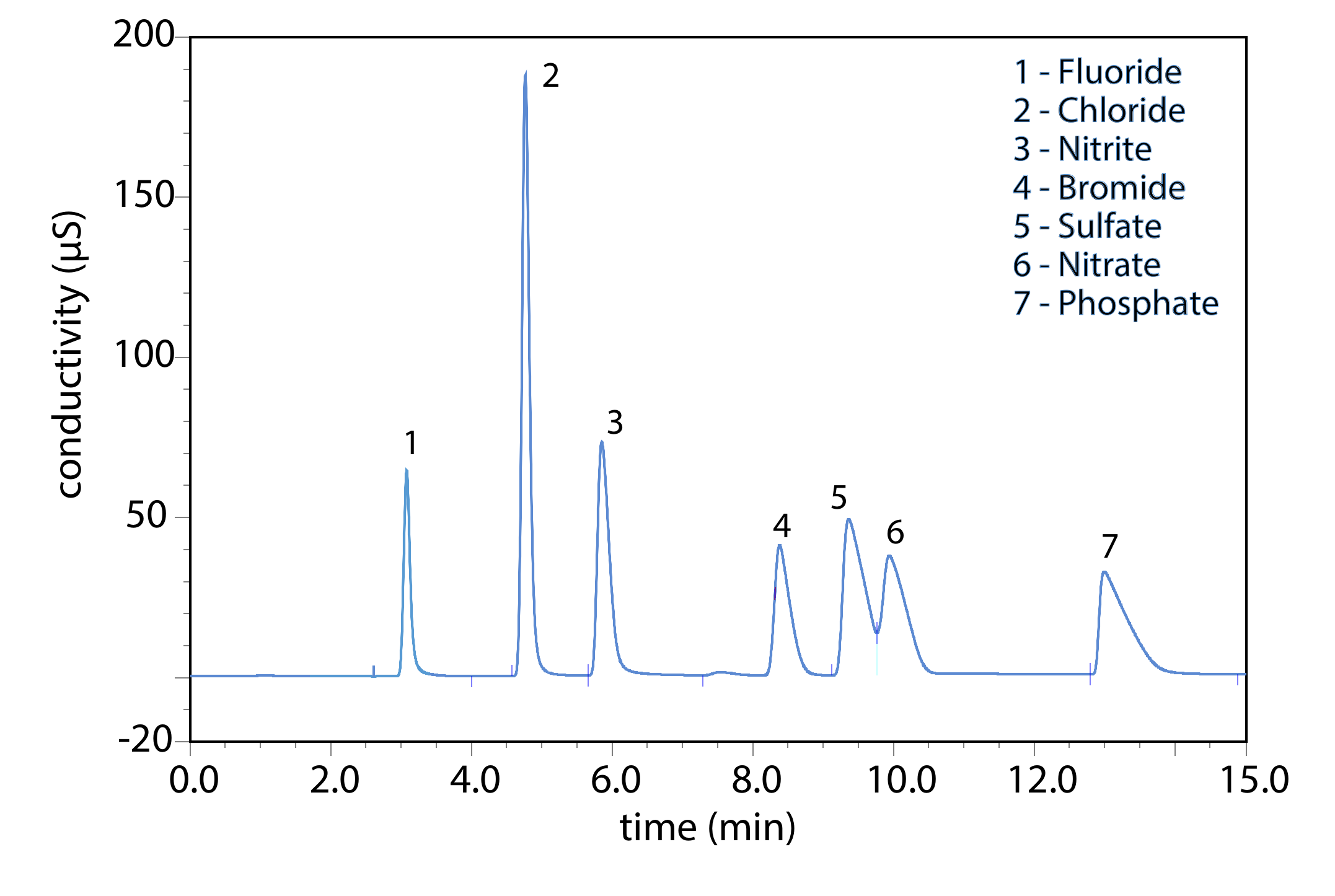
La cromatografía de intercambio iónico es una técnica importante para el análisis de aniones y cationes en agua. Por ejemplo, un análisis cromatográfico de intercambio iónico para los aniones F —, Cl —, Br —\(\text{NO}_2^-\),\(\text{NO}_3^-\),\(\text{PO}_4^{3-}\), y\(\text{SO}_4^{2-}\) toma aproximadamente 15 minutos (Figura 28.6.2 ). Un análisis completo del mismo conjunto de aniones mediante una combinación de potenciometría y espectrofotometría requiere de 1 a 2 días. La cromatografía de intercambio iónico también se utiliza para el análisis de proteínas, aminoácidos, azúcares, nucleótidos, productos farmacéuticos, productos de consumo y muestras clínicas.