30.2: Electroforesis Capilar
- Page ID
- 78882
Teoría de Electroforesis
En electroforesis capilar inyectamos la muestra en una solución tamponada retenida dentro de un tubo capilar. Cuando se aplica un campo eléctrico a través del tubo capilar, los componentes de la muestra migran como resultado de dos tipos de acciones: movilidad electroforética y movilidad electroosmótica. La movilidad electroforética es la respuesta del soluto al campo eléctrico aplicado en el que los cationes se mueven hacia el cátodo cargado negativamente, los aniones se mueven hacia el ánodo cargado positivamente y las especies neutras permanecen estacionarias. La otra contribución a la migración de un soluto es el flujo electroosmótico, que ocurre cuando el tampón se mueve a través del capilar en respuesta al campo eléctrico aplicado. En condiciones normales el tampón se mueve hacia el cátodo, barriendo la mayoría de los solutos, incluyendo los aniones y especies neutras, hacia el cátodo cargado negativamente.
Movilidad Electroforética
La velocidad con la que se mueve un soluto en respuesta al campo eléctrico aplicado se denomina velocidad electroforética,\(\nu_{ep}\); se define como
\[\nu_{ep}=\mu_{ep} E \label{12.1} \]
donde\(\mu_{ep}\) está la movilidad electroforética del soluto, y E es la magnitud del campo eléctrico aplicado. La movilidad electroforética de un soluto se define como
\[\mu_{ep}=\frac{q}{6 \pi \eta r} \label{12.2} \]
donde q es la carga del soluto,\(\eta\) es la viscosidad del tampón y r es el radio del soluto. Usando la Ecuación\ ref {12.1} y la Ecuación\ ref {12.2} podemos sacar varias conclusiones importantes sobre la velocidad electroforética de un soluto. La movilidad electroforética y, por lo tanto, la velocidad electroforética, aumenta para solutos con mayor carga y para solutos de menor tamaño. Debido a que q es positivo para un catión y negativo para un anión, estas especies migran en direcciones opuestas. Una especie neutra, para la cual q es cero, tiene una velocidad electroforética de cero.
Movilidad Electroosmótica
Cuando se aplica un campo eléctrico a un capilar lleno de un tampón acuoso, esperamos que los iones del tampón migren en respuesta a su movilidad electroforética. Debido a que el disolvente, H 2 O, es neutro, podríamos esperar razonablemente que permanezca estacionario. Lo que observamos en condiciones normales, sin embargo, es que el búfer se mueve hacia el cátodo. A este fenómeno se le llama flujo electroosmótico.
El flujo electroosmótico ocurre porque las paredes del tubo capilar transportan una carga. La superficie de un capilar de sílice contiene un gran número de grupos silanol (—SiOH). A un nivel de pH superior a aproximadamente 2 o 3, los grupos silanol se ionizan para formar iones de silanato cargados negativamente (—SiO —). Los cationes del tampón son atraídos por los iones de silanato. Como se muestra en la Figura 30.2.1 , algunos de estos cationes se unen fuertemente a los iones silanato, formando una capa fija. Debido a que los cationes en la capa fija solo neutralizan parcialmente la carga negativa en las paredes capilares, la solución adyacente a la capa fija, que se llama capa difusa, contiene más cationes que aniones. Juntas estas dos capas se conocen como la doble capa. Los cationes en la capa difusa migran hacia el cátodo. Debido a que estos cationes están solvatados, la solución también es arrastrada, produciendo el flujo electroosmótico.
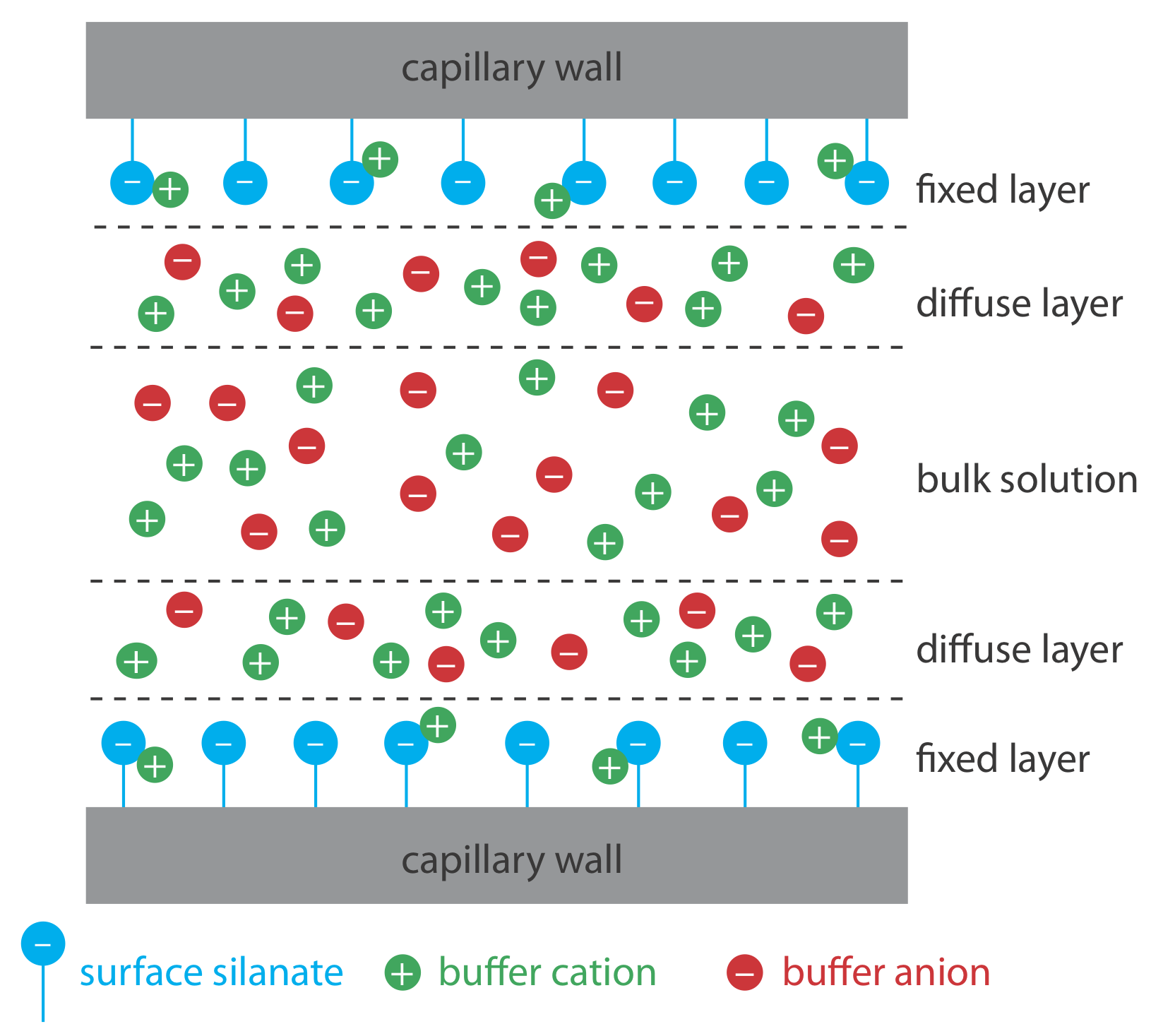
Los aniones en la capa difusa, que también están solvatados, intentan moverse hacia el ánodo. Debido a que hay más cationes que aniones, sin embargo, los cationes ganan y el flujo electroosmótico se mueve en la dirección del cátodo.
La velocidad a la que el búfer se mueve a través del capilar, lo que llamamos su velocidad de flujo electroosmótico\(\nu_{eof}\),, es una función del campo eléctrico aplicado, E, y la movilidad electroosmótica del búfer,\(\mu_{eof}\).
\[\nu_{eof}=\mu_{e o f} E \label{12.3} \]
La movilidad electroosmótica se define como
\[\mu_{eof}=\frac{\varepsilon \zeta}{4 \pi \eta} \label{12.4} \]
donde\(\epsilon\) es la constante dieléctrica del tampón,\(\zeta\) es el potencial zeta, y\(\eta\) es la viscosidad del tampón.
El potencial zeta, el potencial de la capa difusa a una distancia finita de la pared capilar, juega un papel importante en la determinación de la velocidad del flujo electroosmótico. Dos factores determinan el valor del potencial zeta. Primero, el potencial zeta es directamente proporcional a la carga en las paredes capilares, con una mayor densidad de iones silanato que corresponde a un mayor potencial zeta. Por debajo de un pH de 2 hay pocos iones de silanato y el potencial zeta y la velocidad de flujo electroosmótico se acercan a cero. A medida que aumenta el pH, tanto el potencial zeta como la velocidad de flujo electroosmótico aumentan. Segundo, el potencial zeta es directamente proporcional al grosor de la doble capa. El aumento de la fuerza iónica del tampón proporciona una mayor concentración de cationes, lo que disminuye el grosor de la doble capa y disminuye el flujo electroosmótico.
La definición de potencial zeta dada aquí es cierto que es un poco borrosa. Para una explicación más detallada ver Delgado, A. V.; González-Caballero, F.; Hunter, R. J.; Koopal, L. K.; Lyklema, J. “Medición e interpretación de fenómenos electrocinéticos”, Pure. Appl. Chem. 2005, 77, 1753—1805. Si bien se trata de un informe muy técnico, las Secciones 1.3—1.5 proporcionan una buena introducción a la dificultad de definir el potencial zeta y de medir su valor.
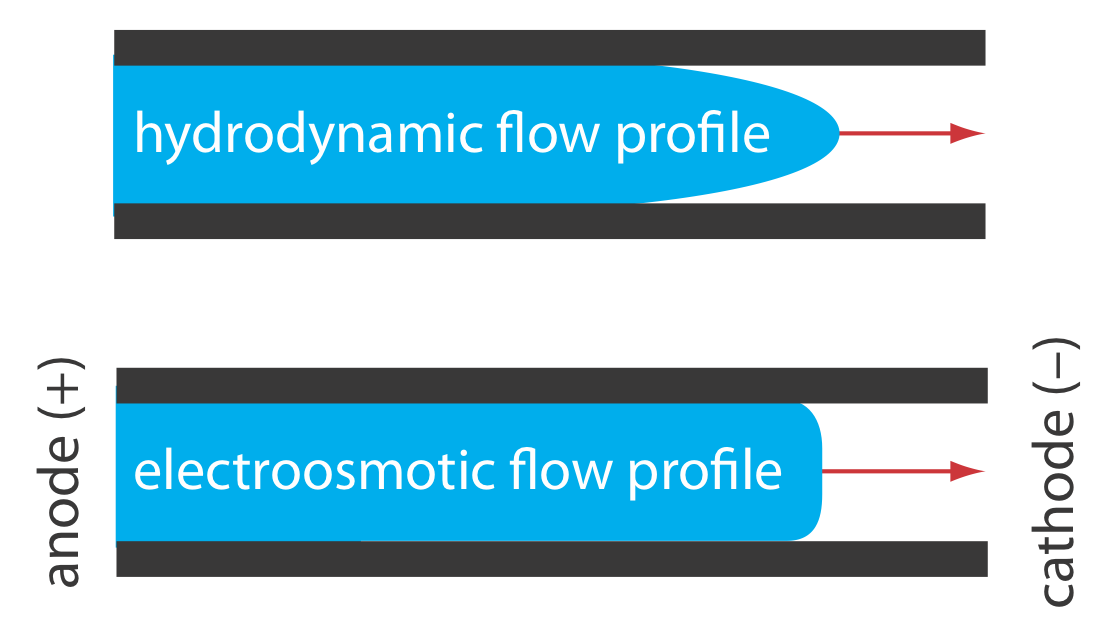
El perfil de flujo electroosmótico es muy diferente al de un fluido que se mueve bajo presión forzada. La Figura 30.2.2 compara el perfil de flujo electroosmótico con el perfil de flujo hidrodinámico en cromatografía de gases y cromatografía líquida. El perfil uniforme y plano para electroósmosis ayuda a minimizar el ensanchamiento de banda en la electroforesis capilar, mejorando la eficiencia de separación.
Movilidad Total
La velocidad total de un soluto\(\nu_{tot}\), a medida que se mueve a través del capilar es la suma de su velocidad electroforética y la velocidad de flujo electroosmótico.
\[\nu_{t o t}=\nu_{ep}+\nu_{eof} \nonumber \]
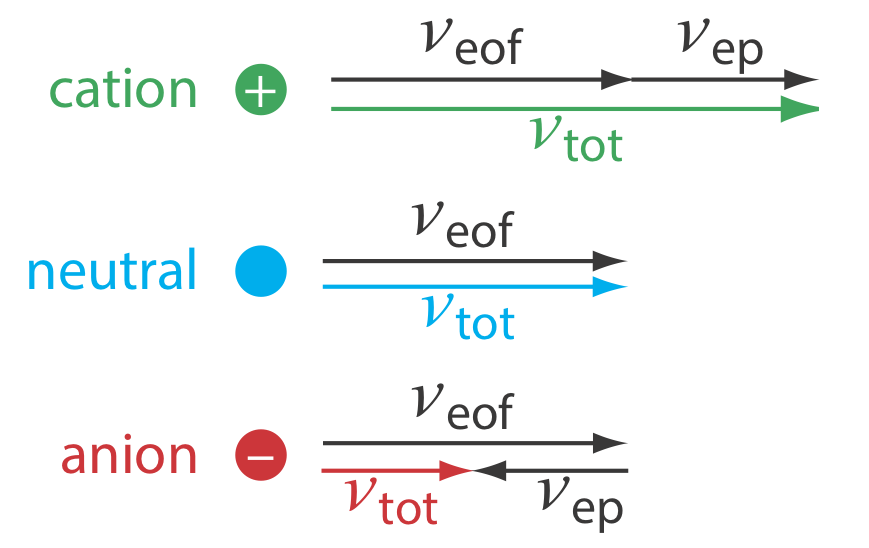
Como se muestra en la Figura 30.2.3 , en condiciones normales las siguientes relaciones generales se mantienen verdaderas.
\[(\nu_{tot})_{cations} > \nu_{eof} \nonumber \]
\[(\nu_{tot})_{neutrals} = \nu_{eof} \nonumber \]
\[(\nu_{tot})_{anions} < \nu_{eof} \nonumber \]
Los cationes eluyen primero en un orden que corresponde a sus movilidades electroforéticas, con cationes pequeños y altamente cargados eluyendo antes de cationes más grandes de menor carga. Las especies neutras eluyen como una sola banda con una tasa de elución igual a la velocidad de flujo electroosmótico. Finalmente, los aniones son los últimos componentes en eluir, con los aniones más pequeños y altamente cargados que tienen el tiempo de elución más largo.
Tiempo de migración
Otra forma de expresar la velocidad de un soluto es dividir la distancia que recorre por el tiempo transcurrido
\[\nu_{tot}=\frac{l}{t_{m}} \label{12.5} \]
donde l es la distancia entre el punto de inyección y el detector, y t m es el tiempo de migración del soluto. Para comprender las variables experimentales que afectan el tiempo de migración, comenzamos por señalar que
\[\nu_{tot} = \mu_{tot}E = (\mu_{ep} + \mu_{eof})E \label{12.6} \]
Combinando la Ecuación\ ref {12.5} y la Ecuación\ ref {12.6} y resolviendo para t m nos deja con
\[t_{\mathrm{m}}=\frac{l}{\left(\mu_{ep}+\mu_{eof}\right) E} \label{12.7} \]
La magnitud del campo eléctrico es
\[E=\frac{V}{L} \label{12.8} \]
donde V es el potencial aplicado y L es la longitud del tubo capilar. Finalmente, sustituyendo la Ecuación\ ref {12.8} por la Ecuación\ ref {12.7} nos deja con la siguiente ecuación para el tiempo de migración de un soluto.
\[t_{\mathrm{m}}=\frac{lL}{\left(\mu_{ep}+\mu_{eof}\right) V} \label{12.9} \]
Para disminuir el tiempo de migración de un soluto, lo que acorta el tiempo de análisis, podemos aplicar un voltaje más alto o usar un tubo capilar más corto. También podemos acortar el tiempo de migración aumentando el flujo electroosmótico, aunque esto disminuye la resolución.
Eficiencia
Como aprendimos en el Capítulo 26.3, la eficiencia de una separación viene dada por el número de placas teóricas, N. En electroforesis capilar el número de placas teóricas es
\[N=\frac{l^{2}}{2 D t_{m}}=\frac{\left(\mu_{e p}+\mu_{eof}\right) E l}{2 D L} \label{12.10} \]
donde D es el coeficiente de difusión del soluto. A partir de la Ecuación\ ref {12.10}, la eficiencia de una separación electroforética capilar aumenta con mayores voltajes. Aumentar la velocidad de flujo electroosmótico mejora la eficiencia, pero a expensas de la resolución. Dos observaciones adicionales merecen comentario. Primero, los solutos con mayores movilidades electroforéticas —en la misma dirección que el flujo electroosmótico— tienen mayores eficiencias; así, los cationes más pequeños y con mayor carga no son solo los primeros solutos en eluir, sino que lo hacen con mayor eficiencia. Segundo, la eficiencia en la electroforesis capilar es independiente de la longitud del capilar. Los recuentos teóricos de placas de aproximadamente 100 000—200 000 no son inusuales.
Es posible diseñar un experimento electroforético para que los aniones eluyan antes de los cationes, más sobre esto más tarde, en el que los aniones más pequeños y altamente cargados eluyen con mayores eficiencias.
Selectividad
En cromatografía definimos la selectividad entre dos solutos como la relación de sus factores de retención. En la electroforesis capilar, la expresión análoga para la selectividad es
\[\alpha=\frac{\mu_{ep, 1}}{\mu_{ep, 2}} \nonumber \]
donde\(\mu_{ep,1}\) y\(\mu_{ep,2}\) son las movilidades electroforéticas para los dos solutos, elegidas de tal manera que\(\alpha \ge 1\). A menudo podemos mejorar la selectividad ajustando el pH de la solución tampón. Por ejemplo,\(\text{NH}_4^+\) es un ácido débil con una p K a de 9.75. A un pH de 9.75 las concentraciones de\(\text{NH}_4^+\) y NH 3 son iguales. Disminuir el pH por debajo de 9.75 aumenta su movilidad electroforética debido a que una mayor fracción del soluto está presente como catión\(\text{NH}_4^+\). Por otro lado, al elevar el pH por encima de 9.75 se incrementa la proporción de NH 3 neutro, disminuyendo su movilidad electroforética.
Resolución
La resolución entre dos solutos es
\[R = \frac {0.177(\mu_{ep,2} - \mu_{ep,1})\sqrt{V}} {\sqrt{D(\mu_{avg} + \mu_{eof})}} \label{12.11} \]
donde\(\mu_{avg}\) es la movilidad electroforética promedio para los dos solutos. Aumentar el voltaje aplicado y disminuir la velocidad de flujo electroosmótico mejora la resolución. Este último efecto es particularmente importante. Aunque aumentar el flujo electroosmótico mejora el tiempo de análisis y la eficiencia, disminuye la resolución.
Instrumentación
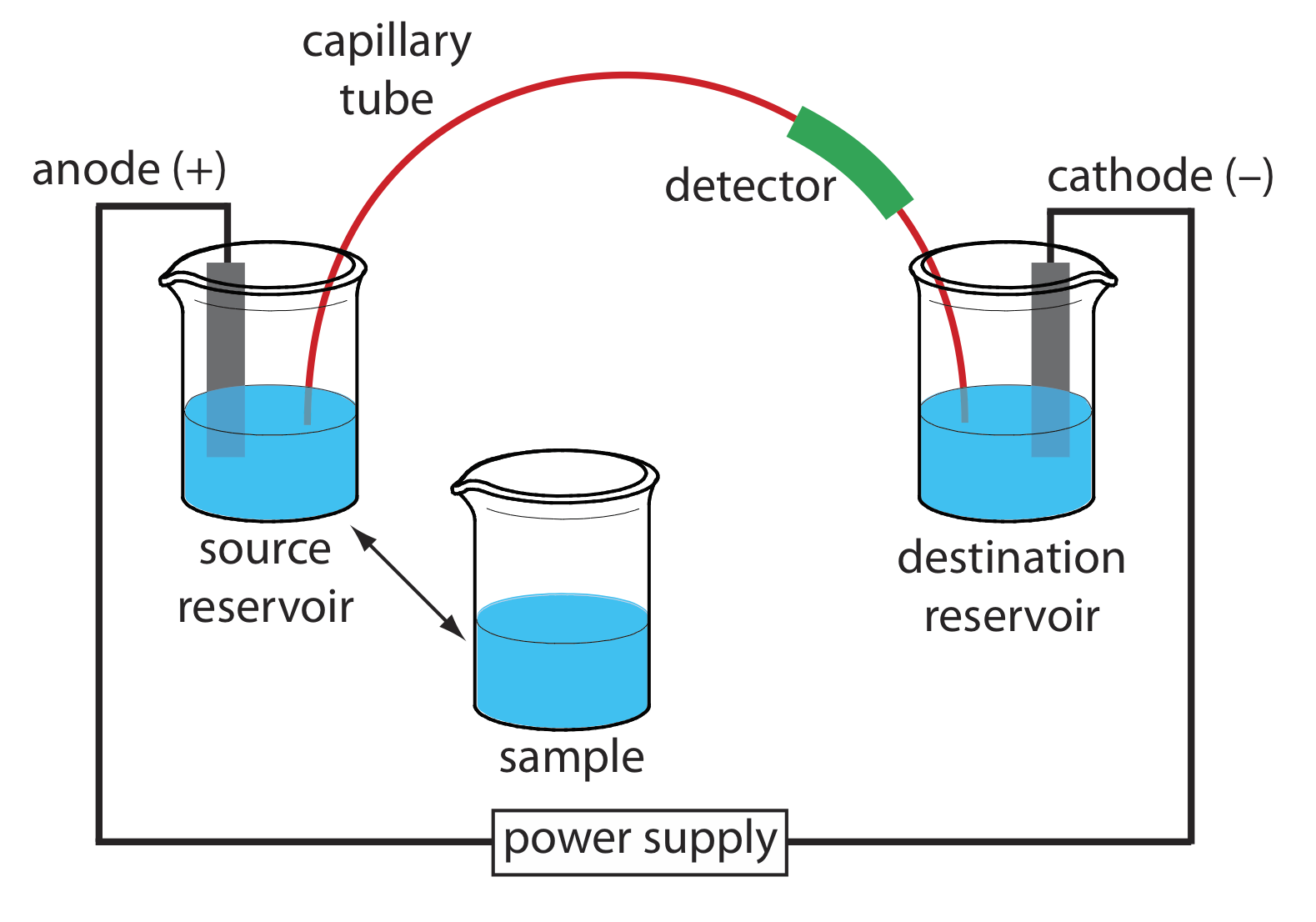
La instrumentación básica para electroforesis capilar se muestra en la Figura 30.2.4 e incluye una fuente de alimentación para aplicar el campo eléctrico, los compartimientos de ánodo y cátodo que contienen depósitos de la solución tampón, un vial de muestra que contiene la muestra, el tubo capilar y un detector . Cada parte del instrumento recibe mayor consideración en esta sección.
Tubos Capilares
La Figura 30.2.5 muestra una sección transversal de un tubo capilar típico. La mayoría de los tubos capilares están hechos de sílice fundida recubierta con una capa de 15—35 μm de poliimida para darle resistencia mecánica. El diámetro interno es típicamente de 25—75 μm, que es más pequeño que el diámetro interno de una columna capilar GC, con un diámetro exterior de 200—375 μm.
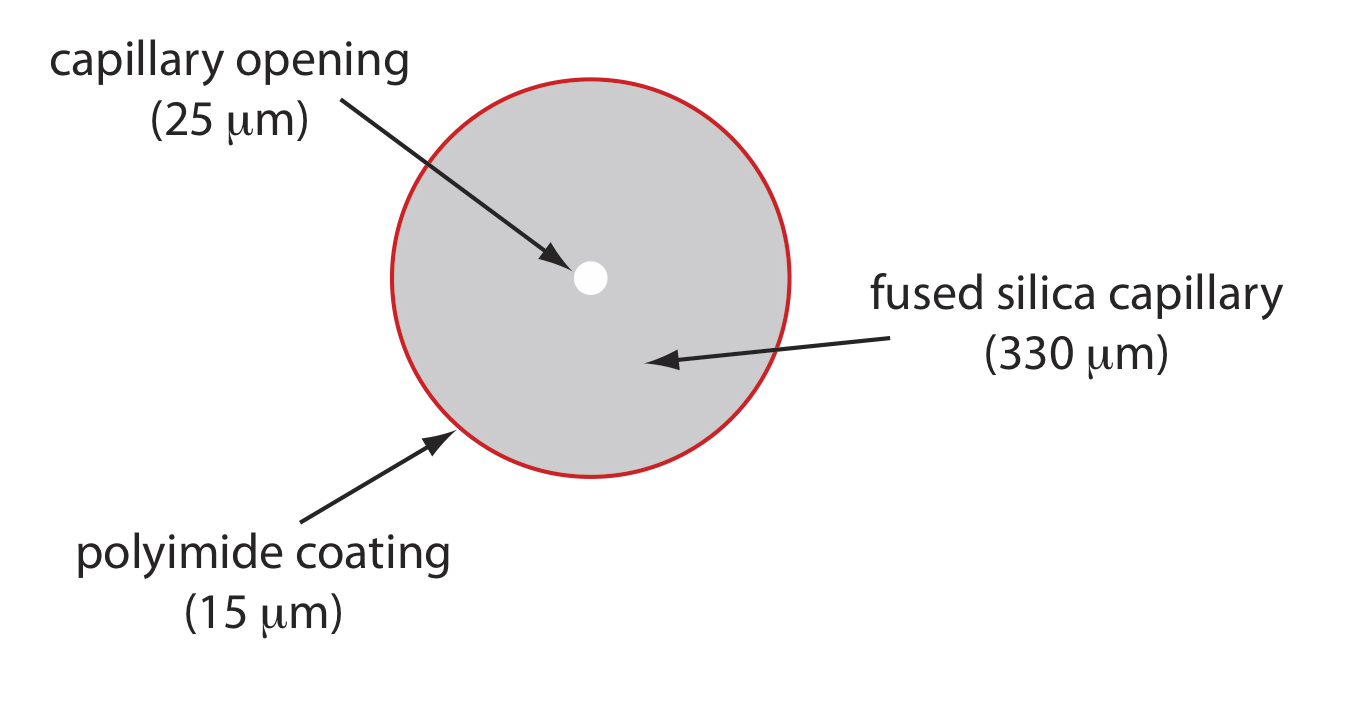
La estrecha apertura de la columna capilar y el grosor de sus paredes son importantes. Cuando se aplica un campo eléctrico a la solución tampón, la corriente fluye a través del capilar. Esta corriente conduce a la liberación de calor, que llamamos calefacción Joule. La cantidad de calor liberado es proporcional al radio del capilar y a la magnitud del campo eléctrico. El calentamiento de Joule es un problema porque cambia la viscosidad del tampón, siendo la solución en el centro del capilar menos viscosa que la que está cerca de las paredes capilares. Debido a que la movilidad electroforética de un soluto depende de su viscosidad (ver Ecuación\ ref {12.2}), las especies de solutos en el centro del capilar migran a una velocidad más rápida que las cercanas a las paredes capilares. El resultado es una fuente adicional de ensanchamiento de banda que degrada la separación. Los capilares con diámetros internos más pequeños generan menos calentamiento Joule, y los capilares con diámetros exteriores más grandes son más efectivos para disipar el calor. Colocar el tubo capilar dentro de una camisa termostática es otro método para minimizar el efecto del calentamiento Joule; en este caso un diámetro exterior más pequeño permite una disipación más rápida de la energía térmica.
Inyectar la muestra
Existen dos métodos comunes para inyectar una muestra en una columna de electroforesis capilar: la inyección hidrodinámica y la inyección electrocinética. En ambos métodos el tubo capilar se llena con la solución tampón. Un extremo del tubo capilar se coloca en el depósito de destino y el otro extremo se coloca en el vial de muestra.
La inyección hidrodinámica utiliza presión para forzar una pequeña porción de la muestra en el tubo capilar. Se aplica una diferencia de presión a través del capilar, ya sea presurizando el vial de muestra o aplicando vacío al depósito de destino. El volumen de muestra inyectada, en litros, viene dado por la siguiente ecuación
\[V_{\text {inj}}=\frac{\Delta P d^{4} \pi t}{128 \eta L} \times 10^{3} \label{12.12} \]
donde\(\Delta P\) está la diferencia de presión a través del capilar en pascales, d es el diámetro interno del capilar en metros, t es la cantidad de tiempo que se aplica la presión en segundos,\(\eta\) es la viscosidad del tampón en kg m —1 s —1, y L es la longitud del tubo capilar en metros. El factor de 10 3 cambia las unidades de metros cúbicos a litros.
Para una inyección hidrodinámica trasladamos el capilar desde el depósito fuente a la muestra. El ánodo permanece en el depósito fuente. También es posible una inyección hidrodinámica si elevamos el vial de muestra por encima del depósito de destino e insertamos brevemente el capilar lleno.
En una inyección hidrodinámica aplicamos una diferencia de presión de\(2.5 \times 10^3\) Pa (a\(\Delta P \approx 0.02 \text{ atm}\)) por 2 s a un tubo capilar de 75 cm de largo con un diámetro interno de 50 μm. Suponiendo que la viscosidad del tampón es de 10 —3 kg m —1 s —1, ¿qué volumen y longitud de muestra inyectamos?
Solución
Hacer sustituciones apropiadas en la Ecuación\ ref {12.12} da el volumen de la muestra como
\[V_{inj}=\frac{\left(2.5 \times 10^{3} \text{ kg} \text{ m}^{-1} \text{ s}^{-2}\right)\left(50 \times 10^{-6} \text{ m}\right)^{4}(3.14)(2 \text{ s})}{(128)\left(0.001 \text{ kg} \text{ m}^{-1} \text{ s}^{-1}\right)(0.75 \text{ m})} \times 10^{3} \mathrm{L} / \mathrm{m}^{3} \nonumber \]
\[V_{inj} = 1 \times 10^{-9} \text{ L} = 1 \text{ nL} \nonumber \]
Debido a que el interior del capilar es cilíndrico, la longitud de la muestra, l, es fácil de calcular usando la ecuación para el volumen de un cilindro; así
\[l=\frac{V_{\text {inj}}}{\pi r^{2}}=\frac{\left(1 \times 10^{-9} \text{ L}\right)\left(10^{-3} \text{ m}^{3} / \mathrm{L}\right)}{(3.14)\left(25 \times 10^{-6} \text{ m}\right)^{2}}=5 \times 10^{-4} \text{ m}=0.5 \text{ mm} \nonumber \]
Supongamos que necesita limitar su inyección a menos del 0.20% de la longitud del capilar. Usando la información del Ejemplo 30.2.1 , ¿cuál es el tiempo máximo de inyección para una inyección hidrodinámica?
- Contestar
-
El capilar mide 75 cm de largo, lo que significa que 0.20% de la longitud máxima de esa muestra es de 0.15 cm. Para convertir esto al volumen máximo de muestra utilizamos la ecuación para el volumen de un cilindro.
\[V_{i n j}=l \pi r^{2}=(0.15 \text{ cm})(3.14)\left(25 \times 10^{-4} \text{ cm}\right)^{2}=2.94 \times 10^{-6} \text{ cm}^{3} \nonumber \]
Dado que 1 cm 3 es equivalente a 1 mL, el volumen máximo es\(2.94 \times 10^{-6}\) mL o\(2.94 \times 10^{-9}\) L. Para encontrar el tiempo máximo de inyección, primero resolvemos la Ecuación\ ref {12.12} para t
\[t=\frac{128 V_{inj} \eta L}{P d^{4} \pi} \times 10^{-3} \text{ m}^{3} / \mathrm{L} \nonumber \]
y luego hacer las sustituciones apropiadas.
\[t=\frac{(128)\left(2.94 \times 10^{-9} \text{ L}\right)\left(0.001 \text{ kg } \text{ m}^{-1} \text{ s}^{-1}\right)(0.75 \text{ m})}{\left(2.5 \times 10^{3} \text{ kg } \mathrm{m}^{-1} \text{ s}^{-2}\right)\left(50 \times 10^{-6} \text{ m}\right)^{4}(3.14)} \times \frac{10^{-3} \text{ m}^{3}}{\mathrm{L}} = 5.8 \text{ s} \nonumber \]
El tiempo máximo de inyección, por lo tanto, es de 5.8 s.
En una inyección electrocinética colocamos tanto el capilar como el ánodo en la muestra y aplicamos brevemente un potencial. El volumen de muestra inyectada es el producto del área de sección transversal del capilar y la longitud del capilar ocupado por la muestra. A su vez, esta longitud es el producto de la velocidad del soluto (ver Ecuación\ ref {12.6}) y el tiempo; así
\[V_{inj} = \pi r^2 L = \pi r^2 (\mu_{ep} + \mu_{eof})E^{\prime}t \label{12.13} \]
donde r es el radio del capilar, L es la longitud del capilar y\(E^{\prime}\) es el campo eléctrico efectivo en la muestra. Una consecuencia importante de la Ecuación\ ref {12.13} es que una inyección electrocinética está sesgada hacia solutos con mayores movilidades electroforéticas. Si dos solutos tienen concentraciones iguales en una muestra, inyectamos un volumen mayor y, por lo tanto, más moles, del soluto con el mayor\(\mu_{ep}\).
El campo eléctrico en la muestra es diferente que el campo eléctrico en el resto del capilar porque la muestra y el tampón tienen diferentes composiciones iónicas. En general, la fuerza iónica de la muestra es menor, lo que hace que su conductividad sea más pequeña. El campo eléctrico efectivo es
\[E^{\prime} = E \times \frac {\chi_\text{buffer}} {\chi_\text{sample}}\nonumber \]
donde\(\chi_\text{buffer}\) y\(\chi_{sample}\) son las conductividades del tampón y la muestra, respectivamente.
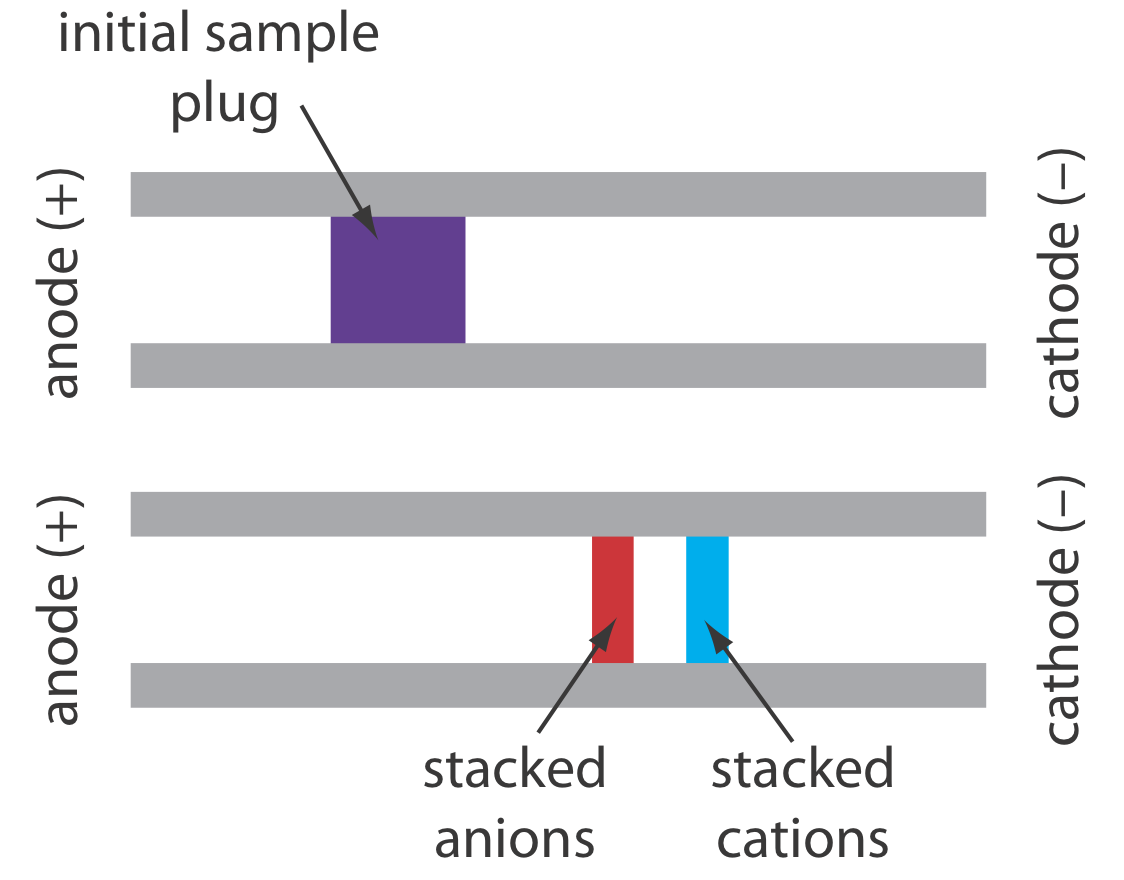
Cuando la concentración de un analito es demasiado pequeña para detectarlo de manera confiable, tal vez sea posible inyectarlo de una manera que aumente su concentración. Este método de inyección se llama apilamiento. El apilamiento se logra colocando la muestra en una solución cuya fuerza iónica es significativamente menor que la del tampón en el tubo capilar. Debido a que el tapón de muestra tiene una menor concentración de iones tampón, la intensidad de campo efectiva a través del tapón de muestra\(E^{\prime}\), es mayor que la del resto del capilar.
Sabemos por la Ecuación\ ref {12.1} que la velocidad electroforética es directamente proporcional al campo eléctrico. Como resultado, los cationes en el tapón de muestra migran hacia el cátodo con una mayor velocidad, y los aniones migran más lentamente, las especies neutras no se ven afectadas y se mueven con el flujo electroosmótico. Cuando los iones alcanzan sus respectivos límites entre el enchufe de muestra y el tampón, el campo eléctrico disminuye y la velocidad electroforética de los cationes disminuye y esa para los aniones aumenta. Como se muestra en la Figura 30.2.6 , el resultado es un apilamiento de cationes y aniones en zonas de muestreo separadas y más pequeñas. Con el tiempo, el tampón dentro del capilar se vuelve más homogéneo y la separación avanza sin apilamiento adicional.
Aplicando el Campo Eléctrico
La migración en electroforesis ocurre en respuesta a un campo eléctrico aplicado. La capacidad de aplicar un campo eléctrico grande es importante porque mayores voltajes conducen a tiempos de análisis más cortos (Ecuación\ ref {12.9}), separaciones más eficientes (Ecuación\ ref {12.10}) y mejor resolución (Ecuación\ ref {12.11}). Debido a que los tubos capilares perforados estrechos disipan el calentamiento Joule de manera tan eficiente, son posibles voltajes de hasta 40 kV.
Debido a los altos voltajes, asegúrese de seguir las pautas de seguridad de su instrumento.
Detectores
La mayoría de los detectores utilizados en HPLC también encuentran uso en electroforesis capilar. Entre los detectores más comunes se encuentran los basados en la absorción de radiación UV/Vis, fluorescencia, conductividad, amperometría y espectrometría de masas. Siempre que sea posible, la detección se realiza “en columna” antes de que los solutos se eluyan del tubo capilar y se produzca un ensanchamiento adicional de la banda.
Los detectores UV/Vis se encuentran entre los más populares. Debido a que la absorbancia es directamente proporcional a la longitud de la trayectoria, el pequeño diámetro del tubo capilar conduce a señales que son más pequeñas que las obtenidas en HPLC. Se han utilizado varios enfoques para aumentar la longitud de la ruta, incluyendo una celda de muestra en forma de Z y múltiples reflexiones (ver Figura 30.2.7 ). Los límites de detección son de aproximadamente 10 —7 M.
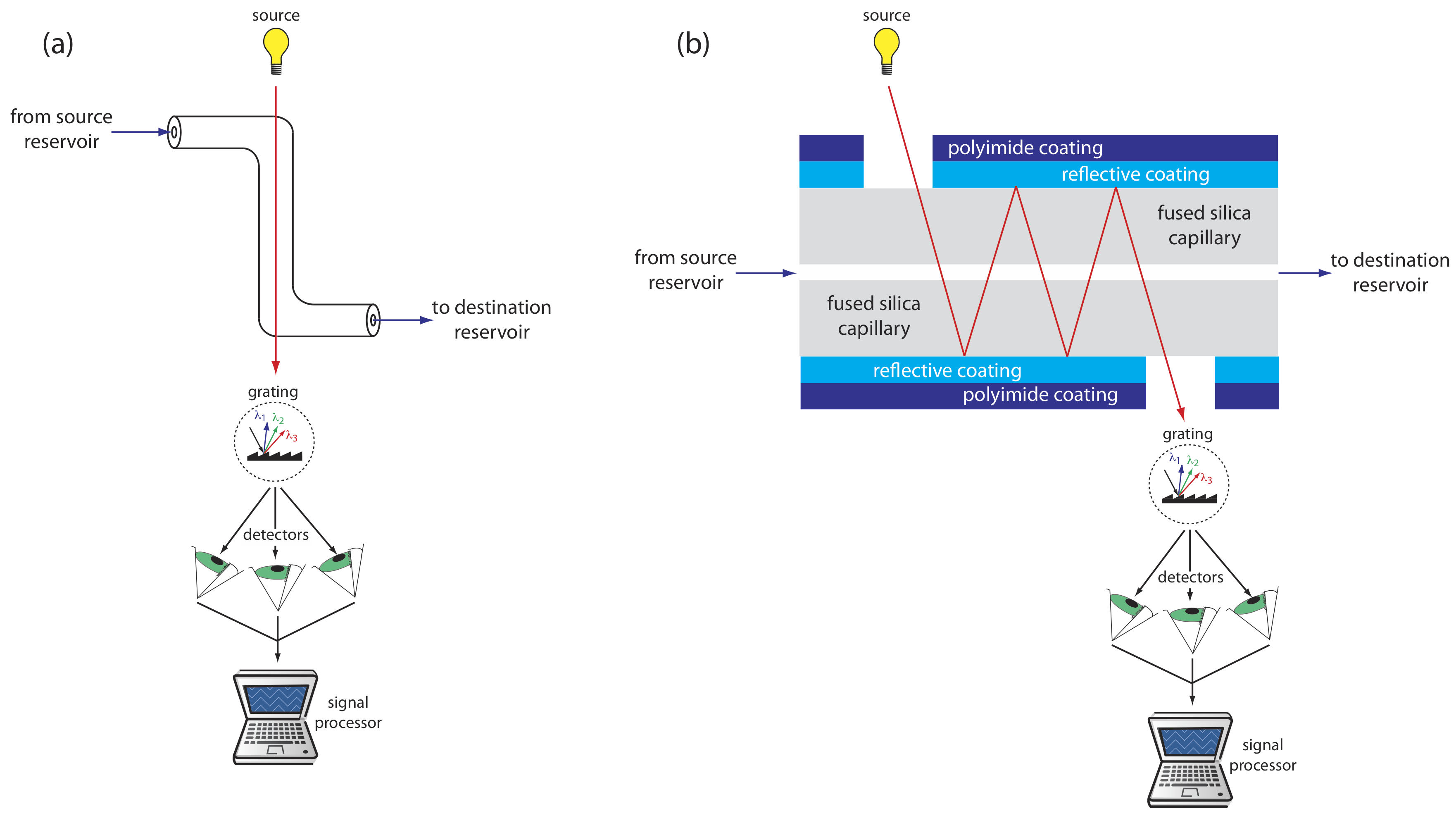
Se obtienen mejores límites de detección usando fluorescencia, particularmente cuando se usa un láser como fuente de excitación. Cuando se usa la detección de fluorescencia, se elimina una pequeña porción del recubrimiento protector del capilar y el rayo láser se enfoca en la porción interna del tubo capilar. La emisión se mide en un ángulo de 90 o con respecto al láser. Debido a que el láser proporciona una fuente intensa de radiación que puede enfocarse en un punto estrecho, los límites de detección son tan bajos como 10 —16 M.
Los solutos que no absorben radiación UV/Vis o que no experimentan fluorescencia pueden ser detectados por otros detectores. El cuadro 30.2.1 proporciona una lista de detectores para electroforesis capilar junto con algunas de sus características importantes.
| detector | selectividad (universal o analito debe...) | detección limitada (moles inyectados) | límite de detección (molaridad) | detección en columna? |
|---|---|---|---|---|
| Absorbancia UV/Vis | tener un cromóforo UV/Vis | \(10^{-13} - 10^{-16}\) | \(10^{-5} - 10^{-7}\) | si |
| absorbidoc indirecto | universal | \(10^{-12} - 10^{-15}\) | \(10^{-4} - 10^{-6}\) | si |
| fluoresencia | tener un rendimiento cuántico favorable | \(10^{-13} - 10^{-17}\) | \(10^{-7} - 10^{-9}\) | si |
| fluorescencia láser | tener un rendimiento cuántico favorable | \(10^{-18} - 10^{-20}\) | \(10^{-13} - 10^{-16}\) | si |
| espectrómetro de masas |
universal (ion total) selectivo (solo ion) |
\(10^{-16} - 10^{-17}\) | \(10^{-8} - 10^{-10}\) | no |
| amperometría | someterse a oxidación o reducción | \(10^{-18} - 10^{-19}\) | \(10^{-7} - 10^{-10}\) | no |
| conductividad | universal | \(10^{-15} - 10^{-16}\) | \(10^{-7} - 10^{-9}\) | no |
| radiométrico | ser radiactivo | \(10^{-17} - 10^{-19}\) | \(10^{-10} - 10^{-12}\) | si |


