30.3: Aplicaciones de Electroforesis Capilar
- Page ID
- 78896
Existen varias formas diferentes de electroforesis capilar, cada una de las cuales tiene sus ventajas particulares. Varios de estos métodos se describen brevemente en esta sección.
Electroforesis de Zona Capilar (CZE)
La forma más simple de electroforesis capilar es la electroforesis de zona capilar. En CZE llenamos el tubo capilar con un tampón y, después de cargar la muestra, colocamos los extremos del tubo capilar en depósitos que contienen tampón adicional. Por lo general, el extremo del capilar que contiene la muestra es el ánodo y los solutos migran hacia el cátodo a una velocidad determinada por sus respectivas movilidades electroforéticas y el flujo electroosmótico. Los cationes eluyen primero, con cationes más pequeños y con mayor carga eluyendo antes que los cationes más grandes con cargas más pequeñas. Las especies neutras eluyen como una sola banda. Los aniones son la última especie en eluir, siendo los aniones más pequeños y con mayor carga negativa los últimos en eluir.
Podemos invertir la dirección del flujo electroosmótico agregando una sal de alquilamonio a la solución tampón. Como se muestra en la Figura 30.3.1 , el extremo cargado positivamente de los iones alquilamonio se une a los iones de silanato cargados negativamente en las paredes del capilar. La cola del ion alquilamonio es hidrofóbica y se asocia con la cola de otro ion alquilamonio. El resultado es una capa de cargas positivas que atraen aniones en el búfer. La migración de estos aniones solvatados hacia el ánodo invierte la dirección del flujo electroosmótico. El orden de elución es exactamente opuesto al observado en condiciones normales.
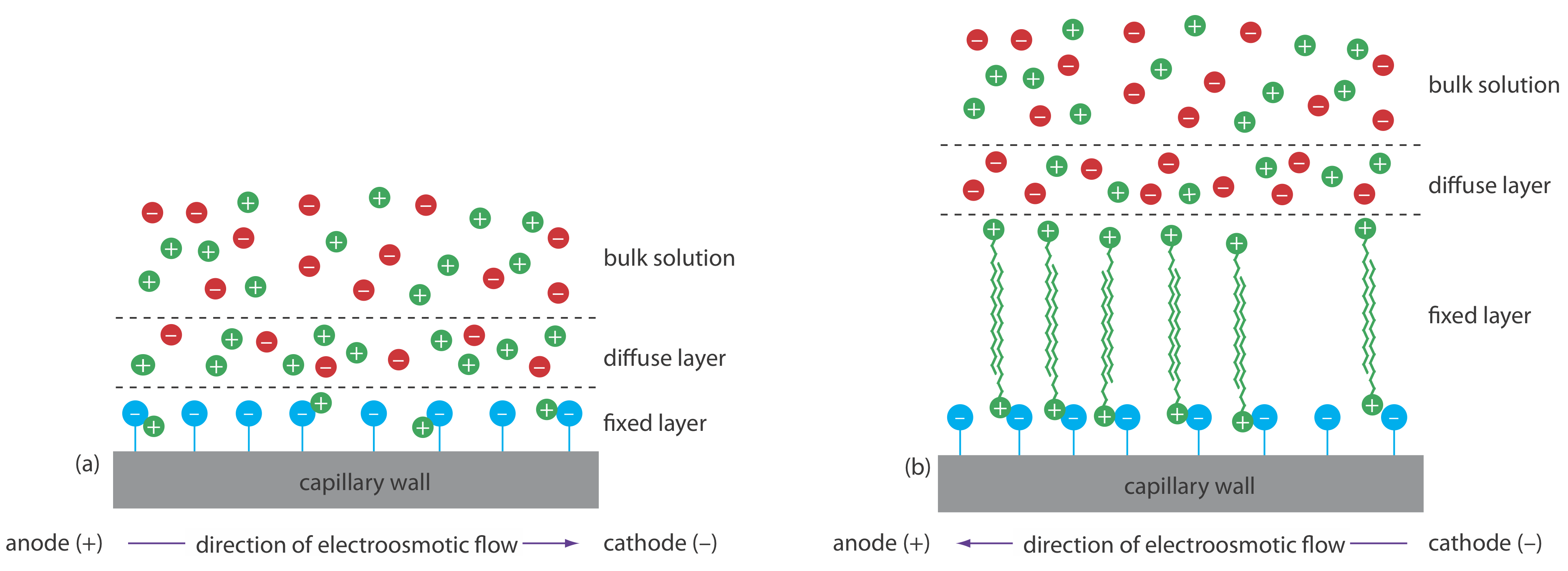
El recubrimiento de las paredes del capilar con un reactivo no iónico elimina el flujo electroosmótico. En esta forma de CZE los cationes migran del ánodo al cátodo. Los aniones eluyen en el reservorio fuente y las especies neutras permanecen estacionarias.
La electroforesis de zona capilar proporciona separaciones efectivas de especies cargadas, incluyendo aniones y cationes inorgánicos, ácidos orgánicos y aminas, y biomoléculas grandes como proteínas. Por ejemplo, se utilizó CZE para separar una mezcla de 36 iones inorgánicos y orgánicos en menos de tres minutos [Jones, W. R.; Jandik, P. J. Chromatog. 1992, 608, 385—393]. Una mezcla de especies neutras, por supuesto, no se puede resolver.
Cromatografía Micelar Electrocinética Capilar (MEKC)
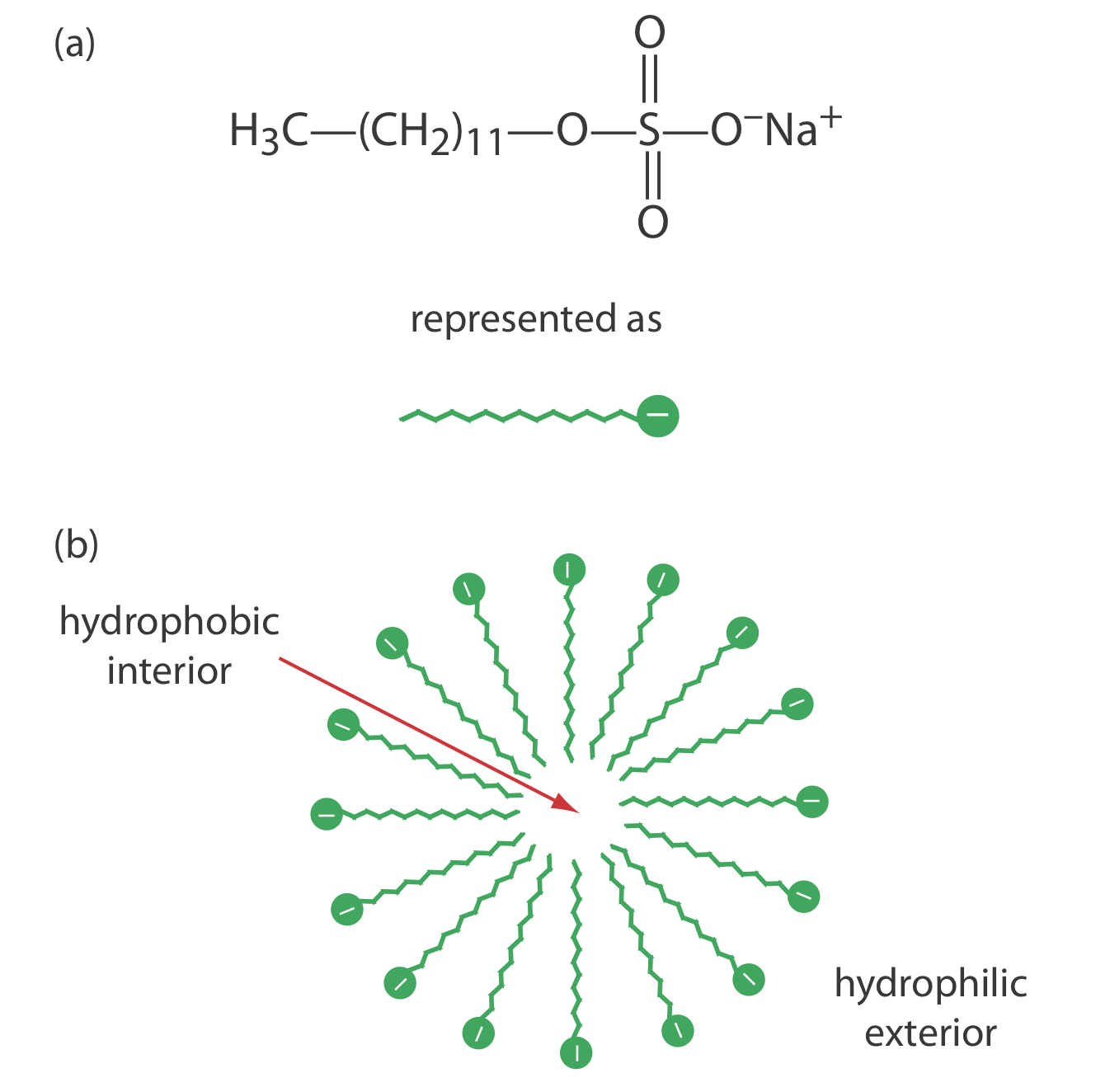
Una limitación a la CZE es su incapacidad para separar especies neutras. La cromatografía capilar electrocinética micelar supera esta limitación al agregar un surfactante, como el dodecilsulfato de sodio (Figura 30.3.2 a) a la solución tampón. El dodecilsulfato de sodio, o SDS, consiste en una cola hidrófoba de cadena larga y un grupo funcional iónico cargado negativamente en su cabeza. Cuando la concentración de SDS es suficientemente grande se forma una micela. Una micela consiste en una aglomeración esférica de 40—100 moléculas tensioactivas en las que las colas de hidrocarburos apuntan hacia adentro y las cabezas cargadas negativamente apuntan hacia afuera (Figura 30.3.2 b).
Debido a que las micelas tienen una carga negativa, migran hacia el cátodo con una velocidad menor que la velocidad de flujo electroosmótico. Las especies neutras se reparten entre las micelas y la solución tampón de manera similar a la partición de solutos entre las dos fases líquidas en HPLC. Debido a que existe una partición entre dos fases, incluimos el término descriptivo cromatografía en el nombre de las técnicas. Tenga en cuenta que en MEKC ambas fases son móviles.
El orden de elución para especies neutras en MEKC depende de la medida en que cada especie se reparte en las micelas. Los neutros hidrofílicos son insolubles en el ambiente interno hidrofóbico de la micela y eluyen como una sola banda, como lo harían en CZE. Los solutos neutros que son extremadamente hidrofóbicos son completamente solubles en la micela, eluyendo con las micelas como una sola banda. Aquellas especies neutras que existen en un equilibrio de partición entre el tampón y las micelas eluyen entre las especies neutras completamente hidrófilas y completamente hidrófobas. Aquellas especies neutras que favorecen el tampón eluyen antes que las que favorecen las micelas. La cromatografía electrocinética micelar se utiliza para separar una amplia variedad de muestras, incluyendo mezclas de compuestos farmacéuticos, vitaminas y explosivos.
Electroforesis Capilar en Gel (CGE)
En la electroforesis capilar en gel el tubo capilar se rellena con un gel polimérico. Debido a que el gel es poroso, un soluto migra a través del gel con una velocidad determinada tanto por su movilidad electroforética como por su tamaño. La capacidad de efectuar una separación usando el tamaño es útil cuando los solutos tienen movilidades electroforéticas similares. Por ejemplo, los fragmentos de ADN de longitud variable tienen relaciones de carga a tamaño similares, lo que dificulta su separación por CZE. Debido a que los fragmentos de ADN son de diferente tamaño, es posible una separación de CGE.
El capilar utilizado para CGE generalmente se trata para eliminar el flujo electroosmótico para evitar que el gel se extruya desde el tubo capilar. Las muestras se inyectan electrocinéticamente porque el gel proporciona demasiada resistencia para el muestreo hidrodinámico. La aplicación primaria de CGE es la separación de biomoléculas grandes, incluyendo fragmentos de ADN, proteínas y oligonucleótidos.
Electrocromatografía Capilar (CEC)
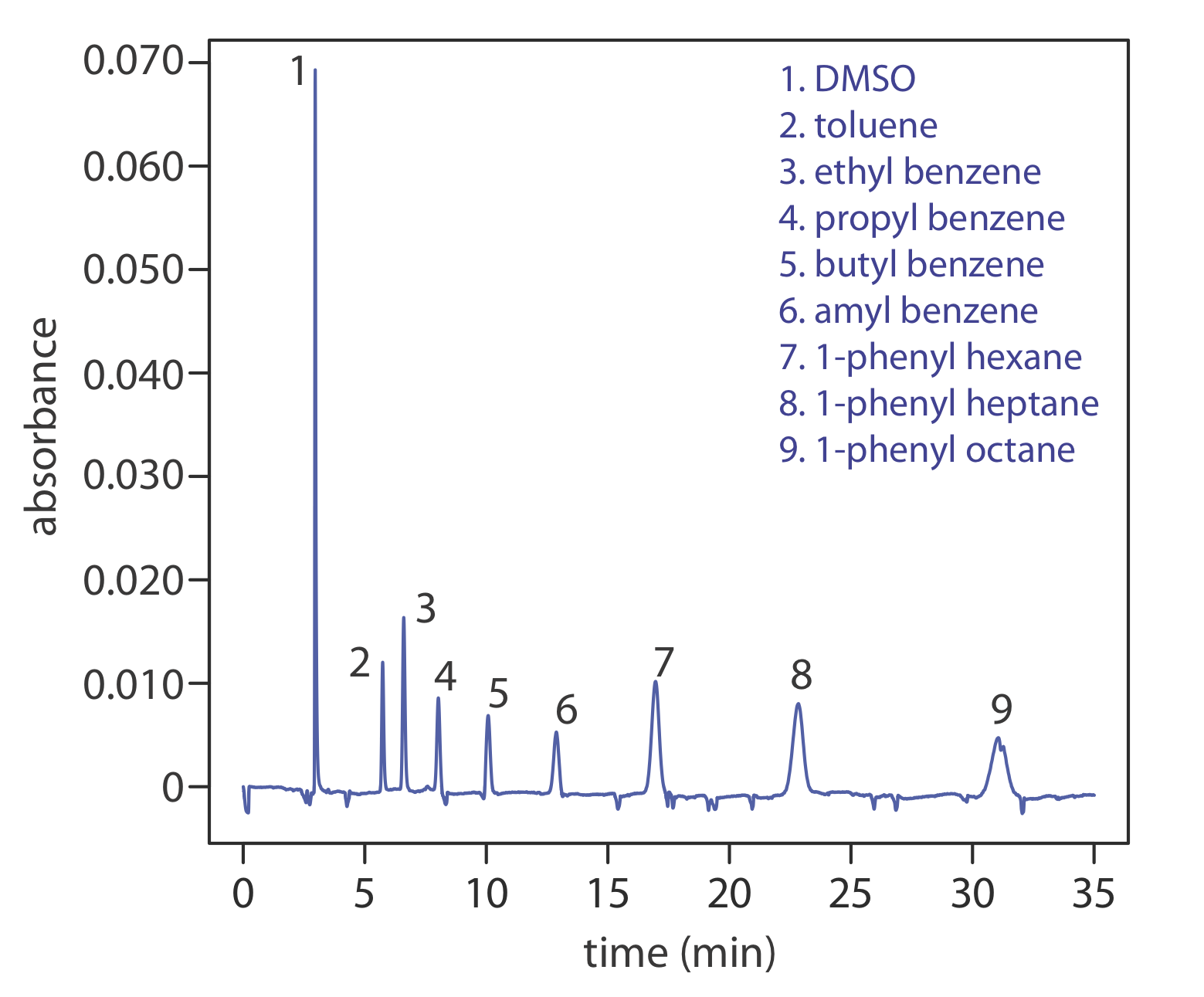
Otro enfoque para separar especies neutras es la electrocromatografía capilar. En CEC el tubo capilar está empaquetado con partículas de 1.5—3 μm recubiertas con una fase estacionaria unida. Las especies neutras se separan en función de su capacidad de partición entre la fase estacionaria y el tampón, que se mueve como resultado del flujo electroosmótico; la Figura 30.3.3 proporciona un ejemplo representativo para la separación de una mezcla de hidrocarburos. Una separación CEC es similar a la separación por HPLC análoga, pero sin necesidad de bombas de alta presión. La eficiencia en CEC es mejor que en HPLC, y los tiempos de análisis son más cortos.