1.5: Análisis ICP-AES de Nanopartículas
- Page ID
- 71202
¿Qué es ICP-AES?
La espectroscopia de emisión atómica de plasma acoplado inductivamente (ICP-AES) es un método espectral utilizado para determinar de manera muy precisa la composición elemental de las muestras; también se puede utilizar para cuantificar la concentración elemental con la muestra. ICP-AES utiliza plasma de alta energía de un gas inerte como el argón para quemar analitos muy rápidamente. El color que se emite desde el analito es indicativo de los elementos presentes, y la intensidad de la señal espectral es indicativa de la concentración de los elementos que está presente. Aquí se muestra una vista esquemática de una configuración experimental típica.
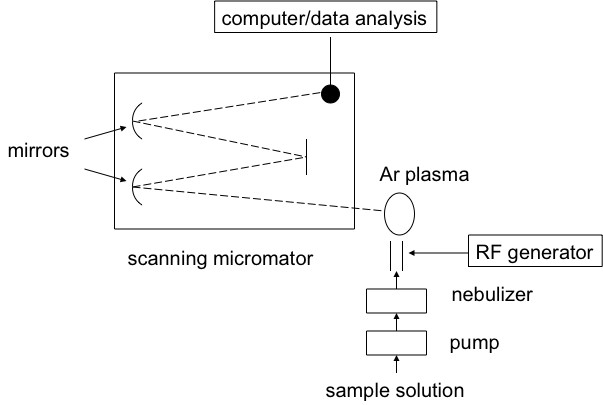
¿Cómo funciona ICP-AES?
ICP-AES funciona mediante la emisión de fotones de analitos que son llevados a un estado excitado por el uso de plasma de alta energía. La fuente de plasma se induce al pasar gas argón a través de un campo eléctrico alterno que es creado por una bobina de acoplamiento inductivo. Cuando el analito es excitado los electrones intentan disipar la energía inducida moviéndose a un estado fundamental de menor energía, al hacer esto emiten el exceso de energía en forma de luz. La longitud de onda de la luz emitida depende de la brecha de energía entre el nivel de energía excitada y el estado fundamental. Esto es específico del elemento basado en el número de electrones que tiene el elemento y se llenan los orbitales de electrones. De esta manera se puede utilizar la longitud de onda de la luz para determinar qué elementos están presentes mediante la detección de la luz a longitudes de onda específicas.
Como ejemplo sencillo considere la situación a la hora de colocar un trozo de alambre de cobre en la llama de una vela. La llama se vuelve verde debido a la emisión de electrones excitados dentro del metal cobre, ya que los electrones intentan disipar la energía incurrida por la llama, se mueven a un estado más estable emitiendo energía en forma de luz. La brecha de energía entre el estado excitado y el estado fundamental (\(ΔE\)dicta el color de la luz o longitud de onda de la luz, Ecuación\ ref {eq:deltae}, donde\(h\) es la constante de Plank (6.626×10 -34 m 2 kg/s), y\(\nu\) es la frecuencia de la luz emitida.
\[ \Delta E = h \nu \label{eq:DeltaE} \]
La longitud de onda de la luz es indicativa del elemento presente. Si se coloca otro metal en la llama como el hierro se emitirá una llama de color diferente porque la estructura electrónica del hierro es diferente a la del cobre. Esta es una analogía muy simple de lo que está sucediendo en ICP-AES y cómo se utiliza para determinar qué elementos están presentes. Al detectar la longitud de onda de la luz que se emite desde el analito se puede deducir qué elementos están presentes.
Naturalmente si hay mucho del material presente entonces habrá un efecto acumulativo haciendo grande la intensidad de la señal. Sin embargo, si hubiera muy pocos materiales presentes la señal sería baja. Por esta razón se puede crear una curva de calibración a partir de soluciones de analitos de concentraciones conocidas, por lo que la intensidad de la señal cambia en función de la concentración del material que está presente. Al medir la intensidad de una muestra de concentración desconocida se puede comparar la intensidad de esta muestra con la de la curva de calibración, por lo que ésta puede ser utilizada para determinar la concentración de los analitos dentro de la muestra.
ICP-AES de nanopartículas para determinar la composición elemental
Al igual que con cualquier muestra que esté siendo estudiada por ICP-AES, las nanopartículas necesitan ser digeridas para que todos los átomos puedan vaporizarse en el plasma por igual. Si una nanopartícula que contiene metal no se digiriera usando un ácido fuerte para poner los átomos de los metales en solución, la forma de la partícula podría impedir que parte del material se vaporizara. El analito no sería detectado aunque esté presente en la muestra y esto daría un resultado erróneo. Las nanopartículas suelen estar cubiertas con una capa protectora de ligandos orgánicos y esto también debe eliminarse. Además de esto, el disolvente utilizado para las nanopartículas también puede ser una solución orgánica y ésta debe eliminarse ya que tampoco será miscible en el medio acuoso.
Varios disolventes orgánicos tienen bajas presiones de vapor por lo que es relativamente fácil eliminar el disolvente calentando las muestras, eliminando el disolvente por evaporación. Para eliminar los ligandos orgánicos que están presentes en la nanopartícula, se puede usar ácido chórico. Este es un ácido muy fuerte y puede descomponer fácilmente los ligandos orgánicos. Para digerir las partículas y obtener el metal en solución se utiliza a menudo ácido nítrico concentrado.
Un protocolo típico puede usar 0.5 mL de solución concentrada de nanopartículas y digerirla con 9.5 mL de ácido nítrico concentrado durante el periodo de unos días. Después de lo cual se colocan 0.5 mL de la solución digerida en 9.5 mL de agua nanopura. La razón por la que se utiliza agua nanopura es porque el agua DI o el agua regular tendrán alguna cantidad de iones metálicos presentes y estos serán detectados por la medición ICP-AES y conducirán a cifras que no son verdaderamente representativas de la concentración de analito por sí sola. Esto es especialmente pertinente cuando hay una concentración muy baja de analito metálico a detectar, y es aún más un problema cuando el metal a detectar se encuentra comúnmente en agua como el hierro. Una vez que se prepara el agua nanopura y la solución digerida, la muestra está lista para su análisis.
Otro punto a considerar al hacer ICP-AES sobre nanopartículas para determinar composiciones químicas, incluye el potencial de superposición de longitud de onda. La energía que se libera en forma de luz es única para cada elemento, pero los elementos que son muy similares en estructura atómica tendrán longitudes de onda de emisión que son muy similares entre sí. Considera el ejemplo del hierro y el cobalto, estos son ambos metales de transición y se sientan uno al lado del otro en la tabla periódica. El hierro tiene una longitud de onda de emisión a 238.204 nm y el cobalto tiene una longitud de onda de emisión a 238.892 nm. Entonces, si trataras de determinar la cantidad de cada elemento en una aleación de los dos tendrías que seleccionar otra longitud de onda que fuera única para ese elemento, y no tener ningún solapamiento de longitud de onda con otros analitos en solución. Para este caso de hierro y cobalto sería más prudente utilizar una longitud de onda para la detección de hierro de 259.940 nm y una detección de longitud de onda de 228.616 nm. Teniendo esto en cuenta, una buena regla general es intentar utilizar principalmente la longitud de onda del analito que permita la mejor detección. Pero si este valor conduce a una posible superposición de longitud de onda dentro de 15 nm de longitud de onda con otro analito en la solución, entonces debería hacerse otra elección de la longitud de onda de detección para evitar que se produzca la superposición de longitud de onda.
Algunas personas también han utilizado la técnica ICP-AES para determinar el tamaño de las nanopartículas. La señal que se detecta está determinada por la cantidad del material que está presente en solución. Si se están analizando soluciones muy diluidas de nanopartículas, las partículas se están analizando una a la vez, es decir, habrá una nanopartícula por gotita en el nebulizador. La intensidad de la señal entonces diferiría según el tamaño de la partícula. De esta manera se podría utilizar la técnica ICP-AES para determinar la concentración de las partículas en la solución así como el tamaño de las partículas.
Cálculos para Concentraciones de ICP
Para realizar ICP-AES se deben preparar soluciones madre en soluciones diluidas de ácido nítrico. Para ello se debe diluir una solución concentrada con agua nanopura para preparar soluciones de ácido nítrico al 7% en peso. Si la solución concentrada es 69.8% en peso (verifique la cantidad de ensayo que está escrita en el costado de la botella) entonces la cantidad para diluir la solución será como tal:
- La densidad (\(d\)) de\(\ce{HNO3}\) es 1.42 g/mL
- El peso molecular (\(M_W\)) de\(\ce{HNO3}\) es 63.01
Porcentaje concentrado 69.8% en peso del ensayo. Primero debes determinar la molaridad de la solución concentrada:
\[ \text { Molarity } = \left[ ( \% ) ( \mathrm { d } ) / \left( \mathrm { M } _ { \mathrm { W } } \right) \right] \times 10 \label{eq:molarity} \]
Para la presente cantidad de ensayo, la cifra se calculará de la siguiente manera
\[ \mathrm { M } = [ ( 69.8 ) ( 1.42 ) / ( 63.01 ) ] \times 10 \nonumber \]
\[ \therefore \mathrm { M } = 15.73 \nonumber \]
Esta es la concentración inicial\( C_I\). Para determinar la molaridad de la solución al 7% utilizamos nuevamente la Ecuación\ ref {eq:molaridad} para encontrar la concentración final\( C_F\).
\[ \mathbf { M } = [ ( 7 ) ( 1.42 ) / ( 63.01 ) ] \times 10 \nonumber \]
\[ \therefore M = 1.58 \nonumber \]
Utilizamos estas cifras para determinar la cantidad de dilución requerida para diluir el ácido nítrico concentrado para convertirlo en una solución al 7%.
\[ \text { mass } _ { 1 } \times \text { concentration } _ { 1 } = \text { mass } _ { \mathrm { F } }\times \text { concentration } _ { \mathrm { F } } \nonumber \]
Ahora como estamos hablando de soluciones la cantidad de masa se medirá en mL, y la concentración se medirá como una molaridad. M I y M F se han calculado anteriormente.
\[ \mathrm { mL } _ { 1 } * \mathrm { C } _ { 1 } = \mathrm { mL } _ { \mathrm { F } } * \mathrm { C } _ { \mathrm { F } } \label{eq:MV} \]
\[ \therefore \mathrm { mL } _ { 1 } = \left[ \mathrm { mL } _ { \mathrm { F } } * \mathrm { C } _ { \mathrm { F } } \right]/ \mathrm { C } _ { 1 } \nonumber \]
Además, la cantidad de solución diluida dependerá del usuario y de cuánto requiera el usuario para completar el análisis ICP, por el bien del argumento digamos que necesitamos 10 mL de solución diluida, esto es mL F:
\[ \mathrm { mL } _ { 1 } = [ 10 * 1.58 ] / 15.73 \nonumber \]
\[ \therefore \mathrm { mL } _ { 1 } = 10.03 \mathrm { mL } \nonumber \]
Esto significa que 10.03 mL del ácido nítrico concentrado (69.8%) deben diluirse hasta un total de 100 mL con agua nanopura.
Ahora que tienes tu solución stock con el porcentaje correcto entonces puedes usar esta solución para preparar tus soluciones de concentración variable. Tomemos el ejemplo de que la solución stock que compra a un proveedor tiene una concentración de 100 ppm de analito, lo que equivale a 1 μg/mL.
Para que su curva de calibración sea más precisa es importante estar al tanto de dos cuestiones. En primer lugar, al igual que con todas las gráficas de línea recta, cuantos más puntos se utilicen entonces, mejor será la estadística que la línea sea correcta. Pero, en segundo lugar, cuantas más mediciones se utilicen significa que se introduce más margen de error al sistema, para evitar que ocurran estos errores se debe estar muy atento y experto en el uso de pipeteo y dilución de soluciones. Especialmente cuando se trabaja con soluciones de muy baja concentración, una pequeña gota de material haciendo la dilución por encima o por debajo de la cantidad exactamente requerida puede alterar la concentración y por lo tanto afectar la calibración de manera perjudicial. La premisa sobre la que se realiza el cálculo se basa en la Ecuación\ ref {Eq:mV}, donde C se refiere a la concentración en ppm, y mL se refiere a la masa en mL.
La elección de las concentraciones a realizar dependerá de las muestras y de la concentración de analito dentro de las muestras que se estén analizando. Para los usuarios primerizos es aconsejable hacer una curva de calibración con un amplio rango para abarcar todos los resultados posibles. Cuando el usuario es más consciente del tipo de concentraciones que está produciendo en su síntesis, entonces puede reducir el rango para adaptarse al tipo de concentraciones que están anticipando.
En este ejemplo realizaremos concentraciones que van de 10 ppm a 0.1 ppm, con un total de cinco muestras. En un análisis típico de ICP-AES se usan aproximadamente 3 mL de solución, sin embargo, si tiene situaciones con superposición de longitud de onda sustancial entonces puede haber elegido hacer dos series separadas y por lo tanto necesitará aproximadamente 6 mL de solución. En general es prudente tener al menos 10 mL de solución para prepararse ante cualquier eventualidad que pueda ocurrir. También habrá alguna cantidad extra necesaria para las muestras que se están utilizando para el control de calidad. Por esta razón 10 mL deben ser una cantidad suficiente para preparar de cada concentración.
Podemos definir las incógnitas en la ecuación de la siguiente manera:
- \( C_I \)= concentración de solución concentrada (ppm)
- \( C_F \)= concentración deseada (ppm)
- \( M_I \)= masa inicial del material (mL)
- \( M_F\)= masa de material requerida para dilución (mL)
La metodología adoptada funciona de la siguiente manera. Hacer la solución de alta concentración luego tomar de esa solución y diluir más a las concentraciones deseadas que se requieran.
Digamos que la concentración de la solución stock del proveedor es de 100 ppm de analito. Primero debemos diluir a una concentración de 10 ppm. Para hacer 10 mL de solución de 10 ppm debemos tomar 1 mL de la solución de 100 ppm y diluirlo hasta 10 mL con agua nanopura, ahora la concentración de esta solución es de 10 ppm. Entonces podemos tomar de la solución de 10 ppm y diluir esta hacia abajo para obtener una solución con 5 ppm. Para ello toma 5 mL de la solución de 10 ppm y diluye a 10 mL con agua nanopura, entonces tendrás una solución de 10 mL que es de concentración de 5 ppm. Y así puede hacer esto sucesivamente tomando alícuotas de cada solución trabajando su camino hacia abajo en pasos incrementales hasta tener una serie de soluciones que tienen concentraciones que van desde 10 ppm hasta 0.1 ppm o menos, según sea necesario.
ICP-AES en el trabajo
Si bien el ICP-AES es un método útil para cuantificar la presencia de un solo metal en una nanopartícula dada, otra aplicación muy importante proviene de la capacidad de determinar la proporción de metales dentro de una muestra de nanopartículas.
En los siguientes ejemplos podemos considerar las nanopartículas bimetálicas de hierro con cobre. En una síntesis típica\(\ce{Fe(acac)3}\) se usa 0.75 mmol de para preparar nanopartícula de óxido de hierro de la forma\(\ce{Fe3O4}\). Es posible reemplazar una cantidad de los\(\ce{Fe^{n+}}\) iones por otro metal de carga similar. De esta manera se elaboraron partículas bimetálicas con un precursor que contenía un metal adecuado. En este ejemplo el precursor metálico adicional será\(\ce{Cu(acac)2}\).
Mantener la concentración total de metal en este ejemplo es de 0.75 mmol. Entonces, si queremos ver el efecto de tener 10% del metal en la reacción como cobre, entonces usaremos 10% de 0.75 mmol, es decir 0.075 mmol\(\ce{Cu(acac)2}\), y la cantidad correspondiente de hierro es 0.675 mmol\(\ce{Fe(acac)3}\). Podemos hacer esto para incrementos sucesivos de los metales hasta que hagas 100% partículas de óxido de cobre.
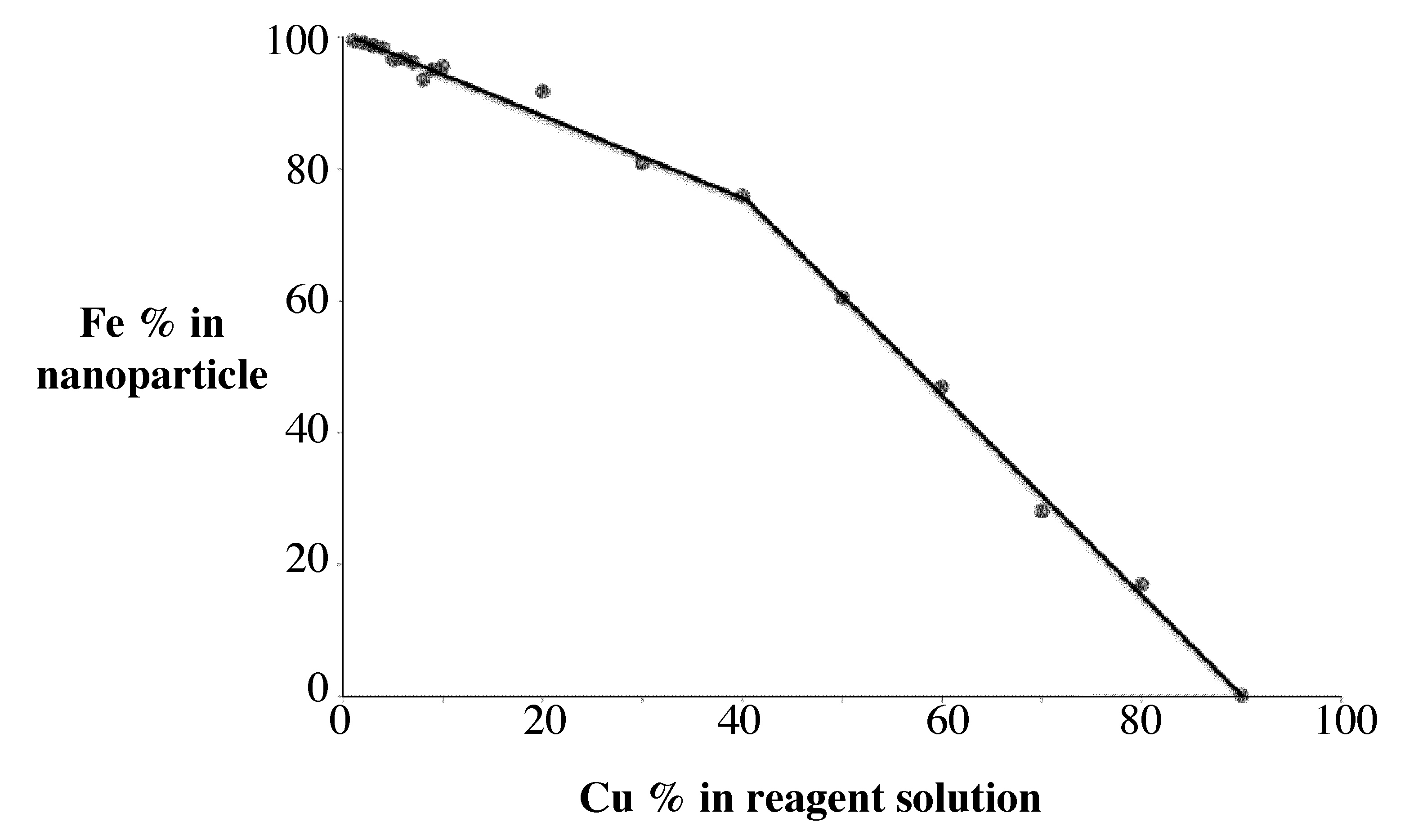
Posterior\(\ce{Fe}\) e\(\ce{Cu}\) ICP-AES de las muestras permitirán determinar la\(\ce{Fe:Cu}\) relación que está presente en la nanopartícula. Esto se puede comparar con la relación de\(\ce{Fe}\) y\(\ce{Cu}\) que se aplicó como reactivos. La gráfica muestra cómo cambia el porcentaje de\(\ce{Fe}\) en la nanopartícula en función de cuánto\(\ce{Fe}\) se usa como reactivo.
Determinación de la concentración de analito
Una vez que se digieren las nanopartículas y se haya completado el análisis ICP-AES se deben convertir las cifras del análisis ICP-AES en números de trabajo para determinar la concentración de metales en la solución que se sintetizó inicialmente.
Primero consideremos las nanopartículas que son de un solo metal. La cifra dada por el análisis en este caso se da en unidades de mg/L, este es el valor en ppm's. Esta cifra se registró para la solución que se analizó, y esta es de una concentración diluida en comparación con la solución sintetizada inicial debido a que las partículas tuvieron que ser digeridas primero en ácido, luego diluidas más en agua nanopura.
Como se mencionó anteriormente en el experimento 0.5 mL de las nanopartículas sintetizadas se digirieron primero en 9.5 mL de ácido nítrico concentrado. Después, cuando se completó la digestión se disolvieron 0.5 mL de esta solución en 9.5 mL de agua nanopura. Esta fue la solución final que se analizó mediante ICP, y la concentración de metal en esta solución será muy inferior a la de la solución original. En este caso la cantidad de analito en la solución final que se analiza es 1/20 th la de la cantidad total de material en la solución que se sintetizó originalmente.
Cálculo de la concentración en ppm
Tomemos un ejemplo de que tras el análisis por ICP-AES la cantidad de\(\ce{Fe}\) detectados es de 6.38 mg/L, primero convertir la cifra a mg/mL,
\[ 6.38~\mathrm { mg } / \mathrm { L } \times 1 / 1000~\mathrm { L } / \mathrm { mL } = 6.38`\mathrm { x } 10 ^ { - 3 }~\mathrm { mg } / \mathrm { mL } \nonumber \]
La cantidad de material se diluyó a un volumen total de 10 mL. Por lo tanto, debemos multiplicar este valor por 10 mL para ver cuánta masa había en todo el contenedor.
\[ 6.38 \times 10 ^ { - 3 }~\mathrm { mg } / \mathrm { mL } \times 10~\mathrm { mL } = 6.38 \times 10 ^ { - 2 }~\mathrm { mg } \nonumber \]
Esta es la masa total de hierro que estuvo presente en la solución que se analizó usando el dispositivo ICP. Para convertir esta cantidad a ppm debemos tomar en consideración el hecho de que 0.5 mL se diluyeron inicialmente a 10 mL, para ello debemos dividir la masa total de hierro por esta cantidad a la que se diluyó.
\[ 6.38 \times 10 ^ { - 2 }~\mathrm { mg } / 0.5~\mathrm { mL } = 0.1276~\mathrm { mg } / \mathrm { mL } \nonumber \]
Esta fue la cantidad total de analito en la solución de 10 mL que fue analizada por el dispositivo ICP, para alcanzar el valor en ppm se debe multiplicar por mil, es decir entonces 127.6 ppm de\(\ce{Fe}\).
Determinación de la concentración de la solución original
Ahora necesitamos tener en cuenta que hubo varias diluciones de la solución original primero para digerir los metales y luego disolverlos en agua nanopura, en total hubo dos diluciones y cada dilución fue equivalente en masa. Al diluir 0.5 mL a 10 mL, estamos diluyendo efectivamente la solución por un factor de 20, y esto se realizó dos veces.
\[ 0.1276~\mathrm { mg } / \mathrm { mL } \times 20 = 2.552~\mathrm { mg } / \mathrm { mL } \nonumber \]
Esta es la cantidad de analito en la solución de partículas digeridas, para encubrirlo a ppm debemos multiplicarlo por 1/1000 ml/L, de la siguiente manera:
\[ 2.552~\mathrm { mg } / \mathrm { mL } *\times 1 / 1000 \mathrm { mL } / \mathrm { L } = 2552~\mathrm { mg } / \mathrm { L } ^ { \mathrm { L } } \nonumber \]
Esta es esencialmente tu respuesta ahora como 2552 ppm. Esta es la cantidad de\(\ce{Fe}\) en la solución de partículas digeridas. Esto se hizo diluyendo 0.5 mL de la solución original en 9.5 mL de ácido nítrico concentrado, que es lo mismo que diluir por un factor de 20. Para calcular cuánto analito había en el lote original que se sintetizó volvemos a multiplicar el valor anterior por 20. Esta es la cantidad final de\(\ce{Fe}\) concentración del lote original cuando se sintetizó y se hizo soluble en hexanos.
\[ 2552~\mathrm { ppm } \times 20 = 51040~\mathrm { ppm } \nonumber \]
Cálculo de la relación estequiométrica
Pasando del cálculo de la concentración de elementos individuales ahora podemos concentrarnos en el cálculo de las relaciones estequiométricas en las nanopartículas bimetálicas.
Consideremos el caso cuando tenemos los elementos de hierro y cobre en la nanopartícula. Los montos determinados por ICP son:
- Hierro = 1.429 mg/L.
- Cobre = 1.837 mg/L.
Debemos dar cuenta de los pesos moleculares de cada elemento dividiendo el valor de ICP obtenido, por el peso molecular para ese elemento en particular. Para el hierro esto se calcula por
\[ \frac{1.429~\mathrm { mg }/ \mathrm { L }}{ 55.85} = 0.0211 \nonumber \],
y así esta es la relación molar de hierro. Por otro lado el ICP devuelve un valor para el cobre que viene dado por:
\[ \frac{1.837 \mathrm { mg } / \mathrm { L } }{ 63.55} = 0.0289 \nonumber \]
Para determinar el porcentaje de hierro utilizamos esta ecuación, que da un valor porcentual de 42.15% Fe.
\[ \% \text { Fe } = [ \frac{ \text { molar ratio of iron } }{\text { sum of molar ratios } } ] \times 100 \nonumber \]
Elaboramos el porcentaje de cobre de manera similar, lo que lleva a una respuesta de 57.85% Cu.
\[ \% \text { Cu} = [ \frac{ \text { molar ratio of copper} }{\text { sum of molar ratios } } ] \times 100 \nonumber \]
De esta manera se puede determinar el porcentaje de hierro en la nanopartícula en función de la concentración del reactivo previo a la síntesis (Figura\(\PageIndex{2}\)).
Determinación de la concentración de nanopartículas en solución
Los ejemplos anteriores han mostrado cómo calcular tanto la concentración de un analito como la concentración efectiva compartida de metales en la solución. Estas cifras corresponden a la concentración de átomos elementales presentes en solución. Para usar esto para determinar la concentración de nanopartículas debemos considerar primero cuántos átomos que se están detectando hay en una nanopartícula. Consideremos que las\(\ce{Fe3O4}\) nanopartículas son de 7 nm de diámetro. En una partícula de 7 nm esperamos encontrar 20,000 átomos. Sin embargo en este análisis solo hemos detectado átomos de Fe, por lo que aún debemos dar cuenta del número de átomos de oxígeno que forman la red cristalina también.
Por cada 3 átomos de Fe, hay 4 átomos de O. Pero como el hierro es un poco más grande que el oxígeno, va a suplir el hecho de que haya un átomo de Fe menos. Se trata de una simplificación excesiva pero en este momento sirve para que el lector sea consciente de los pasos que se requieren tomar a la hora de juzgar la concentración de nanopartículas. Consideremos que la mitad del tamaño de las nanopartículas se atribuye a átomos de hierro, y la otra mitad del tamaño se atribuye a átomos de oxígeno.
Como hay 20,000 átomos en total en una partícula de 7 nm, y luego al considerar el efecto del estado óxido diremos que por cada 10,000 átomos de Fe tendrás una partícula de 7 nm. Entonces ahora debemos averiguar cuántos átomos de Fe están presentes en la muestra para poder dividirlos por 10,000 para determinar cuántas nanopartículas están presentes.
En el caso anterior, encontramos que la solución cuando se sintetizó tenía una concentración de 51,040 ppm de átomos de Fe en solución. Para determinar a cuántos átomos equivale esto usaremos el hecho de que 1 mol de material tiene presente el número Avogadro de átomos.
\[ 51040~\mathrm { ppm } = 51040~\mathrm { mg } / \mathrm { L } = 51.040~\mathrm { g } / \mathrm { L } \nonumber \]
1 mol de hierro pesa 55.847 g. Para determinar cuántos moles tenemos ahora, dividimos los valores así:
\[ \frac{ 51.040~\mathrm{g / L} }{ 55.847~\mathrm{g} } = 0.9139~\text { mol/L } \nonumber \]
El número de átomos se encuentra multiplicando este por el número de Avogadro (6.022x10 23):
\[ ( 0.9139~\text { mol/L} ) \times \left( 6.022 \times 10 ^ { 23 } \text { atoms } \right) = 5.5 \times 10 ^ { 23 }~\text { atoms/L } \nonumber \]
Por cada 10,000 átomos tenemos una nanopartícula (NP) de 7 nm de diámetro, asumiendo que todas las partículas son equivalentes en tamaño podemos entonces dividir los valores. Esta es la concentración de nanopartículas por litro de solución tal como se sintetiza.
\[ \left( 5.5 \times 10 ^ { 23 } \text { atoms/ L } \right) / ( 10,000 \text { atoms/NP} ) = 5.5 \times 10 ^ { 19 }~\mathrm { NP } / \mathrm { L } \nonumber \]
Área de superficie combinada
Una cosa muy interesante de la nanotecnología para la que se pueden utilizar las nanopartículas es su increíble relación entre las áreas superficiales en comparación con el volumen. A medida que las partículas se hacen cada vez más pequeñas, la superficie se vuelve más prominente. Y como gran parte de la química se realiza en superficies, las nanopartículas son buenas contendientes para su uso futuro donde se requieren altas relaciones de aspecto.
En el ejemplo anterior consideramos que las partículas son de 7 nm de diámetro. El área superficial de dicha partícula es de 1.539 x10 -16 m 2. Por lo que la superficie combinada de todas las partículas se encuentra multiplicando cada partícula por sus áreas superficiales individuales.
\[ \left( 1.539 \times 10 ^ { - 16 } \mathrm { m } ^ { 2 } \right) \times \left( 5.5 \times 10 ^ { 19 }~mathrm { NP } / \mathrm { L } \right) = 8465~\mathrm { m } ^ { 2 } / \mathrm { L } \nonumber \]
Para poner esto en contexto, un campo de futbol americano es aproximadamente de 5321 m 2. Por lo que un litro de esta solución de nanopartículas tendría la misma superficie de aproximadamente 1.5 campos de fútbol. Eso es adjudicar área en un litro de solución cuando se considera la cantidad de material que se necesitaría para forrar el campo de fútbol con fina capa de hierro metálico. ¡Recuerda que solo hay alrededor de 51 g/L de hierro en esta solución!
Bibliografía
- http://www.ivstandards.com/extras/pertable/
- A. Scheffer, C. Engelhard, M. Sperling, y W. Buscher, W. Anal. Bioanal. Chem. , 2008, 390, 249.
- H. Nakamuru, T. Shimizu, M. Uehara, Y. Yamaguchi, y H. Maeda, Mater. Res. Soc., Symp. Proc. , 2007, 1056, 11.
- S. Sun y H. Zeng, J. Am. Chem. Soc. , 2002, 124, 8204.
- C. A. Crouse y A. R. Barron, J. Mater. Chem. , 2008, 18, 4146.


