1.7: Análisis de electrodos selectivos de iones
- Page ID
- 71217
Introducción
El electrodo selectivo de iones (ISE) es una técnica analítica utilizada para determinar la actividad de los iones en solución acuosa midiendo el potencial eléctrico. ISE tiene muchas ventajas en comparación con otras técnicas, entre ellas:
- Es relativamente económico y fácil de operar.
- Cuenta con amplio rango de medición de concentración.
- Al medir la actividad, en lugar de concentración, resulta particularmente útil en aplicaciones biológicas/médicas.
- Es una medición en tiempo real, lo que significa que puede monitorear el cambio de actividad del ion con el tiempo.
- Puede determinar iones cargados tanto positiva como negativamente.
En base a estas ventajas, ISE tiene una amplia variedad de aplicaciones, lo cual es razonable considerando la importancia de medir la actividad iónica. Por ejemplo, ISE encuentra su uso en el monitoreo de contaminación en aguas naturales (CN -, F -, S -, Cl -, etc.), procesamiento de alimentos (NO 3 -, NO 2 - en conservantes de carne), Ca 2+ en productos lácteos y K + en zumos de frutas, etc.
Configuración de medición
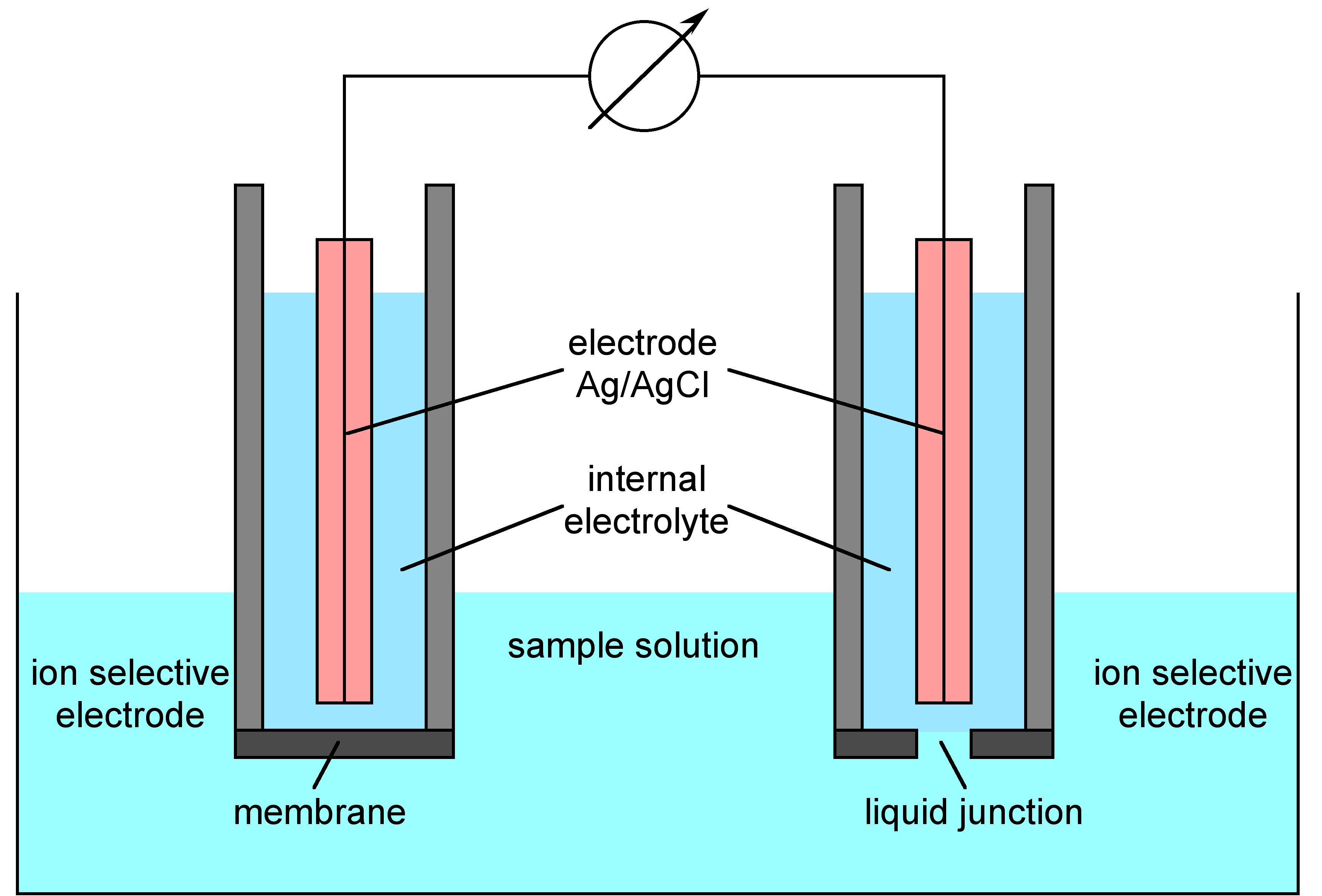
Antes de enfocarse en cómo funciona ISE, sería bueno hacerse una idea de cómo se ve la configuración ISE y el componente del instrumento ISE. La figura\(\PageIndex{1}\) muestra los componentes básicos de la configuración ISE. Tiene un electrodo selectivo de iones, que permite el paso de iones medidos, pero excluye el paso de los otros iones. Dentro de este electrodo selectivo de iones, se encuentra un electrodo de referencia interno, el cual está hecho de alambre de plata recubierto con cloruro de plata sólido, incrustado en solución concentrada de cloruro de potasio (solución de relleno) saturada con cloruro de plata. Esta solución también contiene los mismos iones que los que se van a medir. También hay un electrodo de referencia similar al electrodo selectivo de iones, pero no hay iones a medir en el electrolito interno y la membrana selectiva es reemplazada por frita porosa, lo que permite el paso lento de la solución de llenado interna y forma la unión líquida con la solución de texto externa . El electrodo selectivo de iones y el electrodo de referencia están conectados por un milivoltímetro. La medición se logra simplemente sumergiendo los dos electrodos en la misma solución de prueba.
Teoría de cómo funciona ISE
Comúnmente hay más de un tipo de iones en solución. Entonces, ¿cómo logra ISE medir la concentración de cierto ion en solución sin verse afectado por otros iones? Esto se hace aplicando una membrana selectiva en el electrodo selectivo de iones, lo que solo permite que el ion deseado entre y salga. En equilibrio, existe diferencia de potencial entre dos lados de la membrana, y se rige por la concentración de la solución ensayada descrita por la ecuación de Nernst EQ, donde E es potencial, E 0 es una característica constante de un ISE particular, R es la constante de gas (8.314 J/K.mol), T es la temperatura (en K), n es la carga del ion y F es constante de Faraday (96,500 culombios/mol). Para que sea relevante, la diferencia de potencial medida es proporcional al logaritmo de concentración iónica. Así, la relación entre la diferencia de potencial y la concentración de iones se puede determinar midiendo el potencial de dos soluciones de concentración iónica ya conocida y una gráfica basada en el potencial medido y el logaritmo de la concentración de iones. Con base en esta gráfica, se puede conocer la concentración de iones de una solución desconocida midiendo el potencial y correspondiéndolo a la parcela.
\[ E = E ^ { 0 } + ( 2.030~RT / nF ) \log C \label{eq:nernst} \]
Ejemplo de Aplicación: Determinación de Ion Fluoruro
El fluoruro se agrega al agua potable y a la pasta dental para prevenir la caries dental y así la determinación de su concentración es de gran importancia para la salud humana. Aquí, daremos algunos datos y cálculos para mostrar cómo se determina la concentración de ion fluoruro y echar un vistazo a lo relevante que es ISE para nuestra vida diaria. Según la ecuación de Nernst, (Ecuación\ ref {eq:nernst}), en este caso n = 1, T = 25 °C y E 0, R, F son constantes y así esta ecuación puede simplificarse como
\[ E= K+S\log C \nonumber \]
El primer paso es obtener una curva de calibración para el ion fluoruro y esto se puede hacer preparando varias soluciones patrón de fluoruro con concentración conocida y haciendo una gráfica de E versus log C.
| Concentración (mg/L) | log C | E (mV) |
| 200.0 | 2.301 | -35.6 |
| 100.0 | 2.000 | -17.8 |
| 50.00 | 1.699 | 0.4 |
| 25.00 | 1.398 | 16.8 |
| 12.50 | 1.097 | 34.9 |
| 6.250 | 0.796 | 52.8 |
| 3.125 | 0.495 | 70.4 |
| 1.563 | 0.194 | 89.3 |
| 0.781 | 0.107 | 107.1 |
| 0.391 | 0.408 | 125.5 |
| 0.195 | 0.709 | 142.9 |
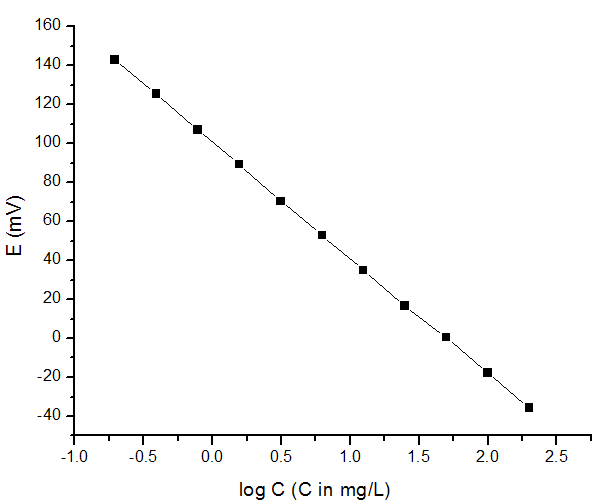
A partir de la gráfica podemos identificar claramente la relación lineal entre E versus log C con pendiente medida a -59.4 mV, la cual es muy cercana al valor teórico -59.2 mV a 25 °C, esta gráfica puede dar la concentración de cualquier solución que contenga ion fluoruro dentro del rango de 0.195 mg/L y 200 mg/L por medir el potencial de la solución desconocida.
Límite de ISE
Aunque ISE es una técnica rentable y útil, tiene algunos inconvenientes que no se pueden evitar. La membrana selectiva de iones solo permite el paso de los iones medidos y así el potencial solo está determinado por este ion en particular. Sin embargo, lo cierto es que no existe tal membrana que sólo permita el paso de un ión, y así hay casos en los que hay más de un iones que pueden pasar por la membrana. Como resultado, el potencial medido se ve afectado por el paso de los iones “no deseados”. Además, debido a su dependencia de la membrana selectiva de iones, un ISE solo es adecuado para un ion y esto puede ser inconveniente a veces. Otro problema que vale la pena notar es que el ion selectivo mide la concentración de iones en equilibrio en la superficie de la membrana. Esto sí importa mucho si la solución se diluye pero a concentraciones más altas, las interacciones interiónicas entre los iones en la solución tienden a disminuir la movilidad de los iones y así la concentración cerca de la membrana sería menor que la del volumen. Esta es una fuente de inexactitud de ISE. Para analizar mejor los resultados de ISE, tenemos que ser conscientes de estas limitaciones inherentes a la misma.
Bibliografía
- D. S. Papastathopoulos y M. I. Karayannis, J. Chem. Edu. , 1980, 57, 904.
- J. E. O'Reilly, J. Chem. Edu. , 1979, 56, 279.
- F. Scholz, Electroanalytical Methods: Guide to Experiments and Application, 2ª edición, Springer, Berlín (2010).
- R. Greef, R. Peat, L. M. Peter, D. Pletcher, y J. Robinson, Instrumental Methods in Electrochemistry, Ellis Horwood, Chichester (1985).


