1.11: Espectroscopia de Fluorescencia
- Page ID
- 71263
Introducción
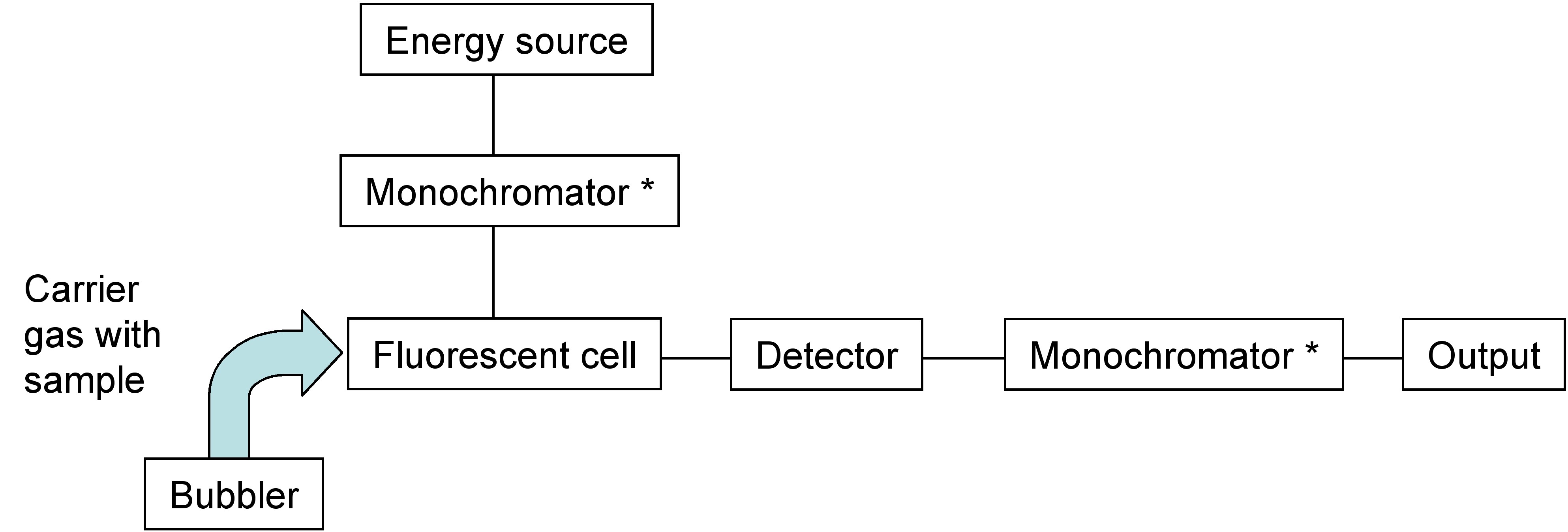
La espectroscopia de fluorescencia atómica (AFS) es un método que fue inventado por Winefordner y Vickers en 1964 como medio para analizar la concentración química de una muestra. La idea es excitar un vapor de muestra con la radiación UV adecuada, y midiendo la radiación emisora, se podría cuantificar la cantidad del elemento específico que se está midiendo. En su forma más básica, el AFS consiste en una fuente de luz UV para excitar la muestra, un monocromador, un detector y un dispositivo de lectura (figura\(\PageIndex{1}\)). La espectroscopia de fluorescencia atómica de vapor frío (CVAFS) utiliza la misma técnica que la AFS, pero la preparación de la muestra se adapta específicamente para cuantificar la presencia de metales pesados que son volátiles, como el mercurio, y permite medir estos elementos a temperatura ambiente.
Teoría
La teoría detrás de CVAFS es que a medida que la muestra absorbe fotones de la fuente de radiación, entrará en un estado excitado. A medida que el átomo vuelve a caer al estado fundamental desde su (los) estado (s) vibratorio (s) excitado (s), emitirá un fotón, que luego se podrá medir para determinar la concentración. En su sentido más básico, este proceso está representado por\ ref {1}, donde P F es la potencia emitida como fotones de la muestra, P abs es la potencia de la radiación absorbida por la muestra, y φ es el factor de proporcionalidad de la energía perdida por colisiones e interacciones entre los átomos presentes, y no debido a la emisión de fotones.
\[ \text{P}_{F}\ =\ \psi \text{P}_{\text{abs}} \label{1} \]
Preparación de Muestras
Para CVAFS, la muestra debe ser digerida, generalmente con un ácido para descomponer el compuesto que se está probando de manera que todos los átomos metálicos en la muestra sean accesibles para ser vaporizados. La muestra se pone en un burbujeador, generalmente con un agente que convertirá el elemento en su especie gaseosa. Un portador de gas inerte tal como argón se pasa entonces a través del burbujeador para llevar los vapores metálicos a la celda de fluorescencia. Es importante que el portador de gas sea inerte, de manera que la señal solo será absorbida y emitida por la muestra en cuestión y no por el gas portador.
Espectroscopia de fluorescencia atómica
Una vez que la muestra se carga en la celda, una fuente de luz UV colimada (casi paralela) pasa a través de la muestra para que fluoresce. A menudo se usa un monocromador, ya sea entre la fuente de luz y la muestra, o entre la muestra y el detector. Estas dos configuraciones diferentes se denominan espectro de excitación o emisión, respectivamente. En un espectro de excitación, la fuente de luz se mantiene a una longitud de onda constante a través del monocromador, y se recogen múltiples longitudes de onda de la luz emitida, mientras que en el espectro de emisión, solo se mide la longitud de onda especificada de la luz emitida desde la muestra, pero la muestra se expone a múltiples longitudes de onda de la luz de la fuente excitatoria. La fluorescencia será detectada por un tubo fotomultiplicador, que es extremadamente sensible a la luz, y se utiliza un fotodiodo para convertir la luz en voltaje o corriente, que luego a su vez puede interpretarse en la cantidad del químico presente.
Detección de mercurio mediante amalgama de oro y espectroscopía de fluorescencia atómica de vapor frío
Introducción
La intoxicación por mercurio puede dañar el sistema nervioso, los riñones y también el desarrollo fetal en mujeres embarazadas, por lo que es importante evaluar los niveles de mercurio presentes en nuestro entorno. Algunas de las fuentes más comunes de mercurio se encuentran en el aire (de la fabricación industrial, la minería y la quema de carbón), el suelo (depósitos, desechos), el agua (subproducto de bacterias, desechos) y en los alimentos (especialmente los mariscos). Aunque la regulación para el contenido de mercurio en alimentos, agua y aire difiere, la regulación de la EPA para el contenido de mercurio en el agua es la más baja y no puede exceder de 2 ppb (27 µg/L).
En 1972, J. F. Kopp et al. publicaron por primera vez un método para detectar concentraciones diminutas de mercurio en suelo, agua y aire mediante amalgamación de oro y espectroscopía de fluorescencia atómica de vapor frío. Si bien la absorción atómica también puede medir las concentraciones de mercurio, no es tan sensible o selectiva como la espectroscopia de fluorescencia atómica de vapor frío (CVAFS).
Preparación de Muestras
Como es común con todas las formas de espectroscopia de fluorescencia atómica (AFS) y espectrometría de absorción atómica (AES), la muestra debe ser digerida, generalmente con un ácido, para descomponer los compuestos de manera que se pueda medir todo el mercurio presente. La muestra se pone en el burbujeador con un agente reductor como el cloruro estañoso (SnCl 2) para que Hg 0 sea el único estado presente en la muestra.
Amalgama de Oro y CVAFS
Una vez que el mercurio está en su forma elemental, el argón ingresa al burbujeador a través de una trampa de oro, y lleva los vapores de mercurio fuera del burbujeador a la primera trampa de oro, después de pasar primero a través de una trampa de cal sodada (mezcla de Ch (OH) 2, NaOH y KOH) donde se atrapan los vapores de ácido o agua restantes. Después de que todo el mercurio de la muestra es absorbido por la primera trampa de oro, se calienta a 450 °C, lo que provoca que el mercurio absorbido en la trampa de oro sea transportado por el gas argón a la segunda trampa de oro. Una vez que el mercurio de la muestra ha sido absorbido por la segunda trampa, se calienta a 450 °C, liberando el mercurio que va a ser transportado por el gas argón a la celda de fluorescencia, donde se utilizará luz a una longitud de onda de 253.7 nm para las muestras de mercurio. El límite de detección de mercurio usando amalgama de oro y CVAFS es de alrededor de 0.05 ng/L, pero el límite de detección variará debido al equipo que se esté utilizando, así como al error humano.
Cálculo de las concentraciones de CVAFS
Se debe hacer una solución estándar de mercurio, y a partir de estas diluciones se utilizarán para hacer al menos cinco soluciones estándar diferentes. Dependiendo del límite de detección y de lo que se esté analizando, las concentraciones en las soluciones estándar variarán. Tenga en cuenta que qué otros productos químicos contienen las soluciones estándar dependerá de cómo se digiera la muestra.
Ejemplo 1
Se elabora una solución de trabajo de 1.00 g/mL Hg (1 ppm), y por dilución, se elaboran cinco estándares a partir de la solución de trabajo, a 5.0, 10.0, 25.0, 50.0 y 100.0 ng/L (ppt). Si estos cinco estándares dan alturas de pico de 10 unidades, 23 unidades, 52 unidades, 110 unidades y 207 unidades, respectivamente, entonces se usa\ ref {2} para calcular el factor de calibración, donde CF x es el factor de calibración, A x es el área del pico o altura del pico, y C x es el concentración en ng/L del estándar,\ ref {3}.
\[ \text{CF}_{x}\ =\ \text{A}_{X}/\text{C}_{X} \label{2} \]
\[ 10/5.0\ \text{ng}/\text{L}\ =\ 2.00\text{ units L/ng} \label{3} \]
Los factores de calibración para los otros cuatro estándares se calculan de la misma manera: 2.30, 2.08, 2.20 y 2.07, respectivamente. Luego se toma el promedio de los cinco factores de calibración,\ ref {4}.
\[ \text{CF}_{m}\ =\ (2.00\ +\ 2.30\ +\ 2.08\ +\ 2.20\ +\ 2.07)/5\ =\ 2.13\text{ units L/ng} \label{4} \]
Ahora para calcular la concentración de mercurio en la muestra, se utiliza\ ref {5}, donde A s es el área de la muestra pico, CF m es el factor de calibración medio, V std es el volumen de la solución estándar menos los reactivos añadidos, y V smp es el volumen del muestra inicial (volumen total menos volumen de reactivos añadidos). Si A s se mide en 49 unidades, V std = 0.47 L, y V smp = 0.26 L, entonces se puede calcular la concentración,\ ref {6}.
\[ [\text{Hg}]\ (\text{ng/L})\ =\ (\text{A}_{s}/\text{CF}_{m})\cdot (\text{V}_{std}/V_{smp}) \label{5} \]
\[ 49\ units/2.13\ units\ L/ng)\cdot (0.47\ L/0.26\ L)\ =\ 43.2\ \text{ng}/\text{L of Hg present} \label{6} \]
Fuentes de error
La contaminación de la recolección de la muestra es una de las mayores fuentes de error: si la muestra no se recolecta correctamente o las manos/guantes no están limpias, esto puede alterar la concentración. Además, asegurándose de que la cristalería y el equipo estén limpios de cualquier fuente de contaminación.
Además, los viales de muestra que se utilizan para almacenar muestras que contienen mercurio deben estar hechos de vidrio de borosilicato o fluoropolímero, ya que el mercurio puede lixiviar o absorber otros materiales, lo que podría provocar una lectura de concentración inexacta.
La aplicación de la espectroscopia de fluorescencia en la detección de iones de mercurio
Mercurio en el Medio Ambiente
La contaminación por mercurio se ha convertido en un problema mundial y pone en grave peligro la salud humana. El mercurio inorgánico se puede liberar fácilmente al medio ambiente a través de una variedad de fuentes antropogénicas, como la minería del carbón, la incineración de desechos sólidos, la combustión de combustibles fósiles y la fabricación de productos químicos. También se puede liberar a través de fuentes no antropogénicas en forma de incendios forestales, emisiones volcánicas y emisiones oceánicas.
El mercurio se puede transportar fácilmente a la atmósfera como la forma del vapor de mercurio. La deposición atmosférica de iones de mercurio conduce a la acumulación en las plantas, en la capa superior del suelo, en el agua y en los sedimentos submarinos. Algunos procariotas que viven en los sedimentos pueden convertir el mercurio inorgánico en metilmercurio, que puede ingresar a la cadena alimentaria y finalmente es ingerido por el ser humano.
El mercurio pone seriamente en peligro la salud de las personas. Un ejemplo es que muchas personas murieron debido a la exposición al metilmercurio a través del consumo de mariscos en Minamata, Japón. La exposición en el mercurio orgánico causa graves problemas neurológicos, como daño cerebral prenatal, trastornos cognitivos y del movimiento, pérdida de visión y audición, e incluso la muerte. Además, el mercurio inorgánico también se dirige a las células epiteliales renales del riñón, lo que resulta en necrosis tubular y proteinuria.
La crisis del mercurio en el medio ambiente y el sistema biológico obligan a las personas a realizar trabajos relacionados para enfrentar el reto. Diseñar e implementar nuevas herramientas de detección de mercurio, en última instancia, facilitará estos esfuerzos. Por lo tanto, en este trabajo, introduciremos principalmente el sensor molecular de fluorescencia, que cada vez es más importante en la detección de mercurio debido a su fácil uso, bajo costo y alta eficiencia.
Introducción de sensores moleculares de fluorescencia
El sensor molecular de fluorescencia, un tipo de sonda molecular de fluorescencia, puede ser una respuesta rápida y reversible en el proceso de reconocimiento. Existen cuatro factores, selectividad, sensibilidad, detección in situ y tiempo real, que generalmente se utilizan para evaluar el rendimiento del sensor. En este trabajo se introducen cuatro principios fundamentales para el diseño de sensores moleculares de fluorescencia.
Transferencia de electrones fotoinducida (PET)
La transferencia de electrones fotoinducida es el principio más popular en el diseño de sensores moleculares de fluorescencia. La estructura característica de los sensores PET incluye tres partes como se muestra en la Figura\(\PageIndex{2}\):
- El fluoróforo absorbe la luz y emite señal de fluorescencia.
- El receptor interactúa selectivamente con el huésped.
- Un espaciador conecta el fluoróforo y el receptor juntos para formar un sistema integral y, con éxito, transfiere eficazmente la información de reconocimiento del receptor al fluoróforo.
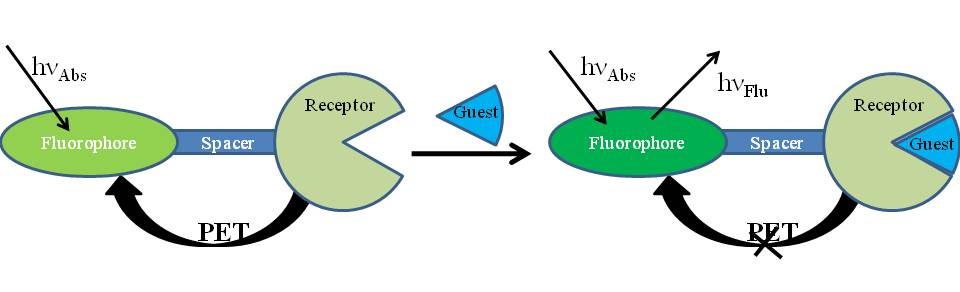
En los sensores PET, la transferencia de electrones fotoinducida hace realidad la transferencia de información de reconocimiento a la señal de fluorescencia entre el receptor y el fluoróforo. La figura\(\PageIndex{2}\) muestra el proceso detallado de cómo funciona el PET en el sensor molecular de fluorescencia. El receptor podría proporcionar el electrón a la órbita electoral desocupada del fluoróforo excitado. El electrón excitado en el fluoróforo no pudo regresar al orbital original, resultando en la extinción de la emisión de fluorescencia. La coordinación del receptor y el huésped disminuyó la capacidad donante de electrones del receptor redujo o incluso interrumpió el proceso de PET, lo que condujo a la mejora de la intensidad de la emisión de fluorescencia. Por lo tanto, los sensores tuvieron débil o ninguna emisión de fluorescencia antes de la coordinación. Sin embargo, la intensidad de la emisión de fluorescencia aumentaría rápidamente después de la coordinación del receptor y la ráfaga.
Transferencia de Carga Intramolecular (TIC)
La transferencia de carga intramolecular (ICT) también se denomina transferencia de carga fotoinducida. La estructura característica de los sensores ICT incluye solo el fluoróforo y el grupo de reconocimiento, pero no el espaciador. El grupo de reconocimiento se une directamente al fluoróforo. Los sustituyentes extractores de electrones o donadores de electrones en el grupo de reconocimiento juegan un papel importante en el reconocimiento. Cuando ocurre el reconocimiento, la coordinación entre el grupo de reconocimiento y el huésped afecta la densidad electrónica en el fluoróforo, resultando en el cambio de emisión de fluorescencia en forma de desplazamiento azul o desplazamiento al rojo.
Excimer
Cuando los dos fluoróforos están a la distancia adecuada, se puede formar un excímero intermolecular entre el estado excitado y el estado fundamental. La emisión de fluorescencia del excímero es diferente con el monómero y principalmente en forma de emisión nueva, amplia, fuerte y de longitud de onda larga sin estructuras finas. La distancia adecuada determina la formación del excímero, por lo tanto, la modulación de la distancia entre los dos fluoróforos se vuelve crucial en el diseño de los sensores basados en este mecanismo. Los fluoróforos tienen una larga vida útil en el estado singlete para formar fácilmente los excímeros. A menudo se utilizan en tales sensores.
Transferencia de energía por resonancia de fluorescencia (FRET)
FRET es un principio popular en el diseño del sensor molecular de fluorescencia. En un sistema, existen dos fluoróforos diferentes, en los que uno actúa como donante de energía del estado excitado al receptor del otro. Como se muestra en la Figura\(\PageIndex{2}\), el receptor acepta la energía del estado excitado del donante y da la emisión de fluorescencia, mientras que el donante volverá al estado básico electrónico. Hay tres factores que afectan el desempeño de FRET. Son la distancia entre el donante y el aceptor, la orientación adecuada entre el momento dipolar de emisión del donante y el momento de absorción del aceptor, y la extensión del solapamiento espectral entre el espectro de emisión del donante y el espectro de absorción del aceptor (Figura\(\PageIndex{3}\)).
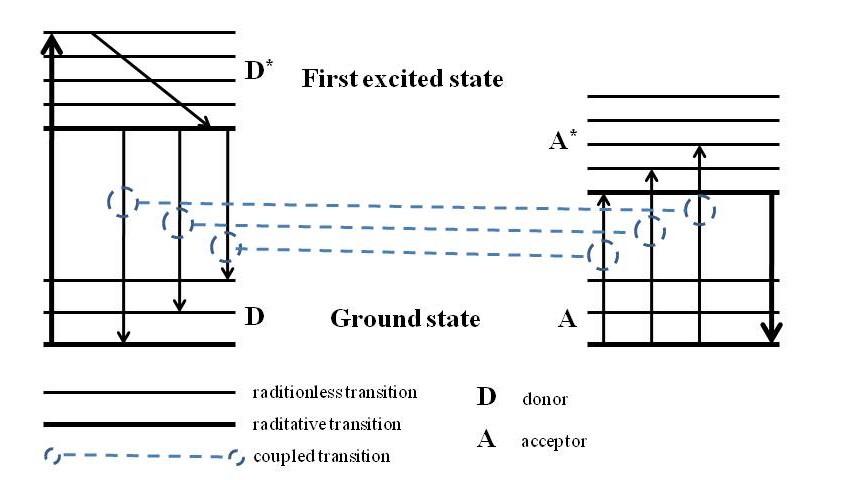
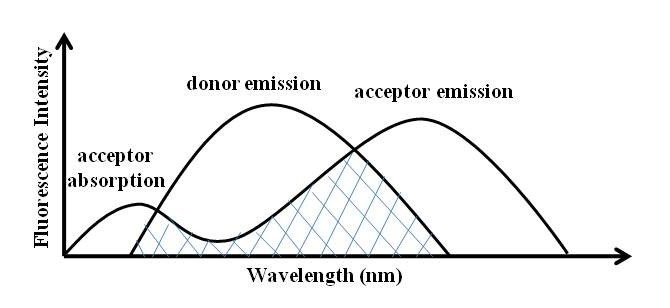
Introducción de la Espectroscopia de Fluorescencia
Fluorescencia
La fluorescencia es un proceso que implica la emisión de luz de cualquier sustancia en los estados excitados. En términos generales, la fluorescencia es la emisión de radiación electromagnética (luz) por la sustancia absorbida por la radiación de diferente longitud de onda. Su absorción y emisión se ilustra en el diagrama de Jablonski (Figura\(\PageIndex{4}\)), un fluoróforo se excita a un estado electrónico y vibracional superior desde el estado fundamental después de la excitación. Las moléculas excitadas pueden relajarse para disminuir el estado vibracional debido a la relajación vibratoria y, luego, volver a afinar al estado fundamental en forma de emisión de fluorescencia.
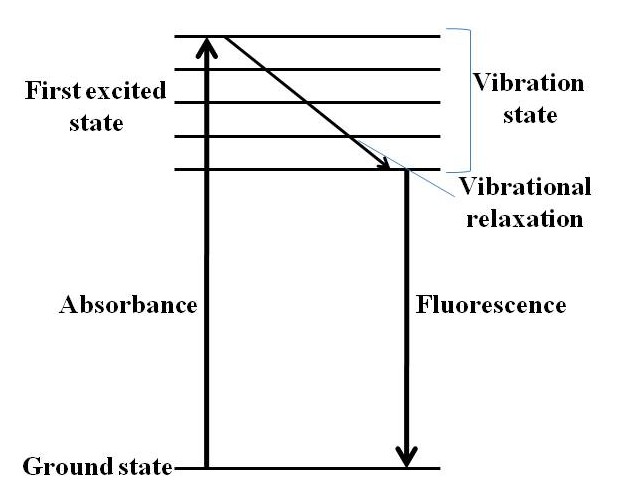
Instrumentación
La mayoría de los espectrofluorómetros pueden registrar espectros tanto de excitación como de emisión. Consiste principalmente en cuatro partes: fuentes de luz, monocromadores, filtros ópticos y detector (Figura\(\PageIndex{5}\)).
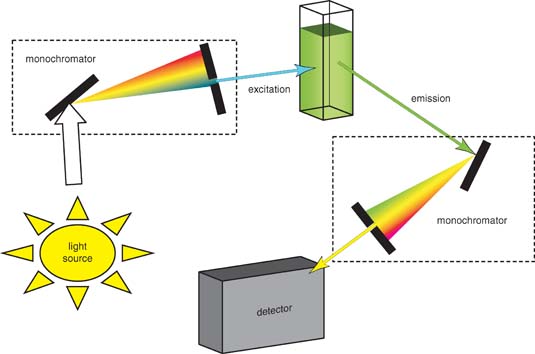
Fuentes de Luz
Las fuentes de luz que pueden emitir longitud de onda de luz sobre el ultravioleta y el rango visible pueden proporcionar la energía de excitación. Existen diferentes fuentes de luz, incluyendo lámparas de arco e incandescentes de xenón, lámparas de mercurio de alta presión (Hg), lámparas de arco Xe-Hg, lámparas de Hg y Hg-Ar de baja presión, lámparas de xenón pulsado, lámparas halógenas de cuarzo-tungsteno (QTH), fuentes de luz LED, etc. La fuente de luz adecuada se elige en función de la aplicación.
Monocromadores
Los prismas y las rejillas de difracción son dos tipos de monocharomadores utilizados principalmente, que ayudan a obtener la luz cromática experimentalmente necesaria con un rango de longitud de onda de 10 nm. Por lo general, los monocharomadores se evalúan en base a la dispersión, eficiencia, nivel de luz parásita y resolución.
Filtros Ópticos
Se utilizan filtros ópticos además de monocromadores con el fin de purificar aún más la luz. Hay dos tipos de filtros ópticos. El primero es el filtro coloreado, que es el filtro más tradicional y también se divide en dos categorías: filtro monocromático y filtro de paso largo. El otro es filtro de película delgada que es el suplemento para el primero en la aplicación y siendo gradualmente en lugar de filtro coloreado.
Detector
Una matriz InGaAs es el detector estándar utilizado en muchos espectrofluorómetros. Puede proporcionar una caracterización espectral rápida y robusta en el IR cercano.
Aplicaciones
Sensor de Fluorescencia PET
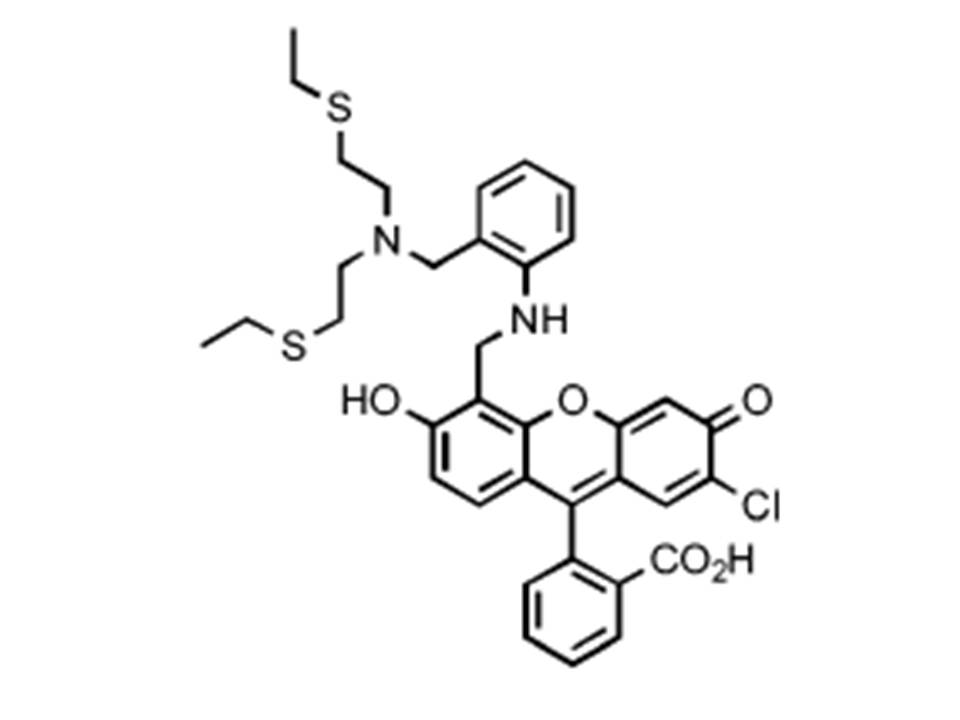
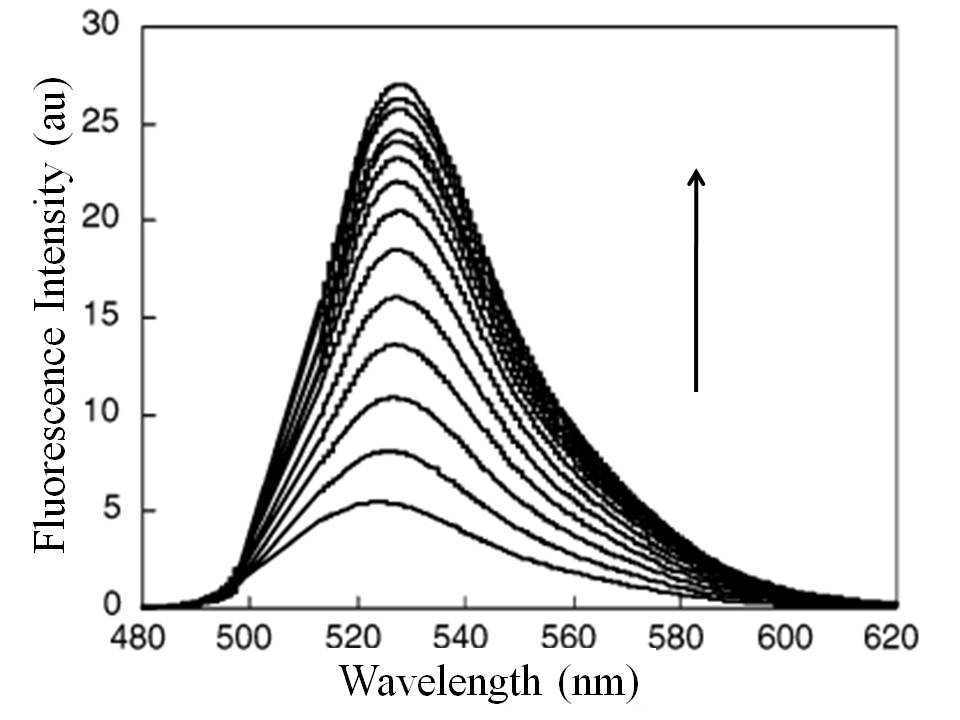
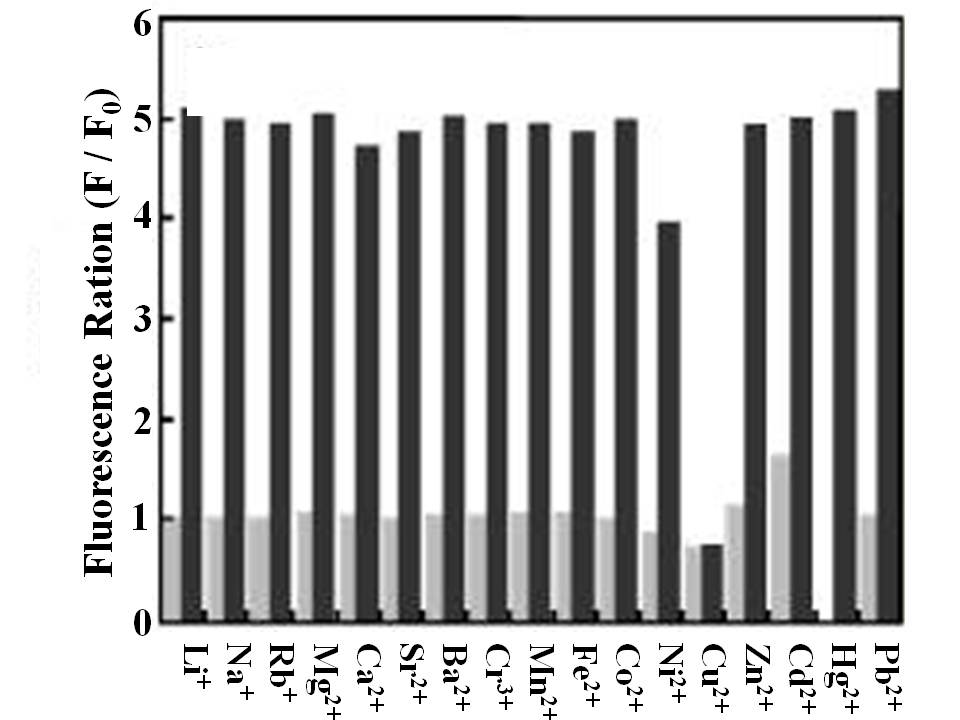
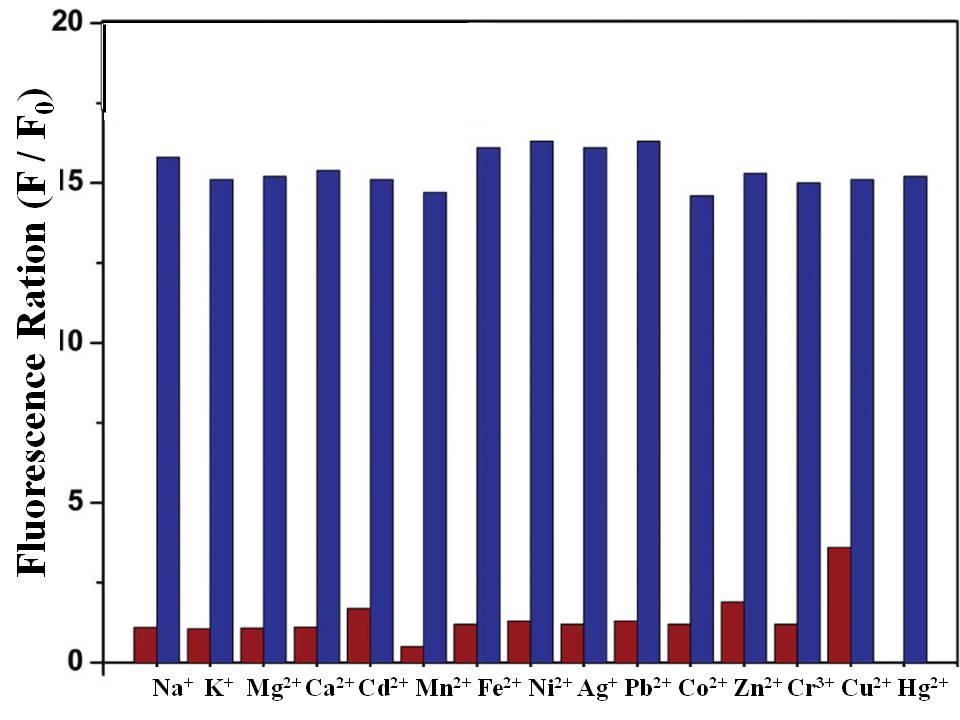
Como sensor de PET, el ácido 2- {5- [(2- {[bis - (2-etilsulfanil-etil) -amino] -metil} -fenilamino) -metil] -2-cloro-6-hidroxi-3-oxo-3H-xanten-9-il} -benzoico (MS1) (Figura\(\PageIndex{6}\)) muestra buena selectividad para iones mercurio en solución tampón (pH = 7, 50 mM PIPES, 100 mM KCl). De la Figura\(\PageIndex{7}\), es claro que, al aumentar la concentración de iones Hg 2+, la coordinación entre el sensor y los iones Hg 2+ interrumpió el proceso de PET, conduciendo al incremento de la intensidad de emisión de fluorescencia con ligero desplazamiento al rojo a 528 nm. El sensor MS1 también mostró buena selectividad para iones Hg 2+ sobre otros cationes de interés como se muestra en las barras de la derecha en la Figura\(\PageIndex{8}\); además, tuvo buena resistencia a la interferencia de otros cationes cuando se detectaron iones Hg 2+ en la solución de mezcla excluyendo Cu 2+ como se muestra en las barras oscuras en la Figura\(\PageIndex{8}\).
Sensor de Fluorescencia TIC
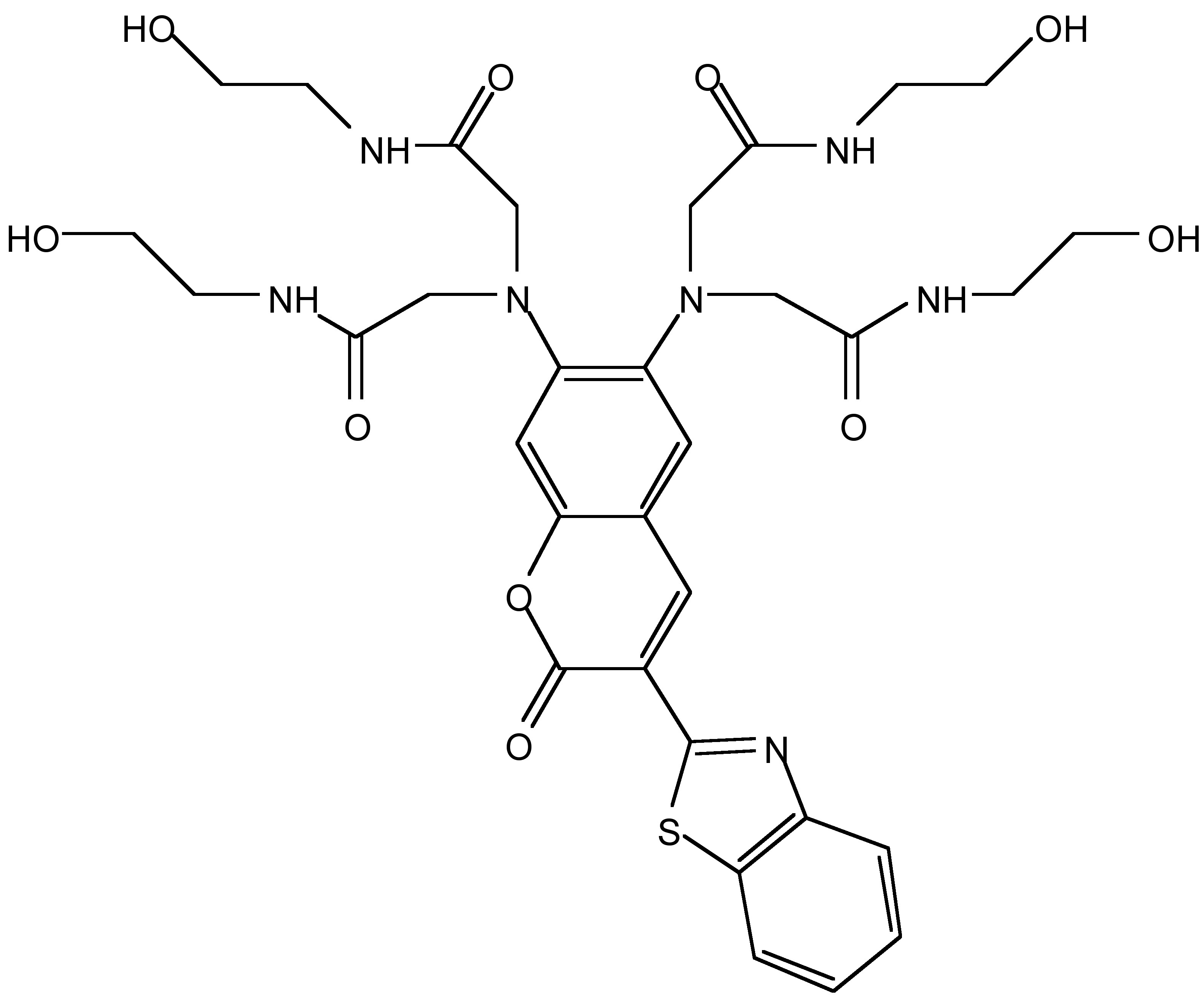
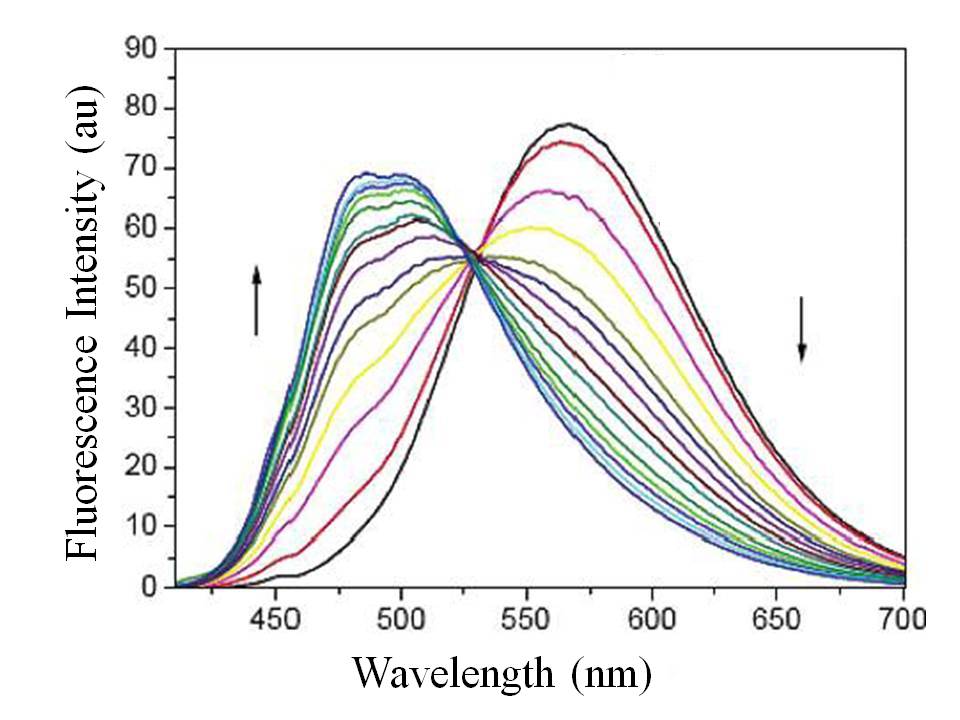
Se ha demostrado que 2,2',2"'- (3- (benzo [d] tiazol-2-il) -2-oxo-2-H-cromeno-6,7-diil) bis (azanotriil) tetraquis (N- (2-hidroxietil) acetamida) (RMS\(\PageIndex{9}\)) (Figura) es un sensor de fluorescencia ICT. De la Figura\(\PageIndex{10}\), es claro que, con el incremento gradual de la concentración de iones Hg 2+, los espectros de emisión de fluorescencia revelaron un desplazamiento azul significativo, el cual fue un desplazamiento de banda de emisión de aproximadamente 100 nm de 567 a 475 nm en presencia de 40 equiv de iones Hg 2+. El cambio de fluorescencia provino de la coexistencia de dos átomos de nitrógeno de anilina ricos en electrones en el resto receptor donador de electrones, lo que impidió la expulsión de iones Hg 2+ de ellos simultáneamente en el fluoróforo ICT excitado. El sensor RMS también mostró buena selectividad sobre otros cationes de interés. Como se muestra en la Figura\(\PageIndex{11}\), es fácil encontrar que solo los iones Hg 2+ pueden modular la fluorescencia de RMS en una solución de agua tamponada neutra.

Sensor de fluorescencia excímero
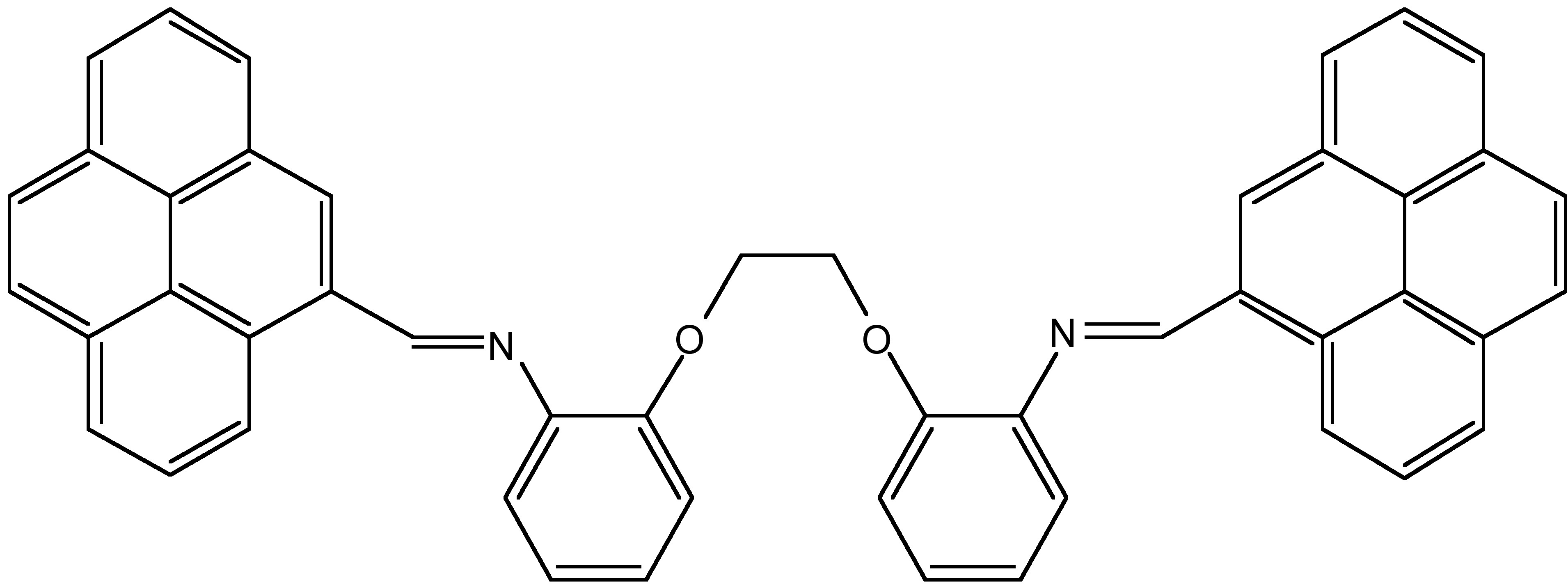
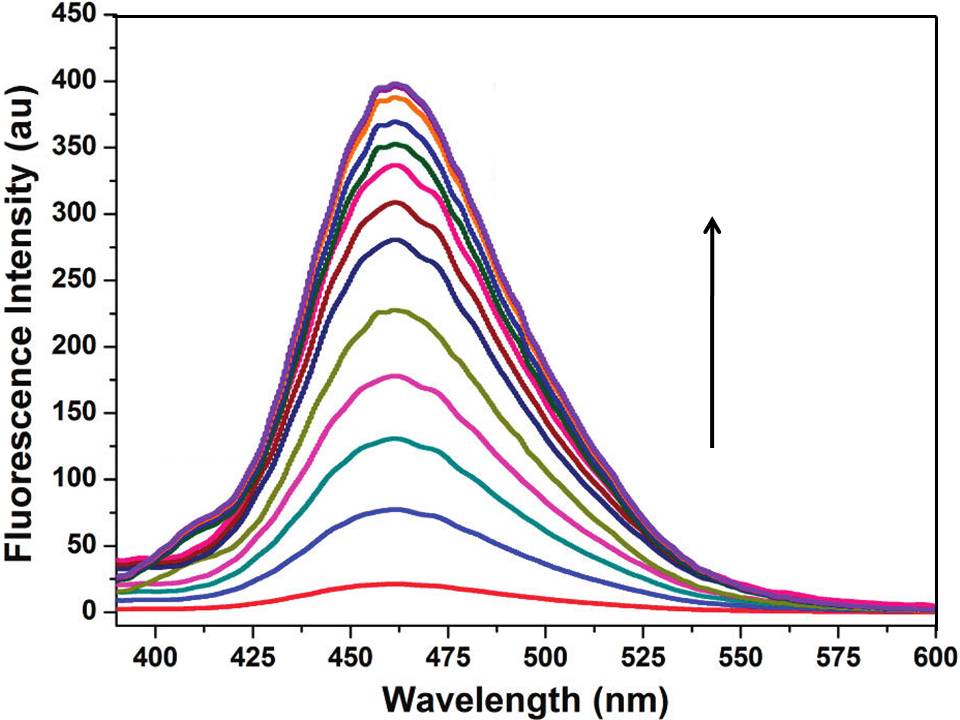
El (NE, N'E) -2,2'- (etano-1,2-diil-bis (oxi)) bis (N- (piren-4-ilmetileno) anilina) (BA) (Figura\(\PageIndex{12}\) es el sensor de fluorescencia excímero. Como se muestra en la Figura\(\PageIndex{13}\), cuando existía BA sin iones mercurio en la mezcla de HEPES-CH 3 CN (80:20, v/v, pH 7.2), solo tuvo la débil emisión de fluorescencia del monómero. Al aumentar la concentración de iones mercurio en la solución de BA, apareció una fuerte emisión de fluorescencia excímera a 462 nm y se incrementó con el cambio de la concentración de iones mercurio. De la Figura\(\PageIndex{14}\), es claro que BA mostró buena selectividad para los iones mercurio. Además, tuvo buena resistencia a la interferencia al detectar iones de mercurio en la solución de mezcla.
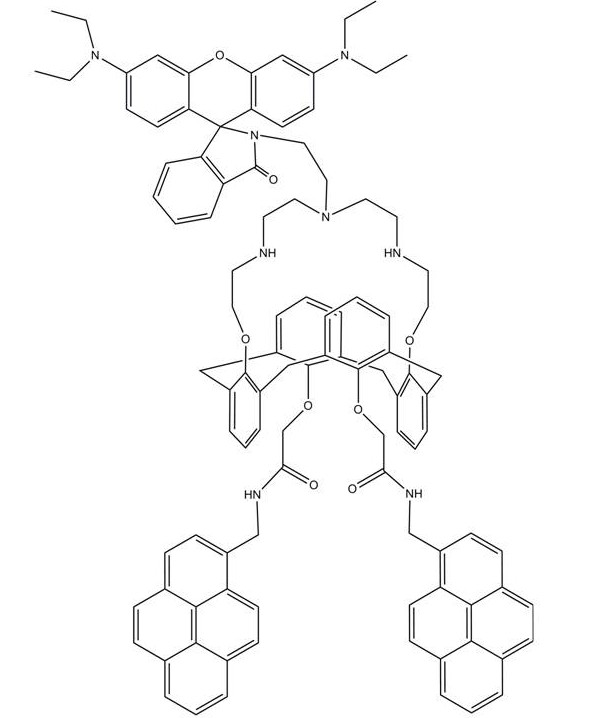
Sensor de Fluorescencia FRET
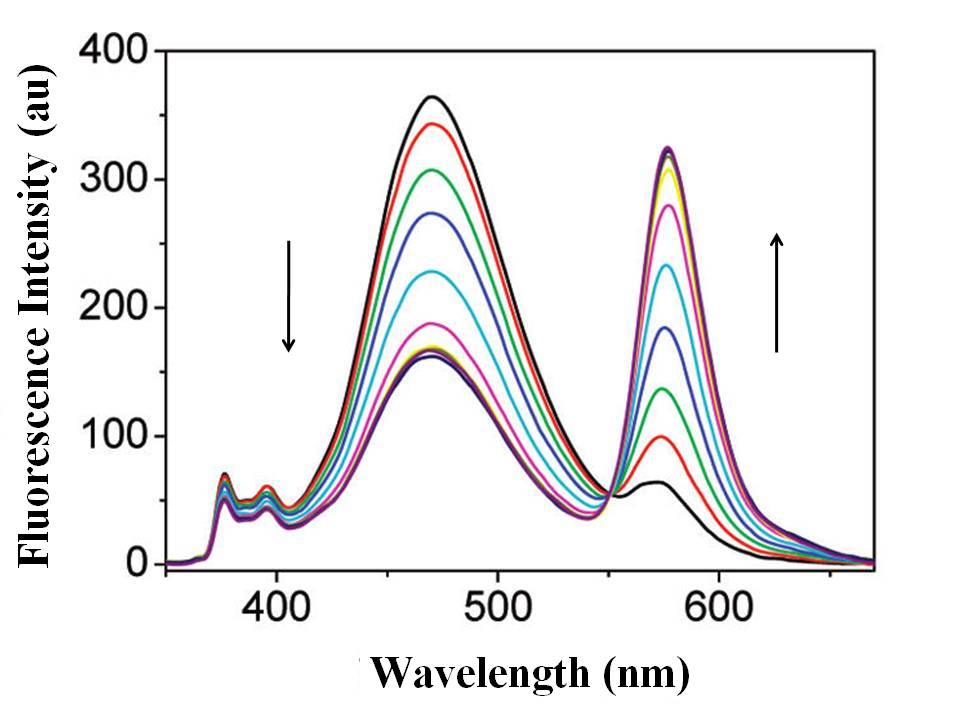
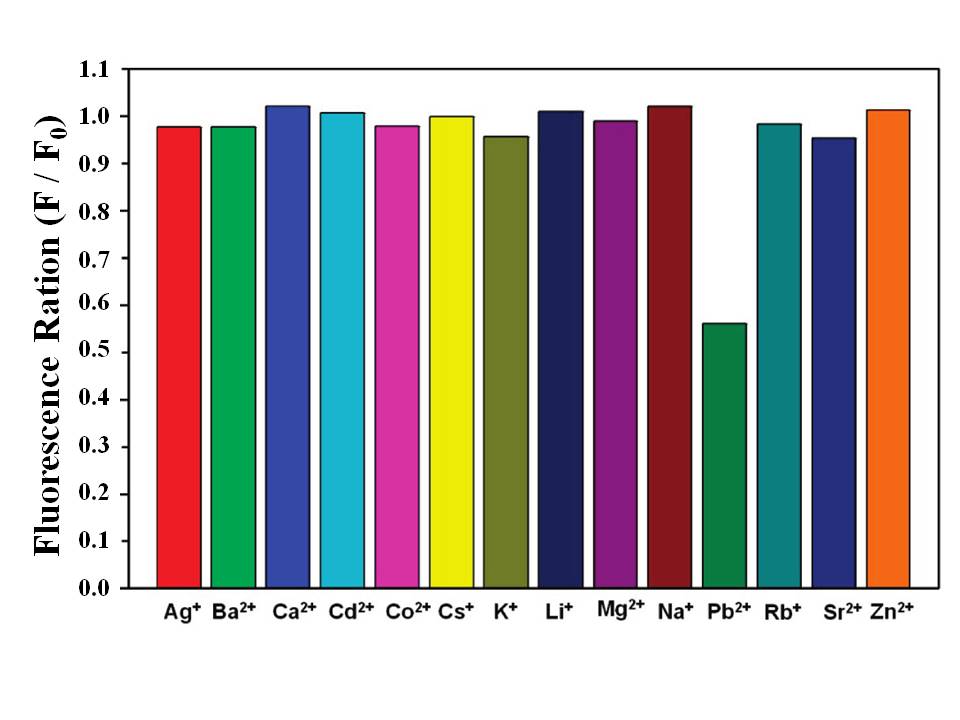
El derivado de areno calix [4] que porta dos fluoróforos de pireno y rodamina (RCP) (Figura\(\PageIndex{15}\)) es un sensor de fluorescencia FRET característico. El experimento de titulación de fluorescencia de RCP (10.0 μM) con iones Hg 2+ se realizó en CHCl 3 /CH 3 CN (50:50, v/v) con una excitación de 343 nm. Como se muestra en la Figura\(\PageIndex{16}\), al aumentar gradualmente la concentración de iones Hg 2+ en la solución de RCP, se observó el aumento de la emisión de fluorescencia de la rodamina de anillo abierto a 576 nm con una disminución concomitante de la emisión excímera de pireno a 470 nm. Además, apareció un punto isosbéstico centrado a 550 nm. Este cambio en la emisión de fluorescencia demostró que una energía del excímero de pireno se transfirió a la rodamina, resultante del desencadenante de iones Hg 2+. La figura\(\PageIndex{17}\) mostró que la RCP tuvo buena resistencia a otros cationes de interés cuando se detectaron iones Hg 2+, aunque los iones Pb 2+ tuvieron poca interferencia en este proceso.