9.1: Descripción general de la Titrimetría
- Page ID
- 75384
En la titrimetría agregamos un reactivo, llamado el valorante, a una solución que contiene otro reactivo, llamado el titrand, y permitimos que reaccionen. El tipo de reacción nos proporciona una manera sencilla de dividir la titulación en cuatro categorías: titulaciones ácido-base, en las que un valorante ácido o básico reacciona con una titulación que es una base o un ácido; titulaciones complejométricas, que se basan en la complejación metal-ligando; titulaciones redox, en las que el valorante es un agente oxidante o reductor; y titulaciones de precipitación, en las que el valorador y el valorante forman un precipitado.
Evitaremos deliberadamente el término analito en este punto de nuestra introducción a la titrimetría. Aunque en la mayoría de las titulaciones el analito es el valor, hay circunstancias en las que el analito es el valorante. Posteriormente, cuando discutamos métodos específicos de titulación, utilizaremos el término analito en su caso.
A pesar de su diferencia en química, todas las titulaciones comparten varias características comunes. Antes de considerar los métodos titrimétricos individuales con mayor detalle, tomemos un momento para considerar algunas de estas similitudes. A medida que trabajas en este capítulo, este resumen te ayudará a enfocarte en las similitudes entre los diferentes métodos de titulación. Te resultará más fácil entender un nuevo método analítico cuando puedas ver su relación con otros métodos similares.
Puntos de Equivalencia y Puntos Finales
Si una valoración es para dar un resultado exacto debemos combinar el valor y el valorante en cantidades estequiométricamente equivalentes. Llamamos a esta mezcla estequiométrica el punto de equivalencia. A diferencia de la gravimetría de precipitación, donde agregamos el precipitante en exceso, una titulación precisa requiere que sepamos el volumen exacto de valorante en el punto de equivalencia, V eq. El producto del volumen del punto de equivalencia del valorante y su molaridad, M T, es igual a los moles de valorante que reaccionan con la titrand.
\[\text { moles titrant }=M_{T} \times V_{e q} \nonumber\]
Si conocemos la estequiometría de la reacción de titulación, entonces podemos calcular los moles de titrand.
Desafortunadamente, para la mayoría de las reacciones de valoración no hay ningún signo obvio cuando alcanzamos el punto de equivalencia. En cambio, dejamos de agregar el valorante en un punto final de nuestra elección. A menudo este punto final es un cambio en el color de una sustancia, llamada indicador, que agregamos a la solución del titrand. La diferencia entre el volumen del punto final y el volumen del punto de equivalencia es un error de titulación determinado. Si el punto final y los volúmenes del punto de equivalencia coinciden estrechamente, entonces este error es insignificante y se ignora con seguridad. Claramente, seleccionar un punto final apropiado es de importancia crítica.
Volumen como señal
En lugar de medir el volumen del valorante, podemos elegir medir su masa. Aunque generalmente podemos medir la masa con mayor precisión que podemos medir el volumen, la simplicidad de una titulación volumétrica la convierte en la opción más popular.
Casi cualquier reacción química puede servir como método titrimétrico siempre que cumpla con las siguientes cuatro condiciones. La primera condición es que debemos conocer la estequiometría entre el valorante y el titrand. Si este no es el caso, entonces no podemos convertir los moles de titulante utilizados para llegar al punto final a los moles de titrand en nuestra muestra. En segundo lugar, la reacción de titulación efectivamente debe proceder a su finalización; es decir, la mezcla estequiométrica del valorante y el valorador debe dar como resultado su reacción completa. Tercero, la reacción de titulación debe ocurrir rápidamente. Si agregamos el valorante más rápido de lo que puede reaccionar con el titrand, entonces el punto final y el punto de equivalencia diferirán significativamente. Finalmente, debemos contar con un método adecuado para determinar con precisión el punto final. Estas son limitaciones significativas y, por esta razón, existen varias estrategias comunes de titulación.
Dependiendo de cómo estemos detectando el punto final, podemos detener la titulación demasiado pronto o demasiado tarde. Si el punto final es una función de la concentración del valorante, entonces agregar el valorante demasiado rápido conduce a un punto final temprano. Por otro lado, si el punto final es una función de la concentración de la titrand, entonces el punto final excede el punto de equivalencia.
Un ejemplo simple de una titulación es un análisis para Ag + usando tiocianato, SCN —, como valorante.
\[\mathrm{Ag}^{+}(a q)+\mathrm{SCN}^{-}(a q)\rightleftharpoons\mathrm{Ag}(\mathrm{SCN})(s) \nonumber\]
Esta reacción ocurre rápidamente y con una estequiometría conocida, que satisface dos de nuestros requisitos. Para indicar el punto final de la titulación, agregamos una pequeña cantidad de Fe 3 + a la solución del analito antes de comenzar la titulación. Cuando la reacción entre Ag + y SCN — es completa, la formación del complejo Fe (SCN) 2+ de color rojo señala el punto final. Este es un ejemplo de valoración directa ya que el valorante reacciona directamente con el analito.
Este es un ejemplo de valoración por precipitación. Encontrará más información sobre las titulaciones de precipitación más adelante en este capítulo.
Si la reacción de la titulación es demasiado lenta, si no se dispone de un indicador adecuado, o si no hay una reacción de titulación directa útil, entonces puede ser posible un análisis indirecto. Supongamos que desea determinar la concentración de formaldehído, H 2 CO, en una solución acuosa. La oxidación de H 2 CO por\(\text{I}_3^-\)
\[\mathrm{H}_{2} \mathrm{CO}(a q)+\mathrm{I}_{3}^-(a q)+3 \mathrm{OH}^{-}(a q)\rightleftharpoons\mathrm{HCO}_{2}^{-}(a q)+3 \mathrm{I}^{-}(a q)+2 \mathrm{H}_{2} \mathrm{O}(1) \nonumber\]
es una reacción útil, pero es demasiado lenta para una valoración. Si añadimos un exceso conocido de\(\text{I}_3^-\) y permitimos que su reacción con H 2 CO vaya a su finalización, podemos valorar el que no haya reaccionado\(\text{I}_3^-\) con tiosulfato,\(\text{S}_2\text{O}_3^{2-}\).
\[\mathrm{I}_{3}^{-}(a q)+2 \mathrm{S}_{2} \mathrm{O}_{3}^{2-}(a q)\rightleftharpoons\mathrm{S}_{4} \mathrm{O}_{6}^{2-}(a q)+3 \mathrm{I}^{-}(a q) \nonumber\]
La diferencia entre la cantidad inicial de\(\text{I}_3^-\) y la cantidad en exceso nos da la cantidad de\(\text{I}_3^-\) que reacciona con el formaldehído. Este es un ejemplo de una valoración posterior.
Este es un ejemplo de una valoración redox. Encontrará más información sobre las titulaciones redox más adelante en este capítulo.
Los iones de calcio juegan un papel importante en muchos sistemas ambientales. Un análisis directo para Ca 2 + podría aprovechar su reacción con el ligando ácido etilendiaminotetraacético (EDTA), que representamos aquí como Y 4—.
\[\mathrm{Ca}^{2+}(a q)+\mathrm{Y}^{4-}(a q)\rightleftharpoons\mathrm{CaY}^{2-}(a q) \nonumber\]
Desafortunadamente, para la mayoría de las muestras esta titulación no tiene un indicador útil. En cambio, reaccionamos el Ca 2 + con un exceso de MgY 2—
\[\mathrm{Ca}^{2+}(a q)+\mathrm{MgY}^{2-}(a q)\rightleftharpoons\mathrm{Ca} \mathrm{Y}^{2-}(a q)+\mathrm{Mg}^{2+}(a q) \nonumber\]
liberando una cantidad de Mg 2 + equivalente a la cantidad de Ca 2+ en la muestra. Porque la titulación de Mg 2 + con EDTA
\[\mathrm{Mg}^{2+}(a q)+\mathrm{Y}^{4-}(a q)\rightleftharpoons\mathrm{MgY}^{2-}(a q) \nonumber\]
tiene un punto final adecuado, podemos completar el análisis. La cantidad de EDTA utilizada en la titulación proporciona una medida indirecta de la cantidad de Ca 2 + en la muestra original. Debido a que la especie que estamos valorando fue desplazada por el analito, llamamos a esto una valoración por desplazamiento.
MgY 2— es el complejo Mg 2 + —EDTA metal—ligando. Se puede preparar una solución de MgY 2— combinando soluciones equimolares de Mg 2 + y EDTA. Este es un ejemplo de una titulación de complejación. Encontrará más información sobre las titulaciones de complejación más adelante en este capítulo.
Si no existe una reacción adecuada con el analito puede ser posible generar una especie que podamos valorar. Por ejemplo, podemos determinar el contenido de azufre del carbón usando una reacción de combustión para convertir azufre en dióxido de azufre
\[\mathrm{S}(s)+\mathrm{O}_{2}(g) \rightarrow \mathrm{SO}_{2}(g) \nonumber\]
y luego convertir el SO 2 en ácido sulfúrico, H 2 SO 4, burbujeándolo a través de una solución acuosa de peróxido de hidrógeno, H 2 O 2.
\[\mathrm{SO}_{2}(g)+\mathrm{H}_{2} \mathrm{O}_{2}(a q) \longrightarrow \mathrm{H}_{2} \mathrm{SO}_{4}(a q) \nonumber\]
Titulación de H 2 SO 4 con NaOH
\[\mathrm{H}_{2} \mathrm{SO}_{4}(a q)+2 \mathrm{NaOH}(a q)\rightleftharpoons2 \mathrm{H}_{2} \mathrm{O}(l )+\mathrm{Na}_{2} \mathrm{SO}_{4}(a q) \nonumber\]
proporciona una determinación indirecta de azufre.
Este es un ejemplo de valoración ácido-base. Encontrará más información sobre las titulaciones ácido-base más adelante en este capítulo.
Curvas de valoración
Para encontrar el punto final de una titulación, necesitamos monitorear alguna propiedad de la reacción que tenga un valor bien definido en el punto de equivalencia. Por ejemplo, el punto de equivalencia para una titulación de HCl con NaOH ocurre a un pH de 7.0. Un método sencillo para encontrar el punto de equivalencia es monitorear el pH de la mezcla de titulación usando un electrodo de pH, deteniendo la titulación cuando alcanzamos un pH de 7.0. Alternativamente, podemos agregar un indicador a la solución del titrand que cambie de color a un pH de 7.0.
Por qué un pH de 7.0 es el punto de equivalencia para esta titulación es un tema que cubriremos más adelante en la sección sobre titulaciones ácido-base.
Supongamos que el único indicador disponible cambia de color a un pH de 6.8. ¿Es la diferencia entre este punto final y el punto de equivalencia lo suficientemente pequeña como para que podamos ignorar con seguridad el error de titulación? Para responder a esta pregunta necesitamos saber cómo cambia el pH durante la titulación.
Una curva de titulación proporciona una imagen visual de cómo cambia una propiedad de la reacción de titulación a medida que agregamos el valorante a la titrand. La curva de titulación en la Figura 9.1.1 , por ejemplo, se obtuvo suspendiendo un electrodo de pH en una solución de HCl 0.100 M (el titrand) y monitoreando el pH mientras se agregó NaOH 0.100 M (el valorante). Un examen minucioso de esta curva de titulación debería convencerle de que un pH de punto final de 6.8 produce un error de titulación insignificante. Sin embargo, seleccionar un pH de 11.6 como punto final produce un error de titulación inaceptablemente grande.
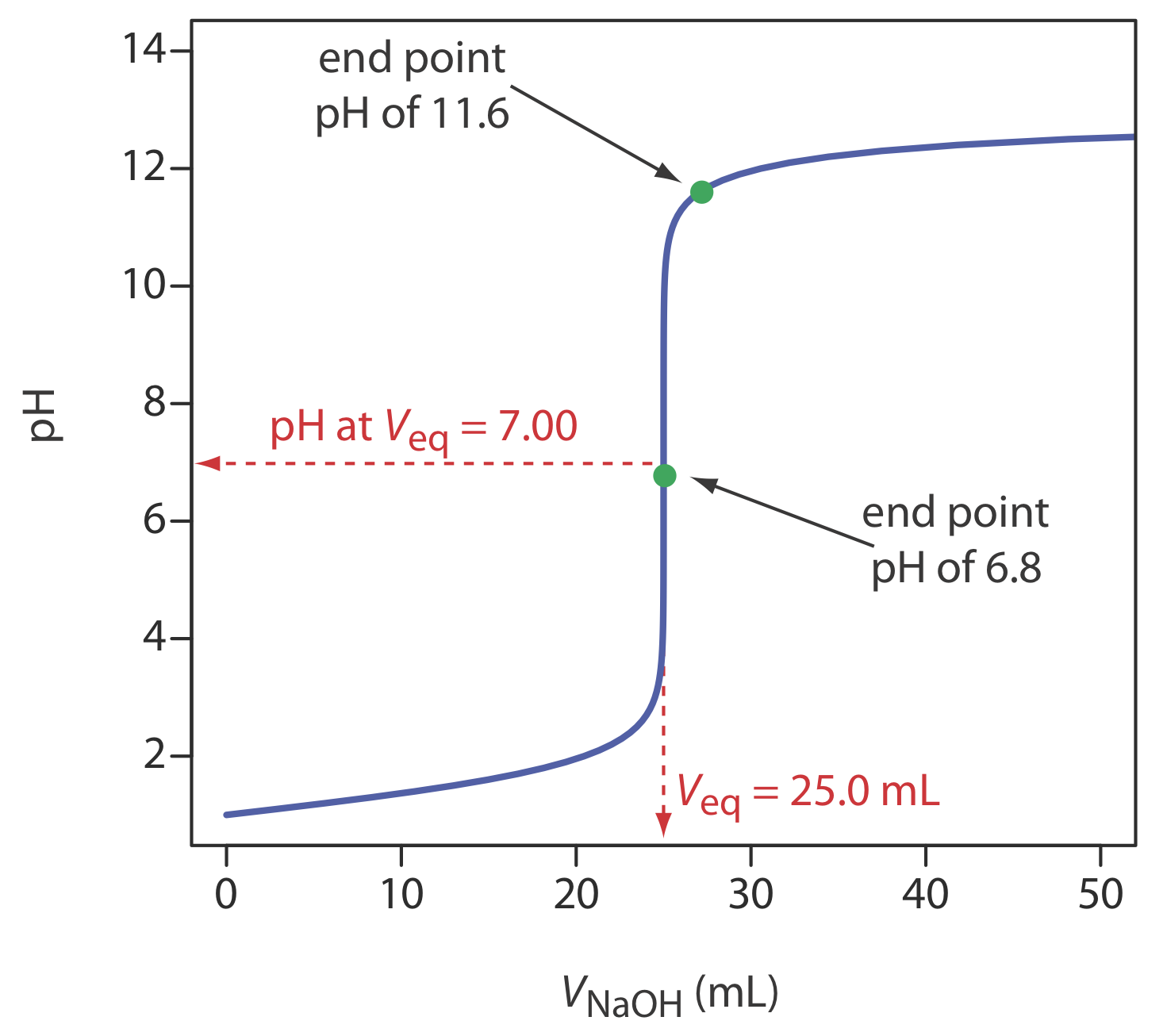
Para la curva de titulación en la Figura 9.1.1 , el volumen de valorante para alcanzar un pH de 6.8 es 24.99995 mL, un error de titulación de\(-2.00 \times 10^{-4}\)% relativo al punto de equivalencia de 25.00 mL. Por lo general, podemos leer el volumen solo a los ±0.01 mL más cercanos, lo que significa que esta incertidumbre es demasiado pequeña para afectar nuestros resultados. El volumen de valorante para alcanzar un pH de 11.6 es 27.07 mL, o un error de titulación de +8.28%. Este es un error significativo.
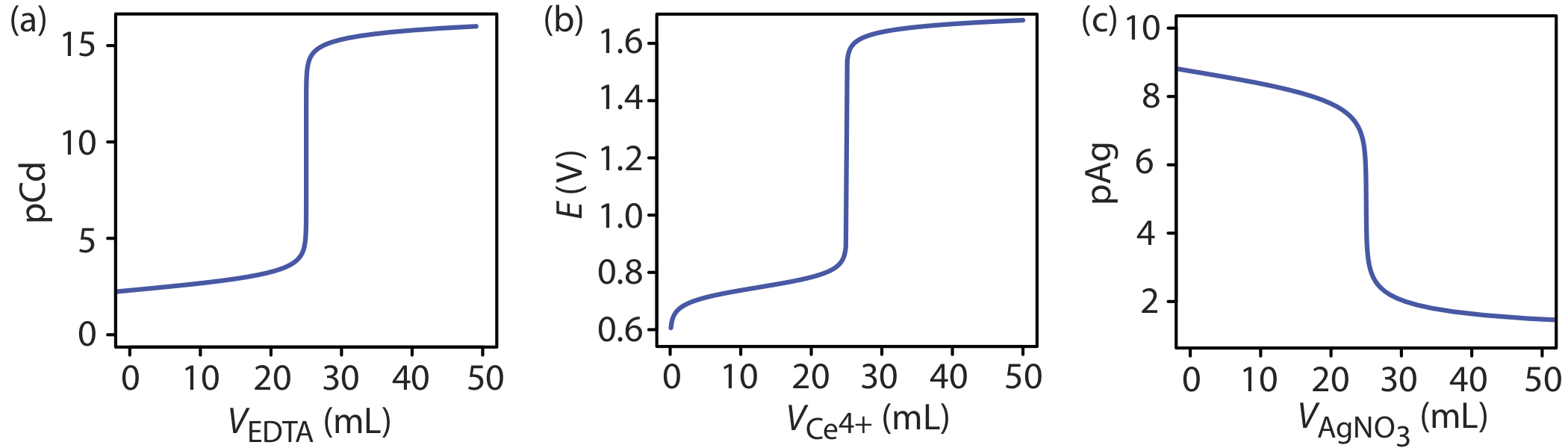
La forma de la curva de valoración en la Figura 9.1.1 no es exclusiva de una valoración ácido-base. Cualquier curva de titulación que siga el cambio en la concentración de una especie en la reacción de titulación (trazada logarítmicamente) en función del volumen del valorante tiene la misma forma sigmoidal general. Varios ejemplos adicionales se muestran en la Figura 9.1.2 .
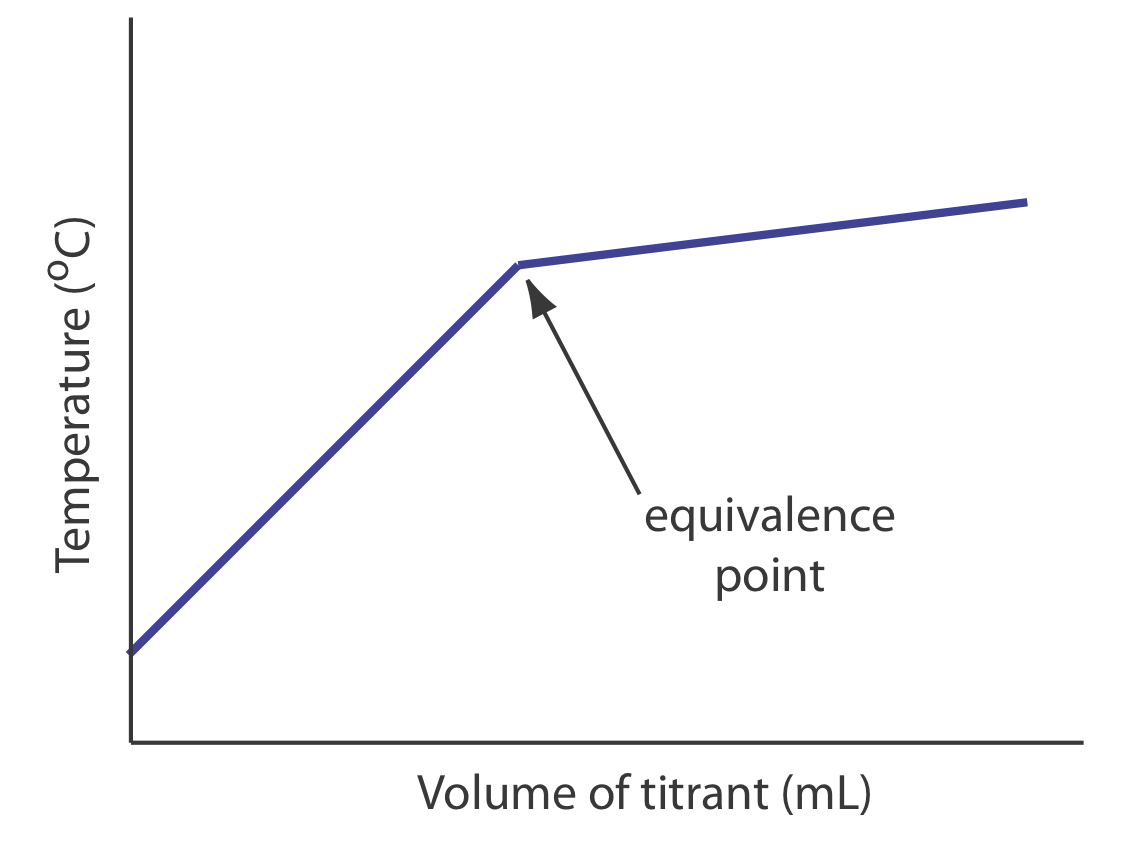
La concentración del valorador o del valorante no es la única propiedad que podemos usar para registrar una curva de titulación. Otros parámetros, tales como la temperatura o absorbancia de la solución del campo de valoración, pueden proporcionar una señal útil de punto final. Muchas reacciones de titulación ácido-base, por ejemplo, son exotérmicas. A medida que el valorante y el grupo de valoración reaccionan, la temperatura de la solución de la titrand aumenta. Una vez que alcanzamos el punto de equivalencia, las adiciones adicionales de titulante no producen como respuesta exotérmica. La figura 9.1.3 muestra una curva de titulación termométrica típica donde la intersección de los dos segmentos lineales indica el punto de equivalencia.
La Buret
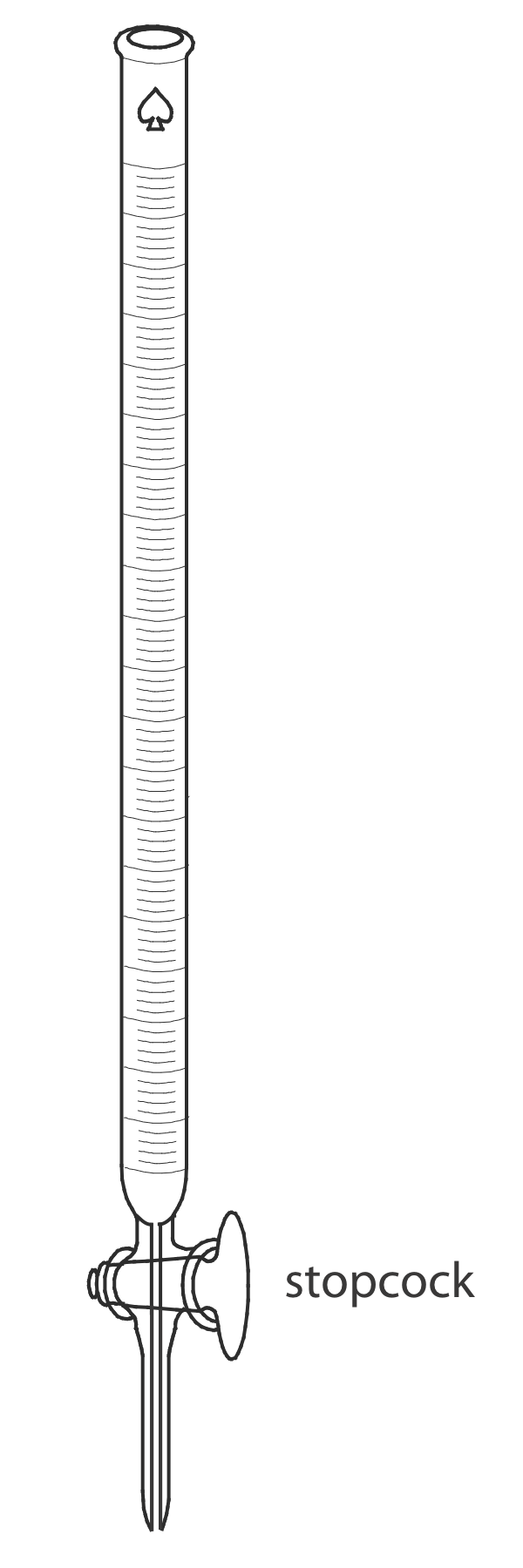
El único equipo esencial para una titulación ácido-base es un medio para entregar el valorante a la solución de la titrand. El método más común para entregar el valorante es una bureta (Figura 9.1.4 ), que es un tubo largo y estrecho con marcas graduadas y equipado con una llave de paso para dispensar el valorante. El pequeño diámetro interno de la bureta proporciona un menisco mejor definido, lo que facilita la lectura precisa del volumen del titulante. Las oficinas están disponibles en una variedad de tamaños y tolerancias (Tabla 9.1.1 ), con la elección de la bureta determinada por las necesidades del análisis. Se puede mejorar la precisión de una bureta calibrándola en varios rangos intermedios de volúmenes utilizando el método descrito en el Capítulo 5 para calibrar pipetas. Calibrar una bureta corrige las variaciones en el diámetro interno de la bureta.
Una valoración automatizada utiliza una bomba para entregar el valorante a un caudal constante (Figura 9.1.5 ). Las valoraciones automatizadas ofrecen la ventaja adicional de usar una microcomputadora para el almacenamiento y análisis de datos.



