13.1: Técnicas cinéticas versus técnicas de equilibrio
- Page ID
- 75334
En un método de equilibrio, la señal analítica se determina mediante una reacción de equilibrio que involucra al analito o por un proceso de estado estacionario que mantiene la concentración del analito. Cuando determinamos la concentración de hierro en el agua midiendo la absorbancia del\(\text{Fe(phen)}_3^{2+}\) complejo naranja-rojo, la señal depende de la concentración de\(\text{Fe(phen)}_3^{2+}\), la cual, a su vez, está determinada por la constante de formación del complejo. En la determinación de absorción atómica de la llama de Cu y Zn en muestras de tejido, la concentración de cada metal en la llama permanece constante debido a que cada paso en el proceso de atomización de la muestra se encuentra en estado estacionario. En un método cinético la señal analítica está determinada por la velocidad de una reacción que involucra al analito o por un proceso en estado no estacionario. Como resultado, la concentración del analito cambia durante el tiempo en que monitoreamos la señal.
En muchos casos podemos optar por completar un análisis usando un método de equilibrio o un método cinético cambiando cuando medimos la señal analítica. Por ejemplo, un método para determinar la concentración de nitrito\(\text{NO}_2^-\), en aguas subterráneas utiliza la re-acción de diazotación en dos etapas que se muestra en la Figura 13.1.1 [Método 4500-NO 2 — B en Métodos Estándar para el Análisis de Aguas y Aguas Residuales, Asociación Americana de Salud Pública: Washington, DC, 20th Ed., 1998]. El producto final, que es un tinte azo de color púrpura rojizo, absorbe la luz visible a una longitud de onda de 543 nm. Debido a que ninguna reacción en la Figura 13.1.1 es rápida, la absorbancia—que es directamente proporcional a la concentración de nitrito—se mide 10 min después de agregar el último reactivo, un lapso de tiempo que asegura que la concentración de los colorantes azoicos alcance el valor de estado estacionario requerido de un método de equilibrio.
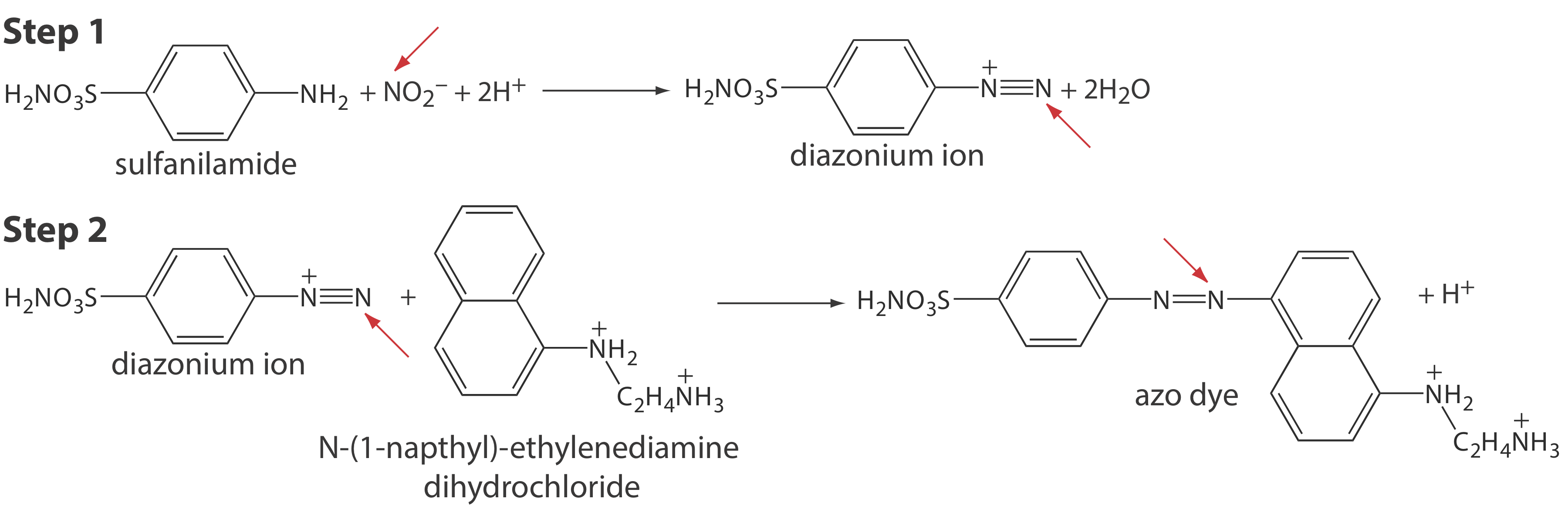
Podemos usar el mismo conjunto de reacciones como base para un método cinético si medimos la absorbancia de la solución durante este periodo de desarrollo de 10 min, obteniendo información sobre la velocidad de la reacción. Si la tasa medida es función de la concentración de\(\text{NO}_2^-\), entonces podemos usar la tasa para determinar su concentración en la muestra [Karayannis, M. I.; Piperaki, E. A.; Maniadaki, M. M. Anal. Lett. 1986, 19, 13—23].
Hay muchas ventajas potenciales para un método cinético de análisis, quizás la más importante de las cuales es la capacidad de utilizar reacciones químicas y sistemas que son lentos para alcanzar el equilibrio. En este capítulo examinamos tres técnicas que se basan en mediciones realizadas mientras el sistema analítico está bajo control cinético: técnicas cinéticas químicas, en las que medimos la velocidad de una reacción química; técnicas radioquímicas, en las que medimos la desintegración de un elemento radiactivo; e inyección de flujo , en el que inyectamos el analito en una corriente portadora de flujo continuo, donde se mezcla y reacciona con reactivos en la corriente bajo condiciones controladas por los procesos cinéticos de convección y difusión.


