20: Plegado de Proteína
( \newcommand{\kernel}{\mathrm{null}\,}\)
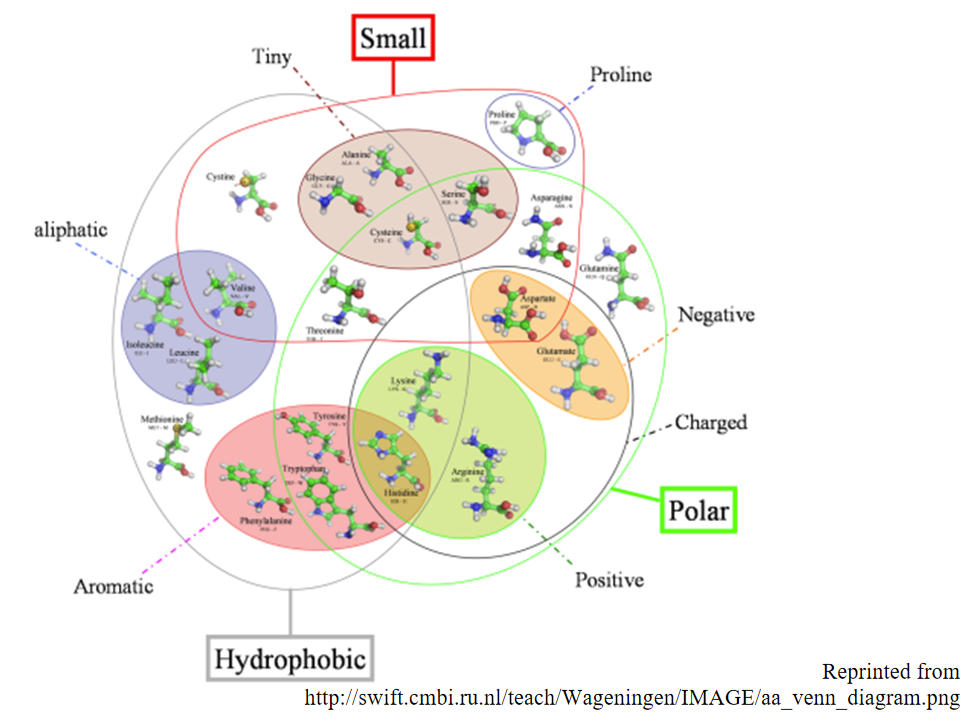
- Compuesto por 50—500 aminoácidos unidos en la secuencia 1D por la cadena principal polipeptídica
- Las propiedades físicas y químicas de los 20 aminoácidos dictan una estructura 3D intrincada y funcional.
- La estructura plegada es un estado básico energético (Anfinsen)
Muchas proteínas se replegan espontáneamente en forma nativa in vitro con alta fidelidad y alta velocidad.
Diferentes enfoques para estudiar este fenómeno:
- ¿Cómo la secuencia primaria codificará la estructura 3D?
- ¿Se puede predecir el pliegue 3D a partir de una secuencia primaria?
- Diseñar una cadena polipeptídica que se pliegue en una estructura conocida.
- ¿Cuál es el mecanismo por el cual una cadena desordenada adopta rápidamente su estructura nativa?
Nuestro énfasis aquí es mecanicista. ¿Qué impulsa este proceso? Las propiedades físicas de las cadenas colgantes conectadas que interactúan cooperativamente dan lugar a la estructura.
Se dice que la secuencia primaria dicta la estructura tridimensional, pero esta no es toda la historia, y enfatiza una cierta perspectiva. Ciertamente necesitamos agua, y condiciones termodinámicas definidas en temperatura, pH y fuerza iónica. En cierto sentido la proteína es el entramado y el solvente es el pegamento. Las proteínas plegadas pueden no estar tan estructuradas a partir de estructuras cristalinas, como se hace creer a uno.
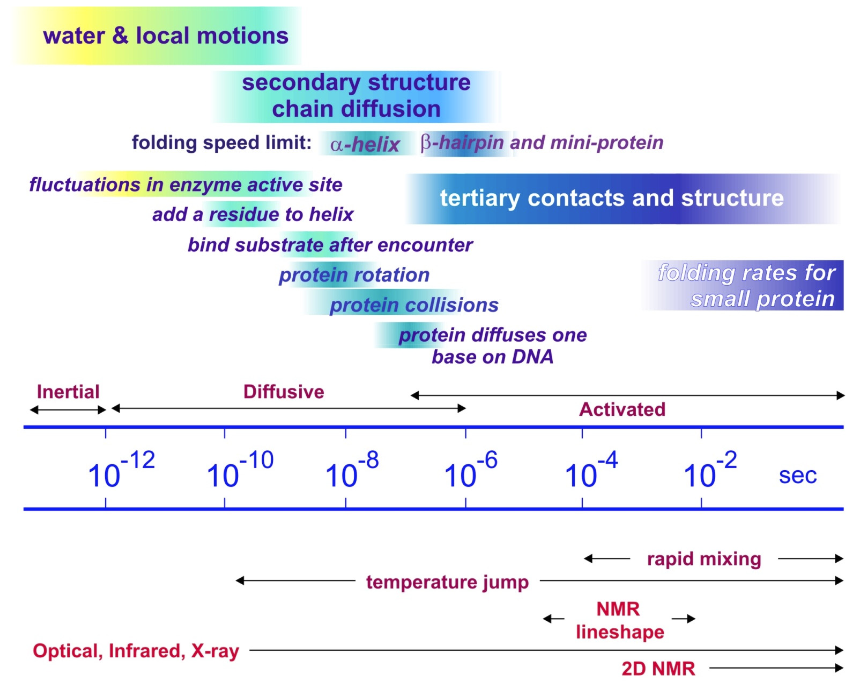
Cinética y Dinámica
Las escalas de tiempo de plegado de proteínas observadas abarcan décadas. Las observaciones para el plegamiento de proteínas típicamente se miden en ms, segundos y minutos. Esta es la escala de tiempo para el plegado activado a través de una barrera de energía libre. La escala de tiempo intrínseca para los procesos difusivos subyacentes que permiten evolucionar conformaciones y formar contactos locales a través de la libre difusión es ps a μs. El plegado de la estructura secundaria pequeña ocurre en 0.1—1 μs para hélices y ~1—10 μs para horquillas. Las miniproteínas de plegamiento más rápido (20—30 residuos) son ~1 μs.
Cooperatividad
¿Qué impulsa esto? Algunos indicios:
Paradoja de Levinthal 1
La configuración plegada no se puede encontrar a través de un proceso de búsqueda puramente aleatorio.
- Supongamos: enlace o3 estados/aminoácidos o100 enlaces
- 3100 = 5 x 1047 estados oMuestra 10-13seg/estado
- 1027 años para muestrear
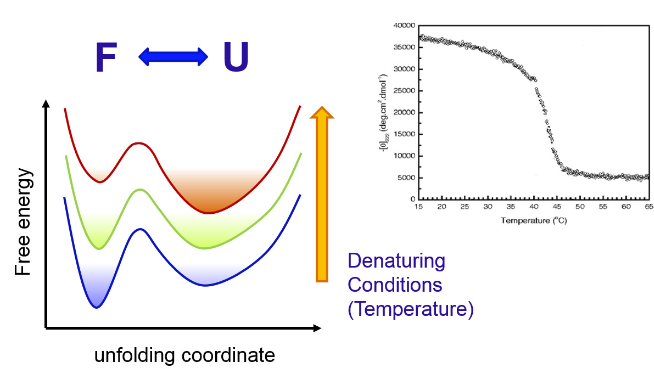
Termodinámica de dos estados
A todas las apariencias, el sistema (a menudo) se comporta como si solo hubiera dos estados termodinámicos.
Entropia/entalpía
ΔG es un delicado equilibrio de dos grandes contribuciones de energía opuestas ΔH y TΔS.
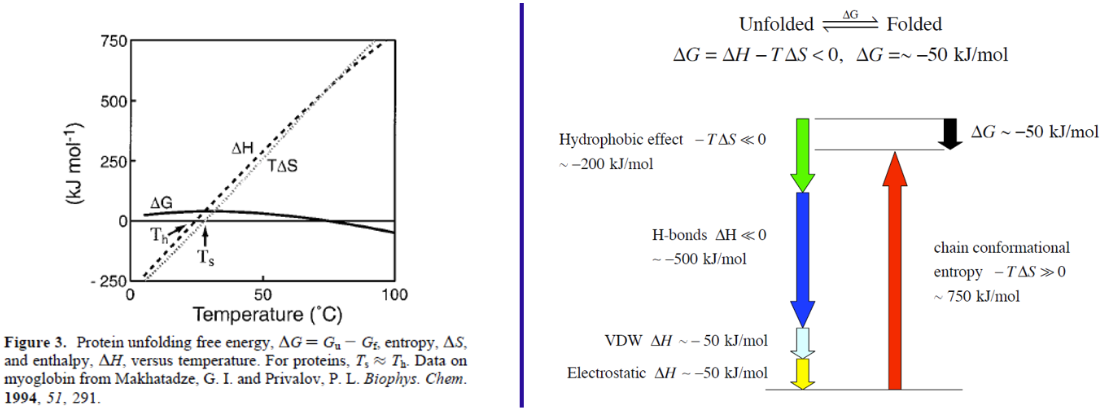
| Reimpreso con permiso de N. T. Southall, K. A. Dill y A. D. J. Haymet, J. Phys. Chem. B 106, 521-533 (2002). Derechos de autor 2002 Sociedad Americana de Química. | Reimpreso de James Chou (2008). http://cmcd.hms.harvard.edu/activiti...1/lecture7.pdf. |
La cooperatividad subyace a estas observaciones
La probabilidad de formar un contacto es mayor si se forma otro contacto.
- Cremallera
- Colapso hidrófobo
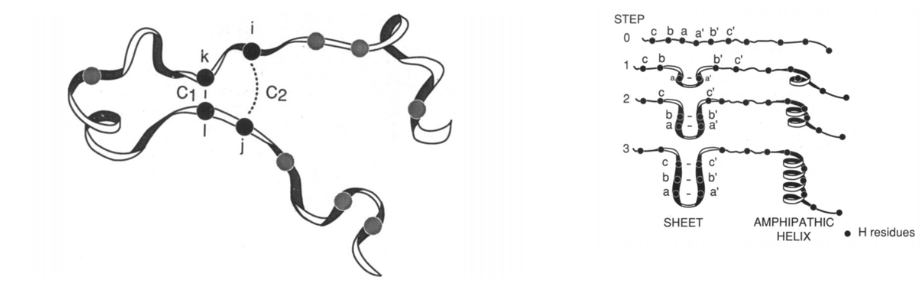
Reimpreso de K. A. Dill, K. M. Fiebig y H. S. Chan, Proc. Natl. Acad. Sci. U. S. A. 90,1942-1946 (1993). Derechos de autor 1993 PNAS.
Proteína Plegable Conceptual Imágenes
Cuadros tradicionales arraigados en la termodinámica clásica y la cinética de reacción.
- Postular secuencia particular de eventos.
- Centrarse en la importancia de un cierto efecto físico.
- Marco o cremallera cinética
- Colapso hidrófobo
- Nucleación—Condensación
Modelo de marco/cremallera cinética
- Observación a partir de péptidos: las estructuras secundarias se pliegan rápidamente tras la nucleación.
- La formación de estructuras secundarias precede a la organización terciaria.
- Énfasis:
- Jerarquía y vía
- Enfoque en la columna vertebral, estructura secundaria
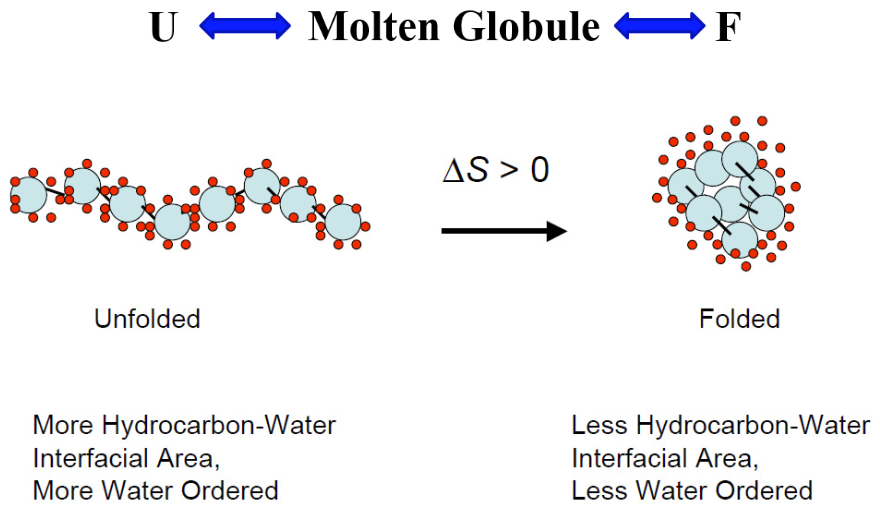
Colapso hidrófobo
- Observación: la estructura proteica tiene residuos hidrófobos enterrados en el centro y grupos hidrófilos cerca de la superficie
- Una cadena extendida colapsa rápidamente para enterrar grupos hidrófobos y, por lo tanto, acelera la búsqueda de contactos nativos.
- Estado colapsado: glóbulo fundido
- La estructura secundaria y terciaria se forman juntas tras el colapso.
Nucleación—Condensación
La nucleación de contactos nativos terciarios es un primer paso importante, y la estructura se condensa alrededor de eso.
Algunas observaciones hasta el momento:
- Importancia de las coordenadas colectivas
- Gran reto: No sabemos mucho sobre el estado desplegado.
______________________________________________________
- C. Levinthal, ¿Existen vías para el plegamiento proteico? , J. Chim. Phys. Phys. -Chim. Biol. 65, 44-45 (1968).
- 20.1: Modelos para Simulación de Plegado
- Nuestro estudio del mecanismo de plegado y la relación mecánica estadística entre estructura y estabilidad se han guiado por modelos. De estos, los modelos reduccionistas simples guiaron el desarrollo conceptual desde el lado de la mecánica estadística, ya que las simulaciones de átomos completos fueron inicialmente intratables. Nos centraremos en los modelos simples.

