8.3: Niveles de Energía Orbital, Reglas de Selección y Espectroscopia
- Page ID
- 71286
Los valores propios de energía orbital obtenidos al resolver la ecuación de Schrödinger del átomo de hidrógeno están dados por
\[E_n = -\dfrac {\mu e^4}{8 \epsilon ^2_0 h^2 n^2} \label {8.3.1}\]
donde\(\mu\) está la masa reducida del protón y del electrón,\(n\) es el número cuántico principal y e,\(\epsilon _0\) y h son las constantes fundamentales habituales. La energía es negativa y se acerca a cero a medida que el número cuántico n se acerca al infinito. Debido a que el átomo de hidrógeno se utiliza como base para los sistemas de múltiples electrones, es útil recordar la energía total (energía de unión) del átomo de hidrógeno del estado fundamental,\(E_H = -13.6\; eV\). El espaciamiento entre los niveles de energía electrónica para valores pequeños de\(n\) es muy grande mientras que el espaciamiento entre los niveles de energía más altos se hace más pequeño muy rápidamente. Este espaciado de nivel de energía es resultado de la forma del potencial de Coulomb, y se puede entender en términos de la partícula en un modelo de caja. Vimos que a medida que la caja de potencial se ensancha, el espaciamiento del nivel de energía se hace menor De manera similar en el átomo de hidrógeno a medida que aumenta la energía, el pozo de Coulomb se ensancha y el espaciamiento del nivel de energía se hace
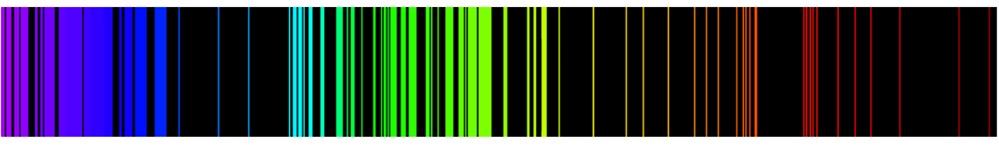
Los espectros lineales producidos por los átomos de hidrógeno son consecuencia de la expresión del nivel de energía mecánica cuántica, Ecuación\ ref {8.3.1}. En el Capítulo 1 vimos la excelente coincidencia entre las líneas espectrales experimentales y calculadas para el átomo de hidrógeno usando la expresión de Bohr para la energía, que es idéntica a la Ecuación\(\ref{8.3.1}\).
Ejercicio\(\PageIndex{1}\)
Usando Ecuación\(\ref{8.3.1}\) y un programa de hoja de cálculo u otro software de su elección, calcule las energías para los 100 niveles de energía más bajos del átomo de hidrógeno. También se calculan las diferencias de energía entre niveles sucesivos. ¿Los resultados de estos cálculos confirman que los niveles de energía se acercan rápidamente a medida que\(n\) aumenta el número cuántico principal? ¿Qué sucede con el espaciamiento del nivel de energía cuando el número cuántico principal se acerca al infinito?
La solución de la ecuación de Schrödinger para el átomo de hidrógeno predice que los niveles de energía con\(n > 1\) pueden tener varios orbitales con la misma energía. De hecho, a medida que aumentan la energía y n, también aumenta la degeneración del nivel de energía orbital. El número de orbitales con una energía particular y valor para\(n\) viene dado por\(n_2\). Por lo tanto, se predice que cada nivel de energía orbital sea\(n_2\) -degenerado. Este alto grado de degeneración orbital se predice solo para sistemas de un electrón. Para los átomos de múltiples electrones, la repulsión electrón-electrón elimina la\(l\) degeneración por lo que solo los orbitales con los mismos números\(m_l\) cuánticos son degenerados.
Ejercicio\(\PageIndex{2}\)
Usa Ecuación o los datos que generaste en Ejercicio\(\ref{8.3.1}\) para dibujar un diagrama de niveles de energía a escala para el átomo de hidrógeno mostrando los tres primeros niveles de energía y su degeneración. Indica en tu diagrama la transición que conduce a la ionización del átomo de hidrógeno y el valor numérico de la energía requerida para la ionización, en eV, unidades atómicas y kJ/mol.
Para entender el espectro de átomos de hidrógeno, también necesitamos determinar qué transiciones están permitidas y qué transiciones están prohibidas. Este tema se aborda a continuación mediante el uso de reglas de selección que se obtienen a partir del momento de transición integral. En capítulos anteriores determinamos reglas de selección para la partícula en una caja, el oscilador armónico y el rotor rígido. Ahora vamos a aplicar esos mismos principios al caso del átomo de hidrógeno iniciando con el momento de transición integral.
La integral del momento de transición para una transición entre un estado inicial (\(i\)) y un estado final (\(f\)) de un átomo de hidrógeno viene dada por
\[ \left \langle \mu _T \right \rangle = \int \psi ^* _{n_f, l_f, m_{l_f}} (r, \theta , \psi ) \hat {\mu} \psi _{n_i, l_i, m_{l_i}} (r, \theta , \psi ) d \tau \label {8.3.2a}\]
o en notación bra ket
\[ \left \langle \mu _T \right \rangle = \langle \psi ^*_{n_f, l_f, m_{l_f}} | \hat {\mu} | \psi _{n_i, l_i, m_{l_i}} \rangle \label{8.3.2b}\]
donde el operador de momento dipolo es dado por
\[ \hat {\mu} = - e \hat {r} \label {8.3.3}\]
El operador de momento dipolo expresado en coordenadas esféricas es
\[ \hat {\mu} = -er (\bar {x} \sin \theta \cos \psi + \bar {y} \sin \theta \sin \psi + \bar {z} \cos \theta \label {8.3.4}\]
La suma de términos en el lado derecho de Ecuación\(\ref{8.3.4}\) muestra que hay tres componentes de\(\left \langle \mu _T \right \rangle\) a evaluar en Ecuación\(\ref{8.3.2a}\), donde cada componente consta de tres integrales: una\(r\) integral, una\(\theta \) integral y una\(\psi \) integral.
La evaluación revela que la\(r\) integral siempre difiere de cero por lo
\[ \Delta n = n_f - n_i = \text {not restricted} \label {8.3.5}\]
No hay restricción sobre el cambio en el número cuántico principal durante una transición espectroscópica;\(\Delta n\) puede ser cualquier cosa. Para absorción,\(\Delta n > 0 \), para emisión\(\Delta n < 0\), y\(\Delta n = 0 \) cuando la degeneración orbital es eliminada por un campo externo o alguna otra interacción.
Las reglas de selección para\(\Delta l \) y\(\Delta m_l\) provienen de las integrales del momento de transición que involucran\(\theta \) y\(\varphi\) en Ecuación\(\ref{8.3.2a}\). Estas integrales son las mismas que se evaluaron para las reglas de selección rotacional, y las reglas de selección resultantes son
\[ \Delta l = \pm 1\]
y
\[\Delta m_l = 0, \pm 1 \label {8.3.6}\]
Ejercicio\(\PageIndex{3}\)
Escriba las reglas de selección espectroscópica para el rotor rígido y para el átomo de hidrógeno. ¿Por qué son iguales estas reglas de selección?


