8.7: Orbitales de espín y configuraciones de electrones
- Page ID
- 71329
Las funciones de onda obtenidas al resolver la ecuación de Schrödinger del átomo de hidrógeno están asociadas con el movimiento angular orbital y a menudo se denominan funciones de onda espaciales, para diferenciarlas de las funciones de onda de espín. La función de onda completa para un electrón en un átomo de hidrógeno debe contener tanto los componentes espaciales como los de espín. Nos referimos al orbital completo de un electrón como un spin-orbital y una forma general para este orbital es
\[ | \varphi _{n,l,m_l , m_s} \rangle = | \psi _{n,l,m_l} (r, \theta , \psi ) \rangle | \sigma ^{m_s}_s \rangle \label {8.7.1}\]
Un spin-orbital para un electrón en el\(2p_z\) orbital con\(m_s = + \frac {1}{2} \), por ejemplo, podría escribirse como
\[ | \psi _{2pz_\alpha} \rangle = | \psi _{2,1,0} (r, \theta \psi) \ | \alpha \rangle \label{8.7.2}\]
Un método común de representar electrones en orbitales espín dispuestos por energía se muestra en la Figura\(\PageIndex{1}\), que da una representación de la configuración electrónica del estado fundamental del átomo de hidrógeno.
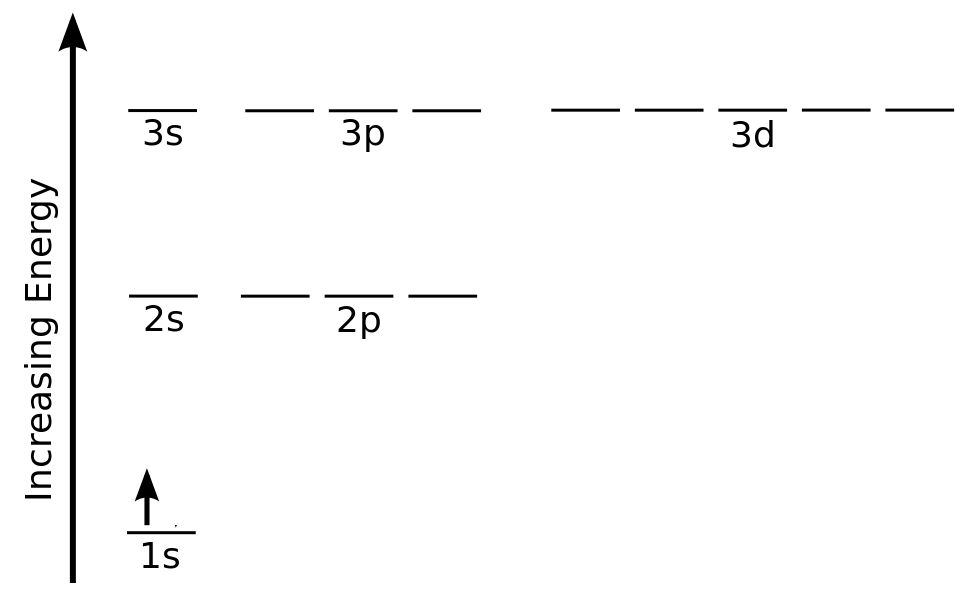
En el diagrama de nivel de energía de la Figura\(\PageIndex{1}\), las líneas horizontales etiquetadas 1s, 2s, 2p, etc. denotan las partes espaciales de los orbitales, y una flecha que apunta hacia arriba para giro\(\alpha\) y hacia abajo para giro\(\beta \) denota la parte de giro de la función de onda.
Una notación abreviada alternativa para la configuración electrónica es la forma familiar 1s 1 para denotar un electrón en el orbital 1s. Tenga en cuenta que esta versión abreviada contiene información solo sobre la función de onda espacial; la información sobre el giro está implícita. Dos electrones en el mismo orbital tienen espín\(\alpha\) y\(\beta \), por ejemplo, 1s 2, y se supone que un electrón en un orbital tiene espín\(\alpha\). Los átomos de hidrógeno pueden absorber energía y el electrón puede ser promovido a orbitales espín de mayor energía. Ejemplos de tales configuraciones de estado excitado son\(2p_1\)\(3d_1\), etc.


