9.9.9E: Afinidad de Electrones
- Page ID
- 71197
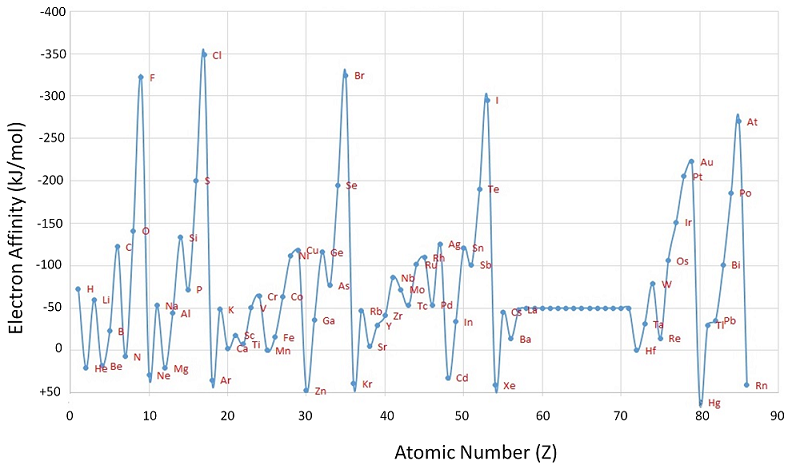
La inversa de la ionización, es decir, traer un electrón desde el infinito para ocupar la vacante de menor energía en un orbital atómico, produce un cambio de energía llamado afinidad electrónica.
\[ A + e^- \rightarrow A^- \label{9-69}\]
con
\[\Delta E = E_f - E_i = EA \label {9-70}\]
Las afinidades electrónicas negativas, es decir, que la reacción anterior es exotérmica, se encuentran para los átomos neutros que en realidad son más altos en energía que el anión correspondiente, como los halógenos. Las afinidades electrónicas de los elementos, al igual que sus potenciales de ionización, son importantes para comprender su reactividad química y sus características de unión. La afinidad electrónica de un átomo neutro es en realidad solo el negativo de una energía de ionización para un anión (es decir, la reacción inversa para la Ecuación\(\ref{9-69}\)).
\[A^- \rightarrow A + e^-\]
con
\[\Delta E = E_f -E_i = IP_A = - EA_A \label {9-71}\]
Como anteriormente, los mejores valores para afinidades electrónicas se obtienen calculando la diferencia en la energía de unión total entre un anión y un átomo neutro.