6.1: La perspectiva termodinámica
- Page ID
- 74407
La termodinámica clásica no considera las características atómicas y moleculares de la materia. Al desarrollarlo, nos enfocamos exclusivamente en las propiedades medibles de las cantidades macroscópicas de materia. En particular, estudiamos la relación entre las funciones termodinámicas que caracterizan a un sistema y los incrementos de calor y trabajo que recibe el sistema a medida que experimenta algún cambio de estado. Al hacerlo, adoptamos algunas perspectivas particulares. El primero es imaginar que podemos segregar la muestra macroscópica que queremos estudiar del resto del universo. Como se esboza en la Figura 1, suponemos que podemos dividir el universo en dos piezas mutuamente excluyentes: el sistema que estamos estudiando y el entorno, que tomamos para abarcar todo lo demás.
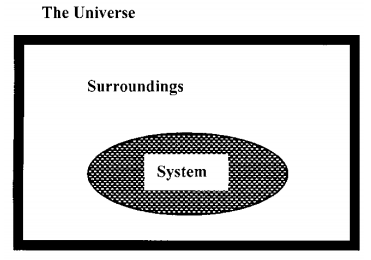
Imaginamos que el sistema está encerrado por un límite, que puede corresponder o no a una barrera material que rodea la colección de materia que designamos como sistema. (Para nuestros fines, un sistema contendrá siempre una cantidad macroscópica de materia. Sin embargo, esto no es necesario; los principios termodinámicos pueden aplicarse a un volumen que está ocupado únicamente por la energía radiante). Todo dentro del límite es parte del sistema. Todo lo que está fuera del límite es parte de los alrededoresalrededores. Cada incremento de energía que recibe el sistema, ya sea como calor o trabajo, se le pasa desde los alrededores, y a la inversa.
Un sistema abierto puede intercambiar materia y energía con su entorno. Un sistema cerrado puede intercambiar energía pero no importar con su entorno. Un sistema aislado no puede intercambiar ni materia ni energía.
Juntos, el sistema y el entorno comprenden el universo, termodinámico.
Si somos demasiado literales, esta referencia al “universo” puede comenzar con rumiaciones innecesarias sobre implicaciones cosmológicas. Todo lo que realmente tenemos en mente es un esquema de contabilidad energética, al igual que el sistema de contabilidad de contabilidad de doble entrada, en el que cada débito de una cuenta es un crédito a otra. Cuando hablamos de “el universo”, en realidad solo estamos llamando la atención sobre el hecho de que nuestro esquema involucra solo dos cuentas. Uno está etiquetado como “sistema” y el otro está etiquetado como “entorno”. Dado que hacemos nuestra contabilidad un sistema a la vez, la combinación de sistema y entorno abarca el universo de las cosas afectadas por el cambio.
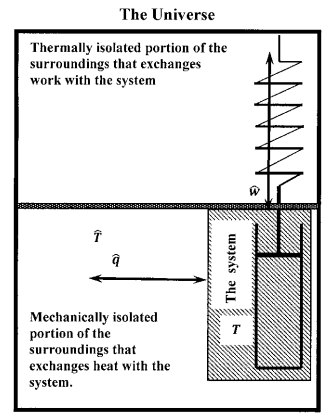
La Figura 2 representa esquemáticamente un sistema cerrado que puede intercambiar calor y trabajar con su entorno. El entorno comprende un depósito de calor y un dispositivo que puede convertir la energía potencial en el entorno en trabajo intercambiado con el sistema. El depósito de calor puede intercambiar calor pero no funcionar con el sistema. En este boceto, el reservorio de calor se encuentra a una temperatura constante,\(\widehat{T\ }\left({=T}_{surroundings}\right)\). Podría comprender, por ejemplo, una gran cantidad de hielo y agua en equilibrio de fases. El dispositivo generador de trabajo no puede intercambiar calor, pero puede intercambiar trabajo con el sistema. Un resorte parcialmente extendido representa la energía potencial disponible en los alrededores. El sistema puede hacer el trabajo en el dispositivo y aumentar la energía potencial del resorte. Alternativamente, el entorno puede transferir energía al sistema a expensas de la energía potencial del resorte. Dado que nada más en el resto del universo se ve afectado por estos intercambios, nuestro boceto abarca todo el universo en lo que respecta a estos cambios. Se aísla un sistema que no puede interactuar con nada externo a sí mismo. La combinación de sistema y entorno representada en la Figura 2 es en sí misma un sistema aislado.
Cuando nos ocupamos del cambio de entropía que acompaña a algún cambio en el estado del sistema, las propiedades del entorno adquieren importancia. Desarrollamos la razón de esto en el Capítulo 9. Es útil introducir notación para distinguir las propiedades del entorno de las propiedades del sistema. En la Figura 2, indicamos las temperaturas del sistema y alrededores por\(T\) y\(\hat{T}\), respectivamente. Adoptamos esta regla general:
Cuando aparece una cantidad termodinámica con un caret superíndice, la cantidad es la del entorno. Si no hay un caret superíndice, la cantidad es la del sistema.
Así,\(\hat{T}\)\(\hat{E}\), y\(\hat{S}\) son la temperatura, la energía, y la entropía del entorno, respectivamente, mientras que\(T\)\(E\), y\(S\) son las cantidades correspondientes para el sistema.
Desarrollamos termodinámica razonando sobre sistemas químicos cerrados que constan de una o más fases homogéneas. Una fase puede ser un sólido, un líquido o un gas. Una fase puede consistir en una sola sustancia química, o puede ser una solución homogénea que contenga dos o más sustancias químicas. Cuando decimos que una fase es homogénea, queremos decir que la presión, temperatura y composición de la fase son las mismas en cada parte de la fase. Dado que los gases son siempre miscibles, un sistema no puede contener dos fases gaseosas que estén en contacto entre sí. Sin embargo, pueden coexistir múltiples fases sólidas e inmiscibles-líquidas.


