3.1: El calor, el trabajo y la primera ley
- Page ID
- 78058
El cuadro de abajo da dos formas de la primera ley de la termodinámica.
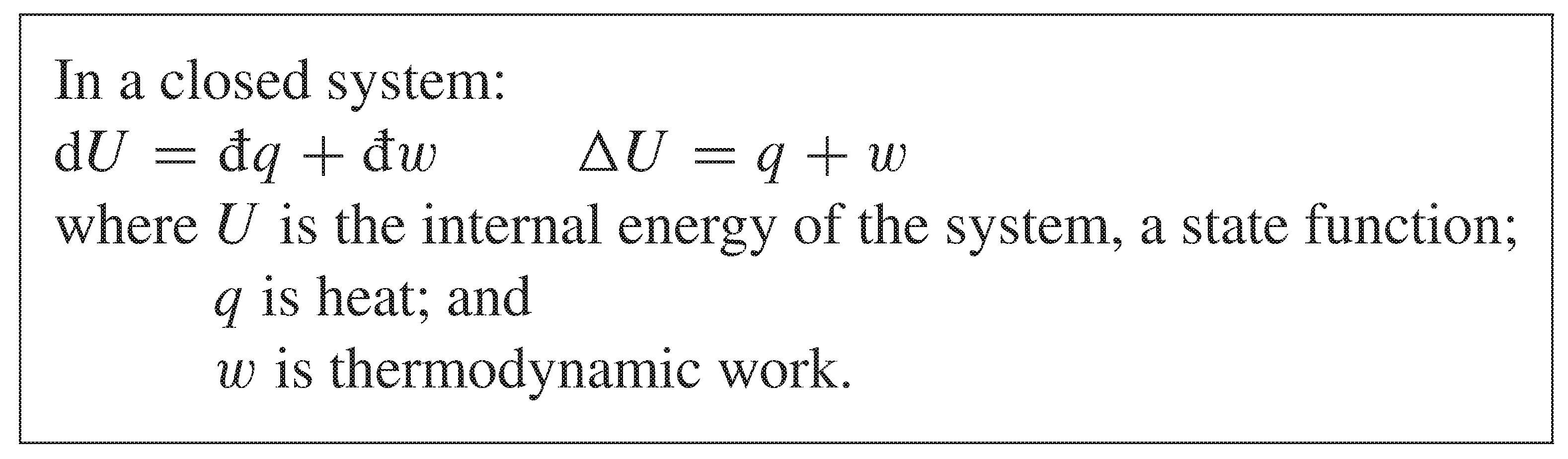
La ecuación\(\dif U=\dq+\dw\) es la forma diferencial de la primera ley, y\(\Del U=q+w\) es la forma integrada.
El calor y el trabajo que aparecen en la primera ley son dos modos diferentes de transferencia de energía. Se pueden definir de manera general de la siguiente manera.
- Se escribe una cantidad infinitesimal de energía transferida como calor en un elemento superficial del límite\(\dq\), y se escribe una cantidad finita\(q\) (Sec. 2.5). Para obtener el calor finito total para un proceso a partir de\(q=\int\!\dq\) (Ec. 2.5.3), debemos integrar sobre la superficie límite total y toda la trayectoria del proceso.
Una cantidad infinitesimal de obra es\(\dw\), y una cantidad finita lo es\(w=\int\!\dw\). Para obtener\(w\) para un proceso, integramos todo tipo de trabajo a lo largo de todo el camino del proceso.
La ecuación de primera ley\(\Del U=q+w\) establece un balance de la energía del sistema, medida en el marco local, al equiparar su cambio durante un proceso con la cantidad neta de energía transferida por medio de calor y trabajo. Tenga en cuenta que la ecuación se aplica únicamente a un sistema cerrado. Si el sistema está abierto, la energía también puede ser traída a través de la frontera por el transporte de la materia.
Una parte importante de la primera ley es la idea de que el calor y el trabajo son transferencias cuantitativas de energía. Es decir, cuando una cierta cantidad de energía ingresa al sistema en forma de calor, la misma cantidad sale del entorno. Cuando los alrededores realizan trabajos sobre el sistema, el incremento en la energía del sistema es igual en magnitud a la disminución de la energía del entorno. Se obedece el principio de conservación de la energía: la energía total (la suma de las energías del sistema y del entorno) se mantiene constante a lo largo del tiempo.
Estrictamente hablando, es la suma de las energías del sistema, el entorno, y cualquier energía potencial compartida por ambos lo que es constante. La energía potencial compartida suele ser insignificante o esencialmente constante (Sec. G.5).
La transferencia de calor puede ocurrir por conducción, convección o radiación. (Algunos termodinámicos tratan la radiación como una contribución separada a\(\Del U\), además de\(q\) y\(w\).) Podemos reducir la conducción con un buen aislamiento térmico en el límite, podemos eliminar la conducción y convección con un hueco de vacío, y podemos minimizar la radiación con superficies altamente reflectantes a ambos lados del hueco de vacío. La única manera de evitar completamente el calor durante un proceso es organizar las condiciones en el entorno para que no haya gradiente de temperatura en ninguna parte del límite. Bajo estas condiciones el proceso es adiabático, y cualquier transferencia de energía en un sistema cerrado es entonces únicamente por medio de trabajo.
3.1.1 El concepto de trabajo termodinámico
El Apéndice G da un análisis detallado de la energía y el trabajo basado en el comportamiento de una colección de partículas interactuantes que se mueven de acuerdo con los principios de la mecánica clásica. El análisis muestra cómo se debe evaluar el trabajo termodinámico mecánico. Supongamos que el desplazamiento responsable del trabajo proviene del movimiento lineal de una porción del límite en la\(-x\) dirección\(+x\) o del marco local. Las formas diferenciales e integradas de la obra son dadas entonces por\ begin {ecuación}\ dw=F\ sur_x\ dx\ qquad w=\ int_ {x_1} ^ {x_2}\! \! F\ sur_x\ dx\ tag {3.1.1}\ end {ecuación} (Estas ecuaciones son la Eq. G.6.11 con un cambio de notación.) Aquí\(F\sur_x\) está el componente en la\(+x\) dirección de la fuerza ejercida por los alrededores sobre el sistema en la porción móvil del límite, y\(\dx\) es el desplazamiento infinitesimal del límite en el marco local. Si el desplazamiento es en la misma dirección que la fuerza,\(\dw\) es positivo; si el desplazamiento es en sentido contrario,\(\dw\) es negativo.
El tipo de fuerza que representa\(F\sur_x\) es una fuerza de contacto de corto alcance. El apéndice G muestra que la fuerza ejercida por un campo externo conservador independiente del tiempo, como una fuerza gravitacional, no debe incluirse como parte de\(F\sur_x\). Esto se debe a que el trabajo realizado por este tipo de fuerza provoca cambios de energías potenciales y cinéticas que son iguales y opuestas en signo, sin efecto neto sobre la energía interna (ver Sec. 3.6).
La tercera ley de acción y reacción de Newton dice que una fuerza ejercida por el entorno sobre el sistema se opone a una fuerza de igual magnitud ejercida en dirección opuesta por el sistema sobre el entorno. Así las expresiones en la Ecuación 3.1.1 pueden ser reemplazadas por\ begin {ecuación}\ dw=-F\ sups {sys} _x\ dx\ qquad w=-\ int_ {x_1} ^ {x_2}\! \! F\ sups {sys} _x\ dx\ tag {3.1.2}\ end {ecuación} donde\(F\sups{sys}_x\) está el componente en la\(+x\) dirección de la fuerza de contacto ejercida por el sistema sobre los alrededores en la porción móvil del límite.
Una alternativa al uso de las expresiones en las ecuaciones 3.1.1 o 3.1.2 para evaluar\(w\) es imaginar que el único efecto del trabajo en el entorno del sistema es un cambio en la elevación de un peso en el entorno. El peso debe ser uno que esté vinculado mecánicamente a la fuente de la fuerza\(F\sur_x\). Luego, siempre que el marco local sea un marco de laboratorio estacionario, el trabajo sea igual en magnitud y opuesto en signo al cambio en la energía potencial del peso:\(w = -mg\Del h\) dónde\(m\) está la masa del peso,\(g\) es la aceleración de la caída libre y\(h\) es la elevación del peso en el marco de laboratorio . Esta interpretación del trabajo puede ser útil para ver si se produce el trabajo y para decidir sobre su signo, pero por supuesto no puede ser utilizada para determinar su valor si el entorno real no incluye tal peso.
El procedimiento de evaluación\(w\) a partir del cambio de la energía potencial de un peso externo requiere que este cambio sea el único efecto mecánico del proceso sobre el entorno, condición que en la práctica se cumple sólo aproximadamente. Por ejemplo, el experimento de rueda de paletas de Joule usando dos pesos vinculados al sistema por cuerdas y poleas, descritas en la Sec.3.7.2, requirió correcciones para (1) la energía cinética ganada por los pesos a medida que se hundieron, (2) fricción en los cojinetes de las poleas y (3) elasticidad de las cuerdas (ver Prob. 3.10).
En la relación de primera ley\(\Del U=q+w\), las cantidades\(\Del U\)\(q\), y todas\(w\) se miden en un marco local arbitrario. Podemos escribir una relación análoga para las mediciones en un marco de laboratorio estacionario:\ begin {equation}\ Del E\ sys=q\ lab+w\ lab\ tag {3.1.3}\ end {equation} Supongamos que el marco local elegido no es un marco de laboratorio, y nos resulta más conveniente medir el calor\(q\lab\) y el trabajo\(w\lab\) en un marco de laboratorio que medir\(q\) y\(w\) en el marco local. ¿Qué correcciones se necesitan para encontrar\(q\) y\(w\) en este caso?
Si los ejes cartesianos del marco local no rotan en relación con el marco de laboratorio, entonces el calor es el mismo en ambos fotogramas:\(q=q\lab\) (Sec. G.7).
Las expresiones para\(\dw\lab\) y\(w\lab\) son las mismas que las de\(\dw\) y\(w\) en las ecuaciones 3.1.1 y 3.1.2,\(\dx\) interpretándose como el desplazamiento en el marco de laboratorio. Existe una relación especialmente simple entre\(w\) y\(w\lab\) cuando el marco local es un marco de centro de masa, uno cuyo origen se mueve con el centro de masa del sistema y cuyos ejes no giran en relación con el marco de laboratorio (Eq. G.8.12):\ comenzar {ecuación} w = w\ lab -\ una mitad m\ Del\! \ left (v^2\ cm\ right) - mg\ Del z\ cm\ tag {3.1.4}\ end {ecuación} En esta ecuación\(m\) se encuentra la masa del sistema,\(v\cm\) es la velocidad de su centro de masa en el marco de laboratorio,\(g\) es la aceleración de caída libre, y\(z\cm\) es la altura del centro de masa por encima de un cero arbitrario de elevación en el marco del laboratorio. En los procesos termodinámicos típicos las cantidades\(v\cm\) y\(z\cm\) cambian solo en una medida despreciable, si acaso, de manera que por lo general a una buena aproximación\(w\) es igual a\(w\lab\).
Cuando el marco local es un marco de centro de masa, podemos combinar las relaciones\(\Del U=q+w\) y\(q=q\lab\) con las ecuaciones 3.1.3 y 3.1.4 para obtener\ begin {ecuación}\ Del E\ sys =\ Del E\ subs {k} +\ Del E\ subs {p} +\ Del U\ tag {3.1.5}\ end {ecuación} donde\(E\subs{k} = \onehalf mv^2\cm\) y\(E\subs{p} = mgz\cm\) son las energías cinéticas y potenciales de el sistema como un todo en el marco del laboratorio.
Se\(w\) puede escribir una relación más general para cualquier fotograma local que no tenga movimiento rotacional y cuyo origen tenga una aceleración insignificante en el cuadro de laboratorio (Eq. G.7.3):\ begin {equation} w = w\ lab - mg\ Del z\ subs {loc}\ tag {3.1.6}\ end {equation} Aquí\(z\subs{loc}\) está la elevación en el marco de laboratorio del origen del marco local. \(\Del z\subs{loc}\)suele ser pequeño o cero, por lo que de nuevo\(w\) es aproximadamente igual a\(w\lab\). Los únicos tipos de procesos para los que podemos necesitar usar la ecuación 3.1.4 o 3.1.6 para calcular una diferencia no despreciable entre\(w\) y\(w\lab\) son aquellos en los que partes masivas del sistema experimentan cambios sustanciales en la elevación en el marco del laboratorio.
Relaciones simples como estas entre\(q\) y\(q\lab\), y entre\(w\) y\(w\lab\), no existen si el marco local tiene movimiento de rotación en relación con un marco de laboratorio.
De aquí en adelante en este libro electrónico, el trabajo termodinámico se\(w\) llamará simplemente trabajo. Para todos los propósitos prácticos, puede asumir que los marcos locales para la mayoría de los procesos a describir son marcos de laboratorio estacionarios. La discusión anterior muestra que los valores de calor y trabajo medidos en estos marcos suelen ser los mismos, o prácticamente los mismos, como si fueran medidos en un marco local moviéndose con el centro de masa del sistema. Una excepción notable es el marco local necesario para tratar las propiedades termodinámicas de una solución líquida en una celda centrífuga. En este caso el marco local se fija en el rotor giratorio de la centrífuga y tiene movimiento rotacional. Este caso especial se discutirá en la Sec. 9.8.2.
3.1.2 Coeficientes de trabajo y coordenadas de trabajo
Si un proceso tiene solo un tipo de trabajo, se puede expresar en la forma\ begin {ecuación}\ dw = Y\ dif X\ qquad\ tx {o}\ qquad w =\ int_ {X_1} ^ {X_2}\! Y\ dif X\ tag {3.1.7}\ end {ecuación} donde\(Y\) es una fuerza generalizada llamada coeficiente de trabajo y\(X\) es un desplazamiento generalizado llamado coordenada de trabajo. El coeficiente de trabajo y la coordenada de trabajo son variables conjugadas. No son necesariamente fuerzas y desplazamientos reales. Por ejemplo, veremos en la Sec. 3.4.2 que el trabajo de expansión reversible viene dado por\(\dw=-p\dif V\); en este caso, el coeficiente de trabajo es\(-p\) y la coordenada de trabajo lo está\(V\).
Un proceso puede tener más de un tipo de trabajo, cada uno con su propio coeficiente de trabajo y coordenada de trabajo conjugada. En este caso el trabajo se puede expresar como una suma sobre los diferentes tipos etiquetados por el índice\(i\):\ begin {ecuación}\ dw =\ sum_i Y_i\ dif x_i\ qquad\ tx {o}\ qquad w =\ sum_i\ int_ {X_ {i,1}} ^ {X_ {i,2}}\! Y_i\ dif x_i\ tag {3.1.8}\ fin {ecuación}
3.1.3 Calentar y trabajar como funciones de ruta
Considera el aparato mostrado en la Fig. 3.1. El sistema consiste en el agua junto con las partes sumergidas: paletas agitadoras unidas a un eje (una rueda de paletas) y una resistencia eléctrica unida a cables. En los estados de equilibrio de este sistema, la temperatura y la presión son uniformes y la rueda de paletas es estacionaria. El sistema está abierto a la atmósfera, por lo que la presión se ve obligada a ser constante. Podemos describir los estados de equilibrio de este sistema mediante una única variable independiente, la temperatura\(T\). (La posición angular del eje es irrelevante para el estado y no es una función de estado para los estados de equilibrio de este sistema).
Aquí hay tres experimentos con diferentes procesos. Cada proceso tiene el mismo estado inicial definido por\(T_1 = 300.0\K\), y cada uno tiene el mismo estado final.
- Aunque los caminos en los tres experimentos son completamente diferentes, el cambio general de estado es el mismo. De hecho, una persona que sólo observe los estados inicial y final y no tenga conocimiento de los estados intermedios o de los cambios en el entorno será ignorante del camino. ¿Giró la rueda de paletas? ¿Pasó una corriente eléctrica a través de la resistencia? ¿Cuánta energía se transfirió por trabajo y cuánta por calor? El observador no puede distinguir por el cambio de estado, porque el calor y el trabajo no son funciones estatales. El cambio de estado depende de la suma de calor y trabajo. Esta suma es el cambio en la función estatal\(U\!\), tal como lo expresa la forma integrada de la primera ley,\(\Del U = q + w\).
De esta discusión se deduce que ni el calor ni el trabajo son cantidades que posee el sistema. Un sistema en un instante dado no tiene o contiene una cantidad particular de calor o una cantidad particular de trabajo. En cambio, el calor y el trabajo dependen de la trayectoria de un proceso que ocurre durante un período de tiempo. Son funciones de ruta.
3.1.4 Calor y calefacción
En el habla cotidiana el sustantivo calor a menudo se usa de manera algo diferente. Aquí hay tres declaraciones con significados similares que podrían ser engañosas:
“El calor se transfiere de una placa caliente de laboratorio a un vaso de precipitados de agua”.
“El calor fluye de un cuerpo más cálido a un cuerpo más frío”.
“Para eliminar el calor de un cuerpo caliente, colóquelo en agua fría”.
Declaraciones como estas pueden dar la falsa impresión de que el calor es como una sustancia que conserva su identidad a medida que se mueve de un cuerpo a otro. En realidad el calor, como el trabajo, no existe como entidad una vez que se completa un proceso. Sin embargo, la redacción de declaraciones como estas está incrustada en nuestro lenguaje cotidiano, y no se hace daño si las interpretamos correctamente. Este libro electrónico, por concisión, a menudo se refiere a “transferencia de calor” y “flujo de calor”, en lugar de usar la frase técnicamente más correcta “transferencia de energía por medio de calor”.
Otro problema común es la falta de distinción entre el “calor” termodinámico y el proceso de “calentamiento”. Calentar un sistema es hacer que su temperatura aumente. Un sistema calentado es aquel que se ha vuelto más cálido. Este proceso de calentamiento no implica necesariamente calor termodinámico; también se puede llevar a cabo con trabajos como se ilustra en los experimentos 1 y 2 de la sección anterior.
La noción de calor como sustancia indestructible fue la esencia de la teoría calórica. Esta teoría fue finalmente desmentida por los experimentos de perforación de cañones de Benjamin Thompson (Conde Rumford) a finales del siglo XVIII, y de una manera más cuantitativa por la medición del equivalente mecánico del calor por James Joule en la década de 1840 (ver Sec. 3.7.2).
3.1.5 Capacidad calorífica
La capacidad calorífica de un sistema cerrado se define como la relación de una cantidad infinitesimal de calor transferido a través del límite bajo condiciones especificadas y el cambio de temperatura infinitesimal resultante:\ begin {recopilar}\ s {\ tx {capacidad calorífica}\ defn\ frac {\ dq} {\ dif T}}\ tag {3.1.9}\ cond {(cerrado system)}\ end {recopilar} Dado que\(q\) es una función de ruta, el valor de la capacidad calorífica depende de las condiciones especificadas, generalmente ya sea volumen constante o presión constante. \(C_V\)es la capacidad calorífica a volumen constante y\(C_p\) es la capacidad calorífica a presión constante. Se trata de extensas funciones estatales que serán discutidas más a fondo en la Sec. 5.6.
3.1.6 Energía térmica
A veces es útil utilizar el concepto de energía térmica. Se puede definir como la energía cinética de los movimientos de traducción aleatorios de átomos y moléculas en relación con el marco local, más las energías vibracionales y rotacionales de las moléculas. La energía térmica de un cuerpo o fase depende de su temperatura, y aumenta cuando la temperatura aumenta. La energía térmica de un sistema es una contribución a la energía interna.
Es importante entender que un cambio de la energía térmica del sistema durante un proceso no es necesariamente lo mismo que la energía transferida a través del límite del sistema como calor. Las dos cantidades son iguales solo si el sistema está cerrado y no hay trabajo, cambio de volumen, cambio de fase o reacción química. Esto se ilustra por los tres experimentos descritos en la Sec. 3.1.3: el cambio de energía térmica es el mismo en cada experimento, pero solo en el experimento 3 es el trabajo insignificante y el cambio de energía térmica igual al calor.
- Aunque los caminos en los tres experimentos son completamente diferentes, el cambio general de estado es el mismo. De hecho, una persona que sólo observe los estados inicial y final y no tenga conocimiento de los estados intermedios o de los cambios en el entorno será ignorante del camino. ¿Giró la rueda de paletas? ¿Pasó una corriente eléctrica a través de la resistencia? ¿Cuánta energía se transfirió por trabajo y cuánta por calor? El observador no puede distinguir por el cambio de estado, porque el calor y el trabajo no son funciones estatales. El cambio de estado depende de la suma de calor y trabajo. Esta suma es el cambio en la función estatal\(U\!\), tal como lo expresa la forma integrada de la primera ley,\(\Del U = q + w\).


