9.9: Capítulo 9 Problemas
- Page ID
- 77977
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Un número de problema subrayado o una letra de parte del problema indica que la respuesta numérica aparece en el Apéndice I.
9.1 Para una solución binaria, encuentre expresiones para las fracciones molares\(x_{\mathrm{B}}\) y\(x_{\mathrm{A}}\) como funciones de la molalidad del soluto\(m_{\mathrm{B}}\).
9.2 Considerar una mezcla binaria de dos líquidos,\(\mathrm{A}\) y\(\mathrm{B}\). El volumen molar de mezcla,\(\Delta V(\mathrm{mix}) / n\), viene dado por la Ec. 9.2.19.
a) Encontrar una fórmula para calcular el valor\(\Delta V(\mathrm{mix}) / n\) de una mezcla binaria a partir de valores de\(x_{\mathrm{A}}, x_{\mathrm{B}}, M_{\mathrm{A}}, M_{\mathrm{B}}, \rho, \rho_{\mathrm{A}}^{*}\), y\(\rho_{\mathrm{B}}^{*} .\)
Tabla Volúmenes\(9.7\) molares de mezcla de mezclas binarias de 1-hexanol (A) y 1-octeno\((\mathrm{B})\) a\(25^{\circ} \mathrm{C} .^{a}\)
\ begin {tabular} {lccc}
\ hline\(x_{\mathrm{B}}\) & {\([\Delta V(\mathrm{mix}) / n] / \mathrm{cm}^{3} \mathrm{~mol}^{-1}\)} &\(x_{\mathrm{B}}\) & {\([\Delta V(\mathrm{mix}) / n] / \mathrm{cm}^{3} \mathrm{~mol}^{-1}\)}\\
\ hline 0 & 0 &\(0.555\) &\(0.005\)\\
\(0.049\) & &\(-0.027\) &\(0.597\) &\(0.011\)\\
\(0.097\) & \(-0.050\)&\(0.702\) &\(0.029\) &
\(0.146\) &\(-0.063\) &\(0.716\) &\(0.035\) & &
\(0.199\) &\(-0.077\) &\(0.751\)\(0.048\) & &
\(0.235\) &\(-0.073\) &\(0.803\) & \(0.056\)\\
\(0.284\) &\(-0.074\) &\(0.846\) & &\(0.058\)
\(0.343\) & &\(-0.065\) & &\(0.897\) & &\(0.057\)
\(0.388\) & &\(-0.053\) &\(0.944\) &\(0.049\)\\
\(0.448\) & amp;\(-0.032\) & 1 & 0\\
\(0.491\) &\(-0.016\) & & &\
\\ hline
\ end {tabular}
\({ }^{a}\) Ref. [170].
b) Los volúmenes molares de mezcla para mezclas binarias líquidas de 1-hexanol (A) y 1-octeno (B) at se\(25^{\circ} \mathrm{C}\) han calculado a partir de sus densidades medidas. Los datos se encuentran en el Cuadro 9.7. Los volúmenes molares de los constituyentes puros son\(V_{\mathrm{A}}^{*}=125.31 \mathrm{~cm}^{3} \mathrm{~mol}^{-1}\) y\(V_{\mathrm{B}}^{*}=\)\(157.85 \mathrm{~cm}^{3} \mathrm{~mol}^{-1}\). Utilizar el método de intercepciones para estimar los volúmenes molares parciales de ambos constituyentes en una mezcla equimolar\(\left(x_{\mathrm{A}}=x_{\mathrm{B}}=0.5\right)\), y el volumen molar parcial\(V_{\mathrm{B}}^{\infty}\) de B a dilución infinita.
9.3 Extender la derivación de Prob. 8.1, relativa a una gotita líquida de radio\(r\) suspendida en un gas, al caso en que el líquido y el gas sean ambos mezclas. Mostrar que las condiciones de equilibrio son\(T^{\mathrm{g}}=T^{\mathrm{l}}, \mu_{i}^{\mathrm{g}}=\mu_{i}^{1}\) (para cada especie\(i\) que puede equilibrarse entre las dos fases), y\(p^{1}=p^{g}+2 \gamma / r\), donde\(\gamma\) está la tensión superficial. (Al igual que en la Prob. 8.1, la última relación es la ecuación de Laplace.)
9.4 Considerar una mezcla gaseosa\(4.0000 \times 10^{-2} \mathrm{~mol}\) de\(\mathrm{N}_{2}\) (A) y\(4.0000 \times 10^{-2} \mathrm{~mol}\) de\(\mathrm{CO}_{2}\) (B) en un volumen de\(1.0000 \times 10^{-3} \mathrm{~m}^{3}\) a una temperatura de\(298.15 \mathrm{~K}\). Los segundos coeficientes viriales a esta temperatura tienen los valores\({ }^{14}\)
\ [
\ begin {aligned}
B_ {\ mathrm {AA}} &=-4.8\ times 10^ {-6}\ mathrm {~m} ^ {3}\ mathrm {~mol} ^ {-1}\\
B_ {\ mathrm {BB}} &=-124.5\ times 10^ {-6}\ mathrm {~m} ^ {3}\ mathrm {~m} ^ {3}\ mathrm {~m} ^ {3}\ mathrm {~mol} ^ {-1}\\
B_ {\ mathrm {AB}} &=-47.5\ times 10^ {-6}\ mathrm {~m} ^ {3}\ mathrm {~mol} ^ {-1}
\ end {alineado}
\]
Compara la presión de la mezcla de gases reales con la predicha por la ecuación de gas ideal. Ver Ecuaciones 9.3.20 y 9.3.23.
\({ }^{14}\)Refs. [3], [49], y [50].
9.5 At\(25^{\circ} \mathrm{C}\) y 1 bar, las constantes de la ley de Henry de nitrógeno y oxígeno disueltos en el agua son\(k_{\mathrm{H}, \mathrm{N}_{2}}=8.64 \times 10^{4}\) bar y\(k_{\mathrm{H}, \mathrm{O}_{2}}=4.41 \times 10^{4}\) bar. \({ }^{15}\)La presión de vapor del agua a esta temperatura y presión es\(p_{\mathrm{H}_{2} \mathrm{O}}=0.032\) bar. Supongamos que el aire seco contiene solo\(\mathrm{N}_{2}\) y\(\mathrm{O}_{2}\) en fracciones molares\(y_{\mathrm{N}_{2}}=0.788\) y\(y_{\mathrm{O}_{2}}=0.212\). Considere los sistemas líquido-gas formados equilibrando agua líquida y aire en\(25^{\circ} \mathrm{C}\) y\(1.000 \mathrm{bar}\), y asuma que la fase gaseosa se comporta como una mezcla de gases ideal.
Sugerencia: La suma de las presiones parciales de\(\mathrm{N}_{2}\) y\(\mathrm{O}_{2}\) debe ser\((1.000-0.032)\) bar\(=0.968\) bar. Si el volumen de una de las fases es mucho mayor que el de la otra, entonces casi todo el\(\mathrm{N}_{2}\) y\(\mathrm{O}_{2}\) estará en la fase predominante y la relación de sus cantidades en esta fase debe ser prácticamente la misma que en el aire seco.
Determinar las fracciones molares de\(\mathrm{N}_{2}\) y\(\mathrm{O}_{2}\) en ambas fases en los siguientes casos limitantes:
(a) Un gran volumen de aire se equilibre con suficiente agua para dejar una pequeña gota de líquido.
b) Un gran volumen de agua se equilibre con suficiente aire para dejar una pequeña burbuja de gas.
9.6 Derivar la expresión para\(\gamma_{m, \mathrm{~B}}\) dada en el Cuadro 9.4, comenzando con la Ec. 9.5.18.
9.7 Considerar una mezcla gaseosa binaria no ideal con la ecuación simple de estado\(V=n R T / p+n B\) (Ec. \(9.3 .21\)).
a) La regla de Lewis y Randall establece que el valor del segundo coeficiente virial mixto\(B_{\mathrm{AB}}\) es el promedio de\(B_{\mathrm{AA}}\) y\(B_{\mathrm{BB}}\). Demostrar que cuando esta regla se mantiene, el coeficiente de fugacidad de\(\mathrm{A}\) en una mezcla gaseosa binaria de cualquier composición viene dada por\(\ln \phi_{\mathrm{A}}=B_{\mathrm{AA}} p / R T\). Al comparar esta expresión con la Ec. \(7.8 .18\)para un gas puro, expresar la fugacidad de\(\mathrm{A}\) en la mezcla como una función de la fugacidad de puro\(A\) a la misma temperatura y presión que la mezcla.
b) La regla de Lewis y Randall no se obedece con precisión cuando los constituyentes A y B son químicamente diferentes. Por ejemplo, at\(298.15 \mathrm{~K}\), los segundos coeficientes viriales de\(\mathrm{H}_{2} \mathrm{O}\) (A) y\(\mathrm{N}_{2}\) (B) son\(B_{\mathrm{AA}}=-1158 \mathrm{~cm}^{3} \mathrm{~mol}^{-1}\) y\(B_{\mathrm{BB}}=-5 \mathrm{~cm}^{3} \mathrm{~mol}^{-1}\), respectivamente, mientras que el segundo coeficiente virial mixto lo es\(B_{\mathrm{AB}}=-40 \mathrm{~cm}^{3} \mathrm{~mol}^{-1}\).
Cuando el agua líquida se equilibre con nitrógeno a\(298.15 \mathrm{~K}\) y 1 bar, la presión parcial de\(\mathrm{H}_{2} \mathrm{O}\) en la fase gaseosa es\(p_{\mathrm{A}}=0.03185\) bar. Utilice los valores dados de\(B_{\mathrm{AA}}, B_{\mathrm{BB}}\), y\(B_{\mathrm{AB}}\) para calcular la fugacidad del gaseoso\(\mathrm{H}_{2} \mathrm{O}\) en esta mezcla binaria. Comparar esta fugacidad con la fugacidad calculada con el valor de\(B_{\mathrm{AB}}\) predicho por la regla de Lewis y Randall.
Cuadro Coeficiente de\(9.8\) actividad del benceno (A) en mezclas de benceno y 1-octanol at\(20^{\circ} \mathrm{C}\). El estado de referencia
es el líquido puro.
\ begin {tabular} {lccc}
\ hline\(x_{\mathrm{A}}\) & &\(\gamma_{\mathrm{A}}\)\(x_{\mathrm{A}}\) &\(\gamma_{\mathrm{A}}\)\\
\ hline 0 & &\(2.0^{a}\) &\(0.7631\) & &\(1.183\)\\
\(0.1334\) &\(1.915\) &\(0.8474\) &\(1.101\)\\
\(0.2381\) & amp;\(1.809\) &\(0.9174\) &\(1.046\)\\
\(0.4131\) &\(1.594\) &\(0.9782\) & &\(1.005\)\\\
\(0.5805\)\(1.370\) & & &\
\\ hline\ multicolumna {3} {l} {\(a_{\text {extrapolated }}\)}
\ final {tabular}
\({ }^{15}\)Ref. [184].
9.8 El benceno y el 1-octanol son dos líquidos que se mezclan en todas las proporciones. El benceno tiene una presión de vapor medible, mientras que el 1-octanol es prácticamente no volátil. Los datos de la Tabla de la\(9.8\) página anterior fueron obtenidos por Platford\({ }^{16}\) utilizando el método isopiéstico de presión de vapor.
(a) Utilizar la integración numérica para evaluar la integral en el lado derecho de la Ec. \(9.6 .10\)en cada uno de los valores de\(x_{\mathrm{A}}\) enumerados en la tabla, y así encontrar\(\gamma_{\mathrm{B}}\) en estas composiciones.
(b) Dibujar dos curvas en la misma gráfica mostrando las fracciones molares efectivas\(\gamma_{\mathrm{A}} x_{\mathrm{A}}\) y\(\gamma_{\mathrm{B}} x_{\mathrm{B}}\) como funciones de\(x_{\mathrm{A}}\). ¿Las desviaciones del comportamiento ideal-mezcla son positivas o negativas?
Tabla Composiciones\(9.9\) líquidas y gaseosas en el sistema bifásico de metanol (A) y benceno (B) a\(45^{\circ} \mathrm{C}^{a}\)
\ begin {tabular} {llllll}
\ hline\(x_{\mathrm{A}}\) &\(y_{\mathrm{A}}\) &\(p / \mathrm{kPa}\) &\(x_{\mathrm{A}}\) &\(y_{\mathrm{A}}\) &\(p / \mathrm{kPa}\)\
\ hline 0 & 0 & &\(29.894\) &\(0.4201\) &\(0.5590\) & &
\(0.0207\) &\(60.015\)\\(0.2794\) & \(40.962\)&\(0.5420\)\(0.5783\) &\(60.416\) &
\(0.0314\) &\(0.3391\) &\(44.231\) &\(0.6164\) &\(0.5908\)\(60.416\) & &
\(0.0431\) &\(0.3794\)\(46.832\) &\(0.7259\) &\(0.6216\) & \(59.868\)\\
\(0.0613\) & &\(0.4306\) &\(50.488\) & &\(0.8171\) &\(0.6681\) & & &\(58.321\)
\(0.0854\) & &\(0.4642\) &\(53.224\) & &\(0.9033\) &\(0.7525\) & & &\(54.692\)
\(0.1811\) & & \(0.5171\)&\(57.454\) &\(0.9497\) &\(0.8368\) &\(51.009\)\\
\(0.3217\) &\(0.5450\) &\(59.402\) & & 1 &\(44.608\)\\
\ hline
\ end {tabular}
\({ }^{a}\)Ref. [169].
9.9 La tabla\(9.9\) enumera los valores medidos de la composición en fase gaseosa y la presión total para el sistema binario bifásico metanol-benceno a temperatura constante y composición variada en fase líquida. \(x_{\mathrm{A}}\)es la fracción molar de metanol en la mezcla líquida, y\(y_{\mathrm{A}}\) es la fracción molar de metanol en la fase gaseosa equilibrada.
a) Para cada una de las 16 diferentes composiciones en fase líquida, tabular las presiones parciales de\(\mathrm{A}\) y\(\mathrm{B}\) en la fase gaseosa equilibrada.
b) Trazar\(p_{\mathrm{A}}\) y\(p_{\mathrm{B}}\) versus\(x_{\mathrm{A}}\) en la misma gráfica. Observe que el comportamiento de la mezcla está lejos del de una mezcla ideal. ¿Las desviaciones de la ley de Raoult son positivas o negativas?
c) Tabular y graficar el coeficiente\(\gamma_{\mathrm{B}}\) de actividad del benceno en función del\(x_{\mathrm{A}}\) uso de un estado de referencia de líquido puro. Supongamos que la fugacidad\(f_{\mathrm{B}}\) es igual a\(p_{\mathrm{B}}\), e ignora los efectos de la presión variable.
(d) Estimar la constante de la ley\(k_{\mathrm{H}, \mathrm{A}}\) de Henry del metanol en el ambiente bencénico\(45^{\circ} \mathrm{C}\) mediante el método gráfico sugerido en la Fig. 9.7 (b). De nuevo asumir que\(f_{\mathrm{A}}\) y\(p_{\mathrm{A}}\) son iguales, e ignorar los efectos de la presión variable.
9.10 Considerar una solución diluida binaria no electrolítica en la que la dependencia del potencial químico del soluto B en la composición viene dada por
\ [\ mu_ {\ mathrm {B}} =\ mu_ {m,\ mathrm {~B}} ^ {\ mathrm {ref}} +R T\ ln\ frac {m_ {\ mathrm {B}}} {m^ {\ circ} +kk_ {m} m_ {\ mathrm {B}}
\]
donde\(\mu_{m, \mathrm{~B}}^{\mathrm{ref}}\) y\(k_{m}\) son constantes a un dado\(T\) y\(p\). (La derivación de esta ecuación se esboza en la Sec. 9.5.4.) Utilice la ecuación de Gibbs-Duhem en la forma\(\mathrm{d} \mu_{\mathrm{A}}=-\left(n_{\mathrm{B}} / n_{\mathrm{A}}\right) \mathrm{d} \mu_{\mathrm{B}}\) para obtener una expresión para\(\mu_{\mathrm{A}}-\mu_{\mathrm{A}}^{*}\) como una función de\(m_{\mathrm{B}}\) en esta solución.
\({ }^{16}\)Ref. [145].
9.11 Por medio de la técnica de presión de vapor isopiéstico, los coeficientes osmóticos de soluciones acuosas de urea en se\(25^{\circ} \mathrm{C}\) han medido a molalidades hasta el límite de saturación de aproximadamente\(20 \mathrm{~mol} \mathrm{~kg}^{-1} .{ }^{17}\) Los valores experimentales se aproximan estrechamente por la función
\ [
\ phi_ {m} =1.00-\ frac {0.050 m_ {\ mathrm {B}}/m^ {\ circ}} {1.00+0.179 m_ {\ mathrm {B}}/m^ {\ circ}}
\]
donde\(m^{\circ}\) esta\(1 \mathrm{~mol} \mathrm{~kg}^{-1}\). Calcular los valores de los coeficientes de actividad solvente y soluto\(\gamma_{\mathrm{A}}\) y\(\gamma_{m, \mathrm{~B}}\) a diversas molalidades en el rango\(0-20 \mathrm{~mol} \mathrm{~kg}^{-1}\), y graficarlos versus\(m_{\mathrm{B}} / m^{\circ}\). Usa suficientes puntos para poder ver las formas de las curvas. ¿Cuáles son las pendientes limitantes de estas curvas a medida que\(m_{\mathrm{B}}\) se acerca a cero?
9.12 Usar la Eq. \(9.2 .49\)para derivar una expresión para la velocidad a la que el logaritmo del coeficiente de actividad del componente\(i\) de una mezcla líquida cambia con la presión a temperatura y composición constantes:\(\left(\partial \ln \gamma_{i} / \partial p\right)_{T,\left\{n_{i}\right\}}=\)?
9.13 Supongamos que a nivel del mar la atmósfera tiene una presión de\(1.00\) bar y una composición dada por\(y_{\mathrm{N}_{2}}=0.788\) y\(y_{\mathrm{O}_{2}}=0.212\). Encontrar las presiones parciales y fracciones molares de\(\mathrm{N}_{2}\) y\(\mathrm{O}_{2}\), y la presión total, a una altitud de\(10.0 \mathrm{~km}\), haciendo la aproximación (drástica) de que la atmósfera es una mezcla de gases ideal en un estado de equilibrio en\(0^{\circ} \mathrm{C}\). Para\(g\) utilizar el valor de la aceleración estándar de caída libre que figura en el Apéndice B.
9.14 Considera una columna alta de una solución líquida binaria diluida en equilibrio en un campo gravitacional.
(a) Derivar una expresión para\(\ln \left[c_{\mathrm{B}}(h) / c_{\mathrm{B}}(0)\right]\), donde\(c_{\mathrm{B}}(h)\) y\(c_{\mathrm{B}}(0)\) son las concentraciones de soluto a elevaciones\(h\) y 0. Su expresión debe ser una función de\(h, M_{\mathrm{B}}, T, \rho\), y el volumen específico parcial del soluto a dilución infinita,\(v_{\mathrm{B}}^{\infty}\). Para la dependencia de la presión sobre la elevación, puede usar la fórmula hidrostática\(\mathrm{d} p=-\rho g \mathrm{~d} h\) (Eq. \(8.1 .14\)en la página 200) y supongamos que la densidad de la solución\(\rho\) es la misma en todas las elevaciones. Sugerencia: utilizar la derivación que conduce a la Ec. \(9.8 .22\)como guía.
(b) Supongamos que tiene un recipiente alto que contiene una solución diluida de una macromolécula soluto de masa molar\(M_{\mathrm{B}}=10.0 \mathrm{~kg} \mathrm{~mol}^{-1}\) y volumen específico parcial\(v_{\mathrm{B}}^{\infty}=0.78 \mathrm{~cm}^{3} \mathrm{~g}^{-1}\). La densidad de la solución es\(\rho=1.00 \mathrm{~g} \mathrm{~cm}^{-3}\) y la temperatura es\(T=300 \mathrm{~K}\). Encontrar la altura\(h\) desde el fondo del vaso a la que, en estado de equilibrio, la concentración\(c_{\mathrm{B}}\) ha disminuido al 99 por ciento de la concentración en el fondo.
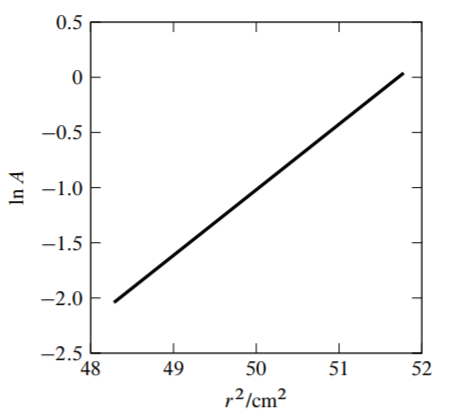
9.15 fHua es una proteína que se encuentra en la membrana externa de la bacteria Escherichia coli. A partir de la secuencia de aminoácidos conocida, se calcula que su masa molar sea\(78.804 \mathrm{~kg} \mathrm{~mol}^{-1}\). En solución acuosa, las moléculas del detergente dodecil maltósido se unen a una molécula de FhuA para formar un agregado que se comporta como una sola especie de soluto. La figura\(9.13\) de la siguiente página muestra los datos recopilados en un experimento de equilibrio de sedimentación con una solución diluida del agregado. \({ }^{18}\)En la gráfica,\(A\) se encuentra la absorbancia medida a una longitud de onda de\(280 \mathrm{~nm}\) (una propiedad que es una función lineal de la concentración agregada) y\(r\) es la distancia radial desde el eje de rotación del rotor centrífugo. Los puntos experimentales caen muy cerca de la línea recta que se muestra en la gráfica. Las condiciones de sedimentación fueron\(\omega=838 \mathrm{~s}^{-1}\) y\(T=293 \mathrm{~K}\). Los autores utilizaron los valores\(v_{\mathrm{B}}^{\infty}=0.776 \mathrm{~cm}^{3} \mathrm{~g}^{-1}\) y\(\rho=1.004 \mathrm{~g} \mathrm{~cm}^{-3}\).
(a) Los valores\(r\) a los que se midió la absorbancia oscilan entre\(6.95 \mathrm{~cm}\) y\(7.20 \mathrm{~cm}\). Encuentra la diferencia de presión en la solución entre estas dos posiciones.
(b) Encontrar la masa molar de la especie de soluto agregado y utilizarla para estimar la relación de unión de masa (la masa del detergente unido dividida por la masa de proteína).
\({ }^{17}\)Ref. [160]. \({ }^{18}\)Ref. [18].